文献分享# 新冠病毒(SARS-CoV-2)利用人类ACE2受体进入细胞的结构基础
浏览次数:334
|
NO.1 研究背景
最近在中国出现的新型冠状病毒(SARS-CoV-2)引起了公众的极大关注。最近,据报道ACE2是SARS-CoV-2的进入受体。
近日,《Cell》在线发表“Structural and functional basis of SARS-CoV-2 entry by using human ACE2, Cell, DOI: 10.1016/j.cell.2020.03.045”。该研究是中科院微生物研究所严景华研究员和齐建勋研究员联合团队最新成果。
 特殊疫情原因,为了让人们尽快知晓最新研究情况。论文已被接受,但还有一些细节没有得到最终敲定。
作者声明:
这是接受的同行评审文章的PDF文件,但尚未正式记录。这个版本在最终版本发布之前,我们将对其进行额外的复制编辑,排版和审阅,但我们将提供此版本以使文章更早可见。请注意,在生产过程中,可能会发现可能影响内容的错误,并且适用于该期刊的所有法律免责声明均适用。
.png) NO.2
研究结果
在这项研究中,作者提出了SARS-CoV-2(SARS-CoV-2-CTD)穗状蛋白(S)蛋白与人ACE2(hACE2)结合的C端结构域的晶体结构,揭示了hACE2结合模式总体上与SARS-CoV相似。但是,结合界面上的原子细节表明,SARS-CoV-2-CTD中的关键残基置换加强了相互作用,并导致与SARS-RBD相比具有更高的受体结合亲和力。此外,一组针对SARS-CoV50 S1 /受体结合结构域(RBD)的鼠单克隆抗体(mAbs)和多克隆抗体(pAbs)无法与SARS-CoV-2 S蛋白相互作用,表明SARS-CoV和SARS-CoV-2在抗原性上存在显著差异。这些发现为病毒发病机理的研究提供了线索,并提供了关于开发针对这种新兴病毒的54种对策的53种重要结构信息。
.png) .png) figure2. SARS-CoV-2和hACE2之间的复杂结构
研究人员发现新冠病毒S蛋白的S1区域C端,正是与ACE2结合的关键。后经验证,如果将ACE2蛋白上的关键氨基酸K353进行突变,就足以破坏病毒蛋白和受体的结合。
 figure 3.
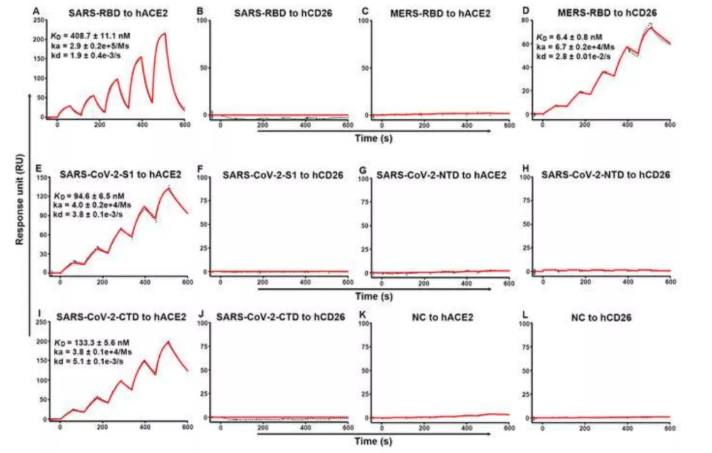 figure 4.
SARS-CoV-2-S1 / CTD与hACE2之间的相互作用是特异性的。发现新冠病毒的受体结合力,其亲和力是SARS-RBD(SARS病毒)的4倍。
上海优宁维生物科技股份有限公司 |
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:www.univ-bio.com
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!




 搜索
搜索




.jpg)


 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
 营业执照(三证合一)
营业执照(三证合一)