免疫检查点抑制剂为尿路上皮癌(UC)患者的治疗带来了新的希望,目前已有多种候选免疫生物标记物,例如PD-L1的表达和肿瘤突变负荷(TMB),可以用于预测UC免疫治疗的反应。然而,这些生物标志物并不完善,缺乏足够的临床应用预测能力。为了更好地了解UC中的免疫治疗反应,需要全面概述肿瘤免疫微环境,包括三级淋巴结构(TLS)。特别是UC肿瘤免疫微环境中的免疫细胞与TLS之间复杂的相互作用仍然知之甚少,这阻碍了新型癌症免疫疗法以及免疫疗法反应的预测性生物标志物的发现和开发,因此迫切需要更好地表征肿瘤免疫环境。
来自荷兰肿瘤研究所的团队使用HALO平台对多重免疫荧光染色的肿瘤切片进行了全景观分析,以表征未经预处理的肿瘤和术前抗PD1/CTLA-4检查点抑制剂的肿瘤中不同肿瘤区室中的免疫细胞亚群。
1 UC患者肿瘤内免疫细胞亚群的异质性分析
为了综合评估UC患者肿瘤免疫微环境,对仅进行前期膀胱切除术而未进行治疗(n=32)和使用CTLA-4/PD-1抑制剂治疗(n=24)的患者的肿瘤组织切片进行了多重荧光免疫组化染色(CD3、CD8、FoxP3、CD68、CD20、PanCK、DAPI)。在分析中,使用HALO注释工具将肿瘤区域分割成不同的感兴趣区域,以便对这些不同区域内的免疫细胞进行综合性的对比评估(图1A)。在使用HALO进行分析中,分别对肿瘤中心(Central tumor)内的肿瘤(Tumor)和间质(Stroma)区域的免疫细胞进行量化(肿瘤和间质区域使用基于机器学习的HALO组织分型算法实现自动化的分割),并对方形空格内(Tumor Tile)的免疫细胞进行空间采样(Tumor Tile的划分使用HALO高级注释工具进行自动化分割),用以评估肿瘤内免疫亚群的异质性。
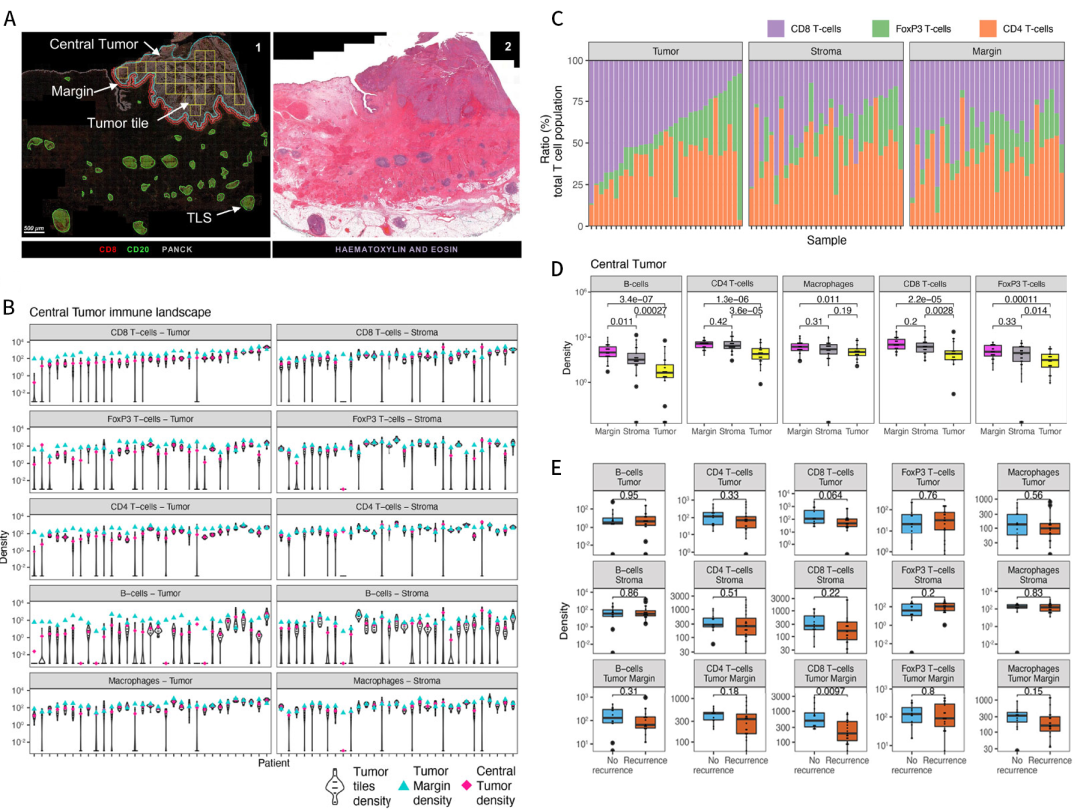
图1未经治疗的尿路上皮癌表现出异质免疫细胞浸润。A) 通过HALO平台对未治疗的UC中感兴趣的注释区域(肿瘤中心-蓝色、肿瘤中心方格区域-黄色、肿瘤边缘-红色、TLS-绿色)示例以及对应的H&E染色图像;B) 未经治疗的UC队列肿瘤中心(红色)、肿瘤边缘(绿色)以及方格(小提琴图)区域免疫亚群的密度及分布;C) 在肿瘤中心区域分类的肿瘤和间质区域内以及肿瘤边缘T细胞亚群的相对丰度;D) 在肿瘤中心区域分类的肿瘤和间质区域内以及肿瘤边缘免疫细胞的密度对比;E)复发(n=19)和非复发(n=12)之间肿瘤、间质和肿瘤边缘免疫亚群细胞密度的对比。
结果发现,免疫亚群的中位密度在未治疗的肿瘤组中差异很大,特别是对于B细胞、FoxP3 T细胞和CD8 T细胞(图1B)。此外,在肿瘤中具有低CD8 T细胞比率的肿瘤表现出较高比例的FoxP3 T细胞(图1C)。对肿瘤中心区域的肿瘤和间质区域以及肿瘤边缘之间的免疫细胞密度进行了对比,发现肿瘤边缘的免疫细胞的丰度相对肿瘤中心显著更高(图1D)。在非复发性肿瘤中,肿瘤边缘的CD8 T细胞存在显著高于复发性肿瘤(图1E),而肿瘤和基质中存在的免疫细胞并不能预测未经治疗的肿瘤的临床结果。综合上述结果,可以发现肿瘤之间的UC免疫景观是异质性的,并且在UC肿瘤边缘发现了明显的免疫浸润。
2 UC患者不同免疫表型中免疫细胞的分布特征
先前有研究根据CD8+ T细胞的浸润模式将免疫表型分为免疫炎症型(immune-inflamed)、免疫豁免型(immune-excluded)及免疫沙漠型(immune-desert)。这些不同的免疫表型具有预后相关性和免疫治疗反应的预测价值。目前,关于UC中CD8免疫表型中除细胞毒性T细胞外存在不同免疫亚群的知识有限,而它们的存在可能影响CD8效应因子功能和CD8肿瘤免疫的扩展。因此,根据未治疗的UC队列中肿瘤和间质和肿瘤边缘区域的CD8+ T细胞密度对免疫表型进行分类(图2A)。
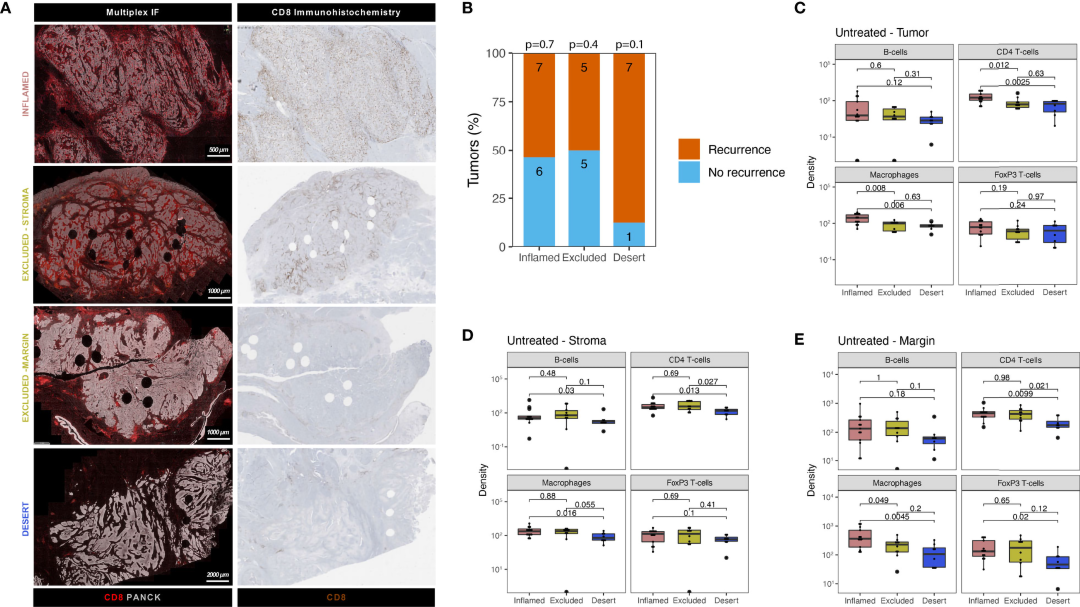
图2 UC免疫表型在肿瘤中心和肿瘤边缘显示出不同的免疫细胞丰度和细胞毒性T细胞排斥模式。A) 通过mIF和CD8 IHC染色对未经治疗的UC患者进行免疫表型的区分;B)复发及未复发组之间免疫表型的分布;C-E)肿瘤中心区域的肿瘤(C)、间质(D)及肿瘤边缘(E)不同免疫表型的免疫亚群的细胞密度对比。
结果发现,多数UC患者(42%)属于免疫炎症性,但单独的肿瘤免疫表型并不能评估未治疗队列的复发结果(图2B),尽管被认定为免疫沙漠型的患者表现出较高的复发率(87.5%)。对不同免疫表型的肿瘤亚组中免疫成分进行了对比分析,发现在肿瘤区域内,免疫炎症型中免疫细胞密度通常较高,特别是与免疫沙漠型相比,巨噬细胞的密度显著更高(图2C);在间质区域内,免疫沙漠型中的免疫细胞密度最低,与其他免疫表型相比,CD4+ T细胞密度显著降低(图2D);在肿瘤边缘区域,免疫炎症型的巨噬细胞丰度显著高于免疫豁免型和免疫沙漠型(图2E)。
3 未经治疗和免疫治疗的UC中T细胞耗竭的标志物
耗尽的 CD8 T细胞的特点是效应功能受损和免疫抑制检查点(如 TIM3、LAG3 和 PD1)持续表达。鉴于T细胞耗竭作为免疫治疗靶点的意义,在未经治疗的队列中使用IHC来检查 TIM3 和 LAG3 的表达,以及 CD8 和 PD1 的共表达(图3A-B)。CD8/PD-1共表达的分析基于HALO Multiplex IHC算法进行自动化的评估。特别的,在分析中肿瘤和间质区域的识别使用了基于卷积神经网络算法的HALO AI进行,该算法可以更稳健的进行算法的训练,识别图像中更多的特征,达到更高的准确度。
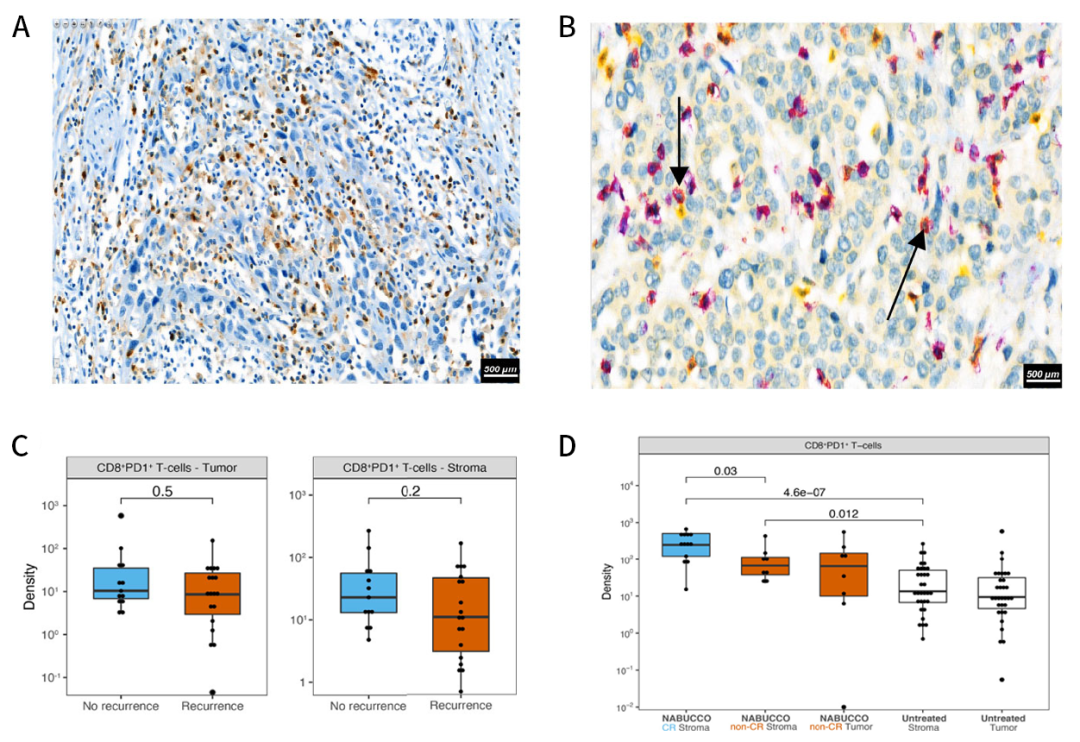
图3 未经治疗和经免疫治疗的UC中T细胞衰竭的标志物。A)TIM-3免疫组化染色的代表性肿瘤示例;B)在未治疗的UC中CD8(紫色)和PD-1(黄色)双重免疫组化染色的代表性肿瘤示例,黑色箭头标记CD8+&PD-1+ T细胞(红色);C)未治疗的UC患者复发和无复发组之间肿瘤中心内肿瘤和间质区域的CD8+&PD-1+ T细胞密度对比;D)未治疗和经免疫治疗的膀胱切除术患者肿瘤和间质区域内CD8+&PD-1+ T细胞密度对比。
结果发现,与TIM-3相比,LAG-3的表达在未治疗的肿瘤中几乎不存在,CD8+&PD-1+ T细胞明显存在于未经治疗的UC中。经过定量分析,发现肿瘤和间质区域中CD8+&PD-1+ T细胞的丰度与肿瘤复发没有相关性(图3C)。此外,与未经治疗的膀胱切除术相比,无论治疗反应如何,CD8+&PD-1+ T细胞均有较高的富集,而CD8+&PD-1+ T细胞在实现免疫治疗CR的肿瘤中分布最高(图3D)。总之,TIM-3在淋巴细胞高度表达,在膀胱切除术中,尤其是免疫治疗后,在有反应和无反应的患者中均发现了大量的CD8+&PD-1+ T细胞。
4 UC患者TLS的组成与检查点抑制剂的变化
TLS的存在与未治疗和治疗的恶性肿瘤的良好临床结果密切相关,而其他研究没有发现相关或免疫抑制TLS功能。研究假设TLS免疫成分的异质性可能会影响未治疗和治疗环境中抗肿瘤免疫和患者的临床结果。因此通过7-plex多重荧光免疫组化panel(CD21、DA-LAMP、CD23、PNAd、CD20、CD3、DAPI)分析TLS的成熟度。TLS成熟阶段由密集CD20+ B细胞区域中是否存在CD21+滤泡树突细胞(FDC)和CD23+生发中心(GC)细胞来定义。早期TLS(无FDC、无GC)、原发性卵泡样(PFL)TLS(有FDC但无GC)和继发性卵泡样(SFL)TLS的比例被确定为每位患者所有分析的TLS中的分数。分析中,研究还采用无监督学习策略对具有不同免疫细胞组成的TLS簇进行了聚类分析。基于TLS中B细胞、CD4 T细胞、CD8 T细胞、FoxP3 T细胞和巨噬细胞的细胞密度(cells/mm2)进行K-Means算法训练,最终获的tSNE聚类结果预测每个TLS子类型。
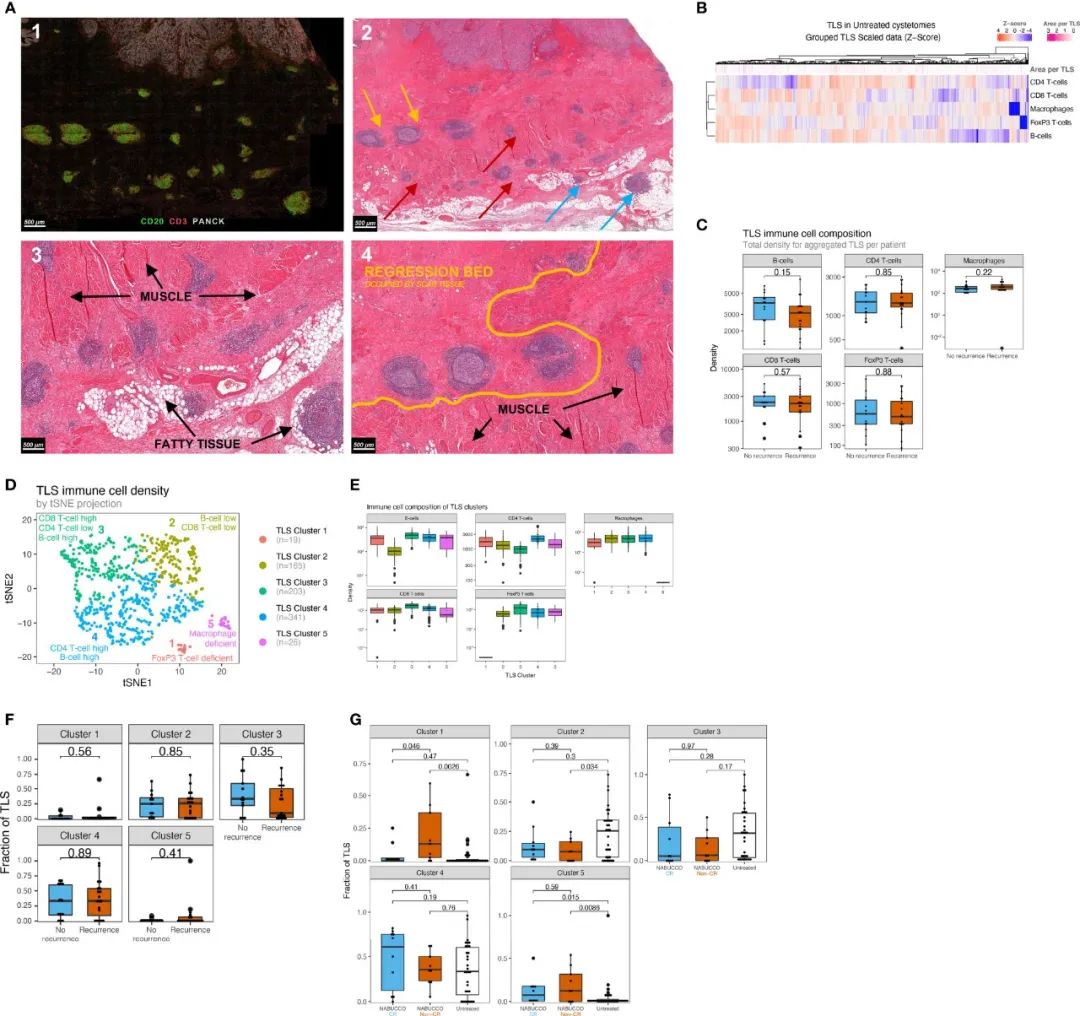
图4 尿路上皮癌中显示出不同的TLS簇,以及响应者和未响应者间对TLS组成的治疗效果差异。A)mIHC染色的TLS的示例(1)及对应区域的H&E染色(2),其中肌肉(红色箭头)、脂肪组织(蓝色箭头)和纤维炎症消退床(黄色箭头)中形成TLS。(3)和(4)图为图2的放大区域;B)未经治疗的UC患者TLS中免疫细胞密度的异质性;C)按复发情况进行分组,TLS内免疫细胞亚群的密度对比;D)未经治疗队列中患者TLS免疫细胞亚群的聚类图示;E)每个TLS簇内单位面积内免疫细胞亚群的密度;F)复发和未复发的UC患者间每个TLS簇的相对面积对比:F)未经治疗、CR以及治疗无反应的UC患者TLS簇分数的比较。
结果发现,总共在未治疗的肿瘤中发现754个TLS聚集体,主要发现在固有肌层、脂肪组织和纤维炎症消退床周围(图4A)。在定量分析中,TLS揭示了异质性的免疫细胞组成,并且TLS的大小在未治疗的UC患者中差异巨大(图4B)。复发组与未复发的组之间的TLS中的免疫细胞密度没有发现差异(图4C)。由于关于TLS免疫结构以及免疫成分如何影响临床结果的知识有限,使用k-means聚类算法根据免疫细胞密度及其在未治疗肿瘤中的相对丰度对TLS进行分组。发现在未治疗的肿瘤中鉴定了五个不同的TLS簇(图4D),其特征在于不同丰度的免疫细胞(图4E)。在未治疗UC中,各组间TLS丰度未观察到差异(图4F)。在免疫治疗无应答者的患者中,与未治疗肿瘤或免疫治疗应答者相比,簇1(FoxP3 T细胞低)TLS显著富集(图4G)。此外,与未治疗的肿瘤相比,在免疫治疗(non-CR或CR)肿瘤中,簇5(巨噬细胞低)TLS显著升高(图4G)。这些结果表明,UC在免疫治疗后显示不同的TLS簇,细胞组成发生改变。
5 TLS在不同区域的分布与免疫细胞的表达
尽管B细胞和TLS富集与良好的临床结果和免疫治疗反应相关,但其他研究报告没有正相关性,这表明B细胞和TLS可能具有相反的作用。研究假设TLS的一个子集可能与抗肿瘤免疫无关,特别是在通过经尿道切除术(TUR)获得的预处理组织中。TUR活检主要收集高度暴露于尿毒素、微生物病原体(尤其是存在膀胱肿瘤的情况下)和炎症介质的浅表组织。这些TLS可能会使与肿瘤相关的TLS分析变得模糊,尤其是在肿瘤的浅表部分。为了检验这一点,研究探讨了浅层区域的TLS组成是否与深层组织区域的TLS不同。
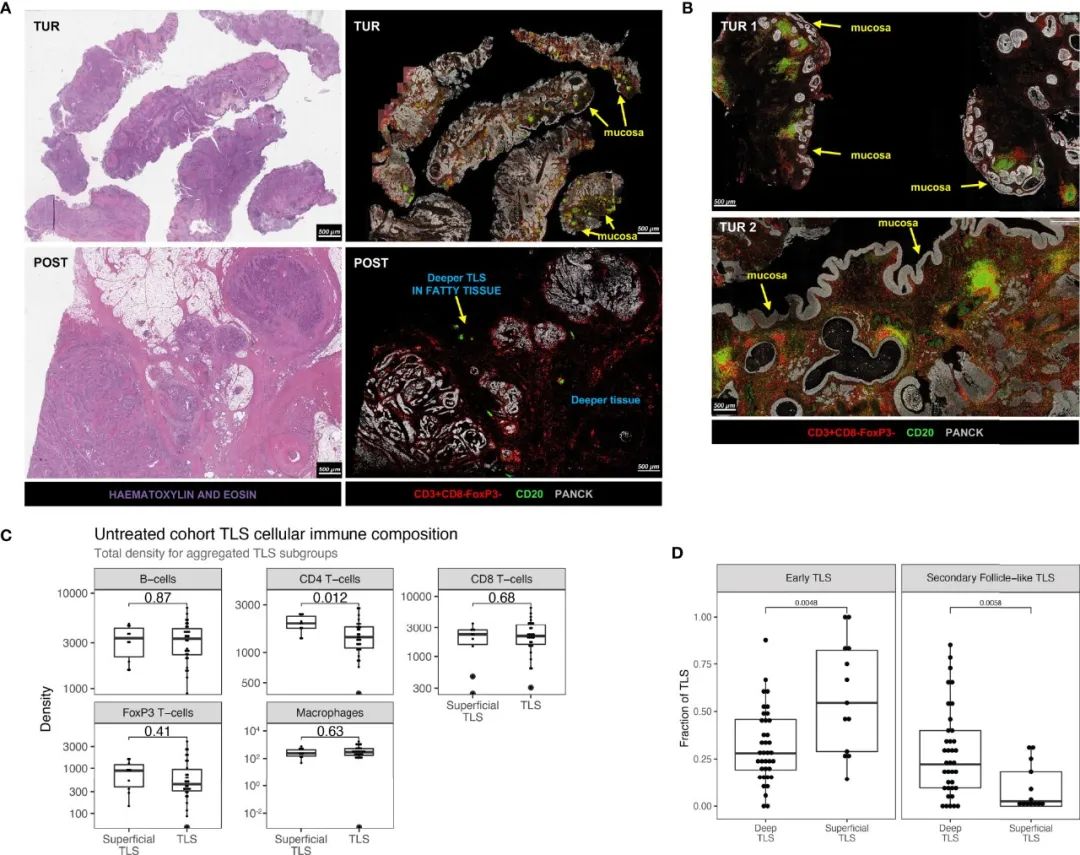
图5 不同的TLS模式和T辅助性细胞在尿路上皮癌浅层和深层TLS之间的不同表达。A) 通过mIHC和H&E染色,在无应答的免疫治疗患者中,基线TUR和治疗后膀胱切除术中TLS丰度的示例;B)两个不同的TUR例子显示TLS中明显存在CD4 T细胞;C)浅层(n=10)和深层TLS(n=30)之间的TLS聚集免疫细胞密度的比较;D)不同区域位置(浅层/深层)以及TLS的成熟状态间TLS的评分。
结果发现,在免疫治疗预处理TUR中观察到高TLS存在,特别是在非CR肿瘤中,而TLS丰度在其相应的治疗后组织中受到限制(图5A)。预处理TUR中的TLS丰度在尿路上皮黏膜下层中特别高(图5B)。存在于尿路上皮黏膜下层(浅表TLS)的TLS的特征是明显的CD4 T细胞存在,而更深的TLS仅显示有限的CD4 T细胞对免疫细胞组成的贡献(图5B)。接下来,对未经治疗的UC中的浅层和深层TLS进行分层,以比较TLS组成和TLS簇的相对丰度。在未经治疗的肿瘤中,浅表TLS显示出显著更高的CD4 T细胞存在(图5C)。最后,在一个单独的、更大的队列(n=40,涉及来自原始未治疗队列的20名患者)。在指定TLS成熟度后,发现与更深的TLS相比,浅层TLS显示出更高比例的早期TLS和更低的生发中心阳性TLS(图5D)。综合上述的研究结果表明,浅层TLS可能在成分上与深层TLS不同。这些观察结果可能会影响UC中免疫生物标志物的方法,并为进一步剖析TLS群体和研究它们在UC肿瘤免疫微环境中抗肿瘤免疫中的确切作用提供理论基础。
本研究基于多重荧光免疫组化染色,使用HALO平台全面评估了UC患者肿瘤组织中免疫表型和TLS的组成和空间分布特征。特别的,针对不同免疫细胞的密度对TLS进行了聚类分析,发现与未治疗的肿瘤相比,TLS簇在抗CTLA-4/PD-1ICI治疗的肿瘤中显示出独特的免疫细胞组成。此外,根据TLS在肿瘤组织内不同区域的分布进行了分析,发现在浅层组织区域的TLS群体,CD4 T细胞表达比深层TLS更明显。总之,该研究结果对UC中肿瘤免疫景观进行了更加全面的概述,可为后续进一步的研究提供基础。
参考文献:
Dijk N V, Gil-Jimenez A, Silina K, et al. The Tumor Immune Landscape and Architecture of Tertiary Lymphoid Structures in Urothelial Cancer[J]. Frontiers in Immunology, 2021, 12.







