三级淋巴结构(TLS)是肿瘤微环境中抗肿瘤免疫应答启动的直接部位,对患者生存预后、治疗反应及免疫治疗应答评估均有积极作用,也是近来肿瘤免疫治疗的新热点。上期我们介绍了如何利用HALO数字病理图像分析平台,对TLS的识别、组成与结构、定量检测以及在临床前研究进行分析。本期我们将继续分享关于使用HALO平台进行肿瘤微环境及三级淋巴结构研究的应用案例。
01 TLS的存在、数量及大小与免疫治疗的反应

肿瘤相关三级淋巴结构 (TA-TLS)与提高患者存活率和对癌症治疗的反应性有关,但其发展的潜在机制尚不清楚。来自弗吉尼亚大学医学院免疫学研究中心的团队展示了小鼠黑色素瘤中TA-TLS的发展是由癌症相关成纤维细胞(CAF)策划的,这些细胞具有肿瘤坏死因子受体信号诱导的具有淋巴组织组织细胞的特征。CD8 T细胞介导CAF形成网状结构,而CAF的积累和TA-TLS的扩展取决于CXCL13介导的表达Lymphotoxin-α1β2的B细胞的募集。其中一些元素在人类TA-TLS中也有过多的表现。此外,研究还证明了免疫疗法会诱导更多、更大的TA-TLS,这些TA-TLS更多由离散的T和B细胞区组成,并且TA-TLS的存在、数量和大小与肿瘤大小的减小和对检查点免疫疗法的总体反应相关。这项工作为TA-TLS发展作为癌症免疫治疗策略提供了一个平台。
研究中HALO的应用
本研究中,对小鼠黑色素瘤组织进行了多重免疫荧光染色检测,使用HALO平台全面对TA-TLS中的CAF密度,以及FAP+与PDPN+共阳性,FAP+阳性,VCAM-1+与PDPN+共阳性,ICAM+与PDPN+共阳性区域进行了定量分析(图1)。此外,使用HALO对TA-TLS的大小、数量也进行了全面的评估(图2)。在建立驱动小鼠TA-TLS发展机制的转化相关性,使用HALO评估了三位人类黑色素瘤患者中的TA-TLS。将PNAd+细胞、CD20+ B细胞、CD8+ T细胞以及gp36+ CAF细胞的聚集簇识别为TA-TLS,并对三种肿瘤类型中的CD20+ B细胞、gp36+ CAF细胞、APRIL+细胞、VCAM-1+细胞、LTα+细胞、CXCL13+细胞密度进行了定量分析(图3)。
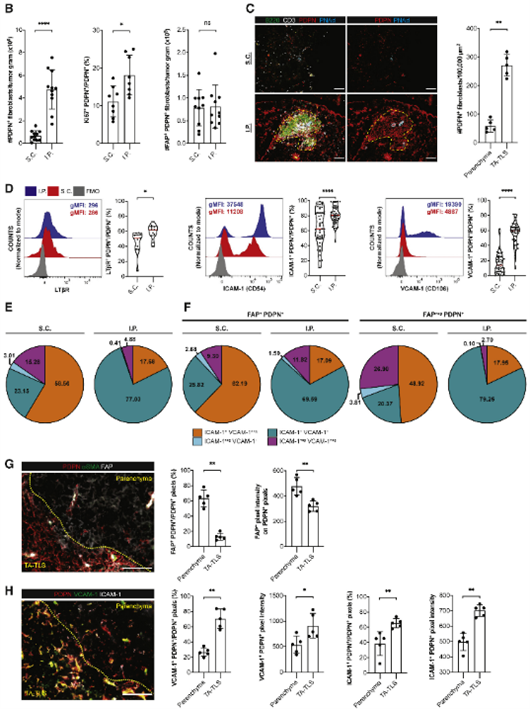
图1 多色免疫荧光染色的小鼠黑色素瘤组织图像及HALO定量分析的统计图示
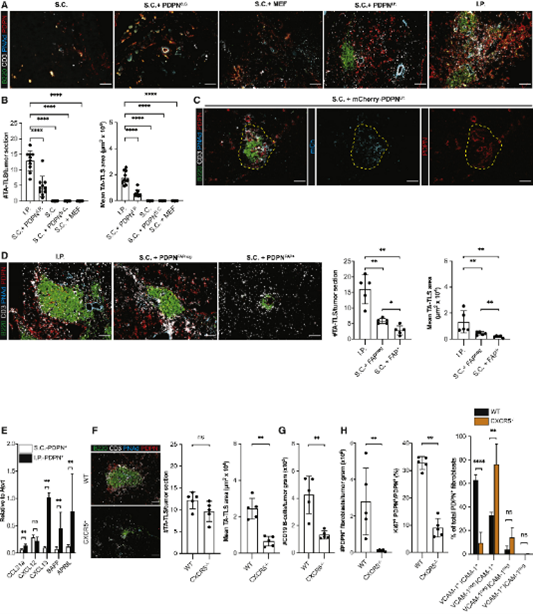
图2 CAF作为替代淋巴组织组织者细胞,协调TA-TLS的形成
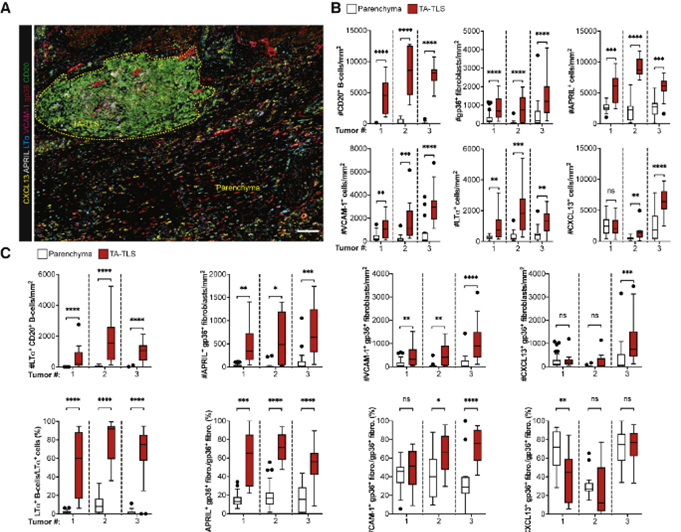
图3 HALO评估TA-TLS及外围组织实质中免疫细胞的表达
02 靶向TLS内的T细胞是横纹肌肉瘤抗肿瘤应答的关键
目前为止,免疫检查点抑制剂药物对肉瘤的治疗效果有限。来自约翰·霍普金斯大学医学院的团队研究了两种差异比较大的软组织肉瘤(STS),横纹肌肉瘤和未分化多形性肉瘤(UPS)。通过免疫组化染色、流式细胞术和比较转录组学分析,全面对其肿瘤微环境进行了分析。研究结果表明,这两种STS亚型均以肿瘤相关巨噬细胞为主,并被定位于肿瘤脉管系统附近的浸润免疫细胞。两种亚型具有相似的T细胞密度,但他们在组织上的空间原位分布并不相同。UPS样本显示T细胞弥漫性肿瘤内浸润,而横纹肌肉瘤样本显示肿瘤内T细胞与血管周围附近的B细胞聚集,形成三级淋巴结构(TLS)。UPS样本中的T细胞由大量的CD8+ T细胞组成,表现出高PD-1表达;在横纹肌肉瘤中,T细胞仅限于TLS,但表达免疫检查点和免疫调节分子。本研究揭示了一种以骨髓细胞为主的免疫抑制的肿瘤微环境,这种肿瘤微环境可能通过激活进入肿瘤的T细胞来克服。在横纹肌肉瘤中,靶向TLS内的T细胞是实现抗肿瘤应答的关键。
研究中HALO的应用
本研究中,对获得的39个UPS、27个ERMS(胚胎型横纹肌肉瘤)以及11个ARMS(肺泡型横纹肌肉瘤)分别进行了H&E染色、CD3、CD8、CD163、FoxP3、CD20、CSF-1R、PD-L1和CD31标记物染色。切片经扫描后,使用HALO对肿瘤区域进行标注,计算肿瘤区域内免疫细胞的数量及密度。
在CD3 T细胞、CD163巨噬细胞以及CD31内皮细胞的分析中,分别计算了CD31内皮细胞100μm范围内最邻近的CD3、CD163细胞的数量。结果发现,在UPS、ERMS及ARMS三种肿瘤亚型中,CD31内皮细胞周围20~40μm范围内存在大量的T细胞和巨噬细胞(图4)。

图4 3例肿瘤血管及免疫细胞浸润的代表性示例图
另外对全组织切片内的CD3+T细胞、CD8+细胞毒性T细胞、FoxP3+调节性T细胞、CD163+巨噬细胞和PD-L1+的细胞密度进行了统计分析(图5)。发现巨噬细胞在所有肉瘤中的存在最强,UPS的密度最大,其次是ERMS,然后是ARMS。对三种不同STS亚型中CD163密度/CD3密度的比率进行评估。发现UPS样本中CD163/CD3比值高于横纹肌肉瘤亚型,包括ARMS和ERMS,但ARMS和ERMS之间没有差异。在三个亚型中测量了CSF1R阳性面积百分比。UPS样本的CSF1R表达百分比最高,其次是ARMS,然后是ERMS。PD-L1平均阳性面积在UPS样本中最高,但与ERMS样本的平均值相比仅具有统计学意义。
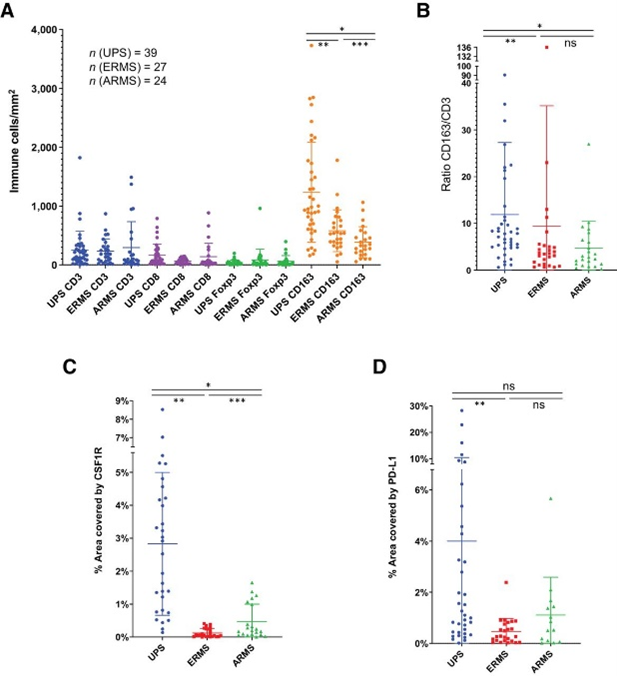
图 5 UPS、ERMS和ARMS样本中不同免疫细胞的对比
尽管观察到所有三种肉瘤都具有相似的T细胞(CD3+)密度,但它们的空间分布明显不同。发现UPS中T细胞(CD3+和CD8+)呈弥漫分布,不存在B细胞(CD20+)。在ERMS和ARMS中,T细胞(CD3+和CD8+)与B细胞(CD20+)聚集在一起形成TLS。TAMs(CD163+)广泛分布于所有肉瘤中。CSF1R在UPS和ARMS中显得更强。PD-L1存在于所有肉瘤中,但在UPS中更强。每种肉瘤亚型中TLS的频率各不相同,并且起源于不同的解剖部位。
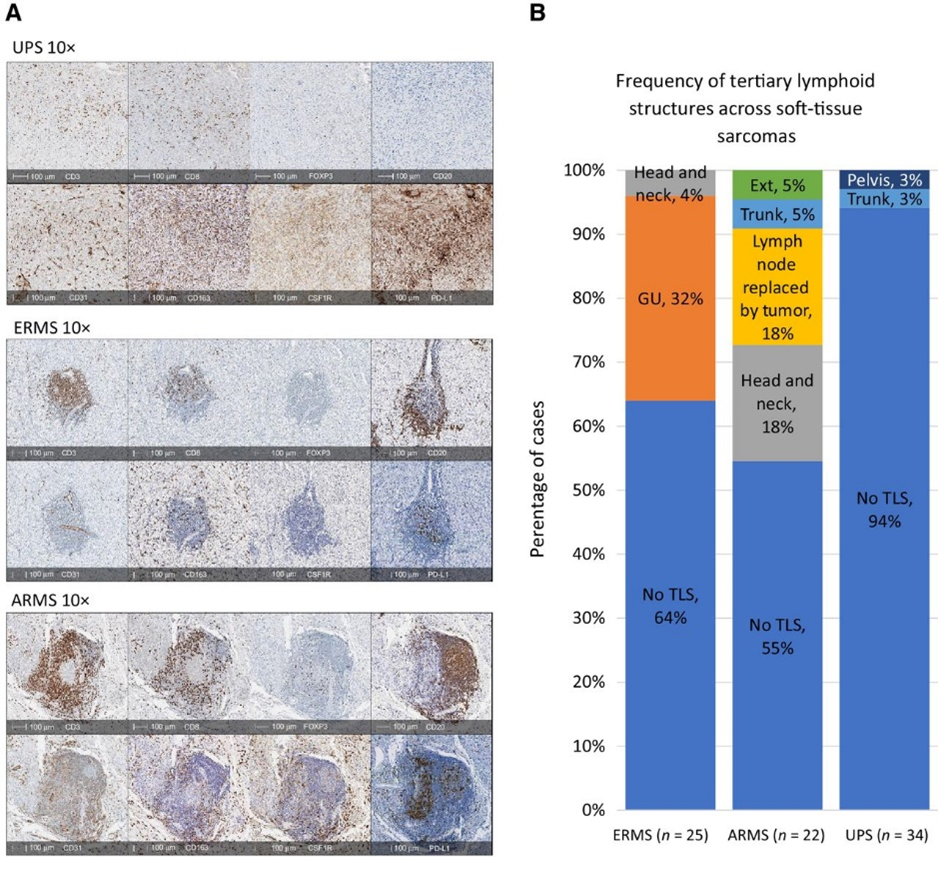
图6 UPS、ERMS和ARMS样本中免疫细胞的分布及TLS的比例
03 TLS与子宫内膜癌患者预后的关联

B细胞在癌症抑制中起着关键作用,特别是当聚集在三级淋巴结构中时。来自莱顿大学医学中心的团队研究了B细胞和TLS在子宫内膜癌(EC)中的作用。B细胞的单细胞RNA测序表明活化/记忆B细胞、循环/生发中心B细胞和抗体分泌细胞的存在。差异基因表达分析显示TLS与L1细胞黏附分子(L1CAM)过表达的关联。免疫组织化学和免疫荧光显示L1CAM在位于子宫肌层壁或肿瘤浸润边界的成熟TLS中表达,与肿瘤中的L1CAM表达无关。使用L1CAM作为标记,对PORTEC-3生物库中411个分子分类EC中的378个进行了评估。发现其中的19%存在TLS,主要存在于错配修复缺陷和polymerase-epsilon突变体EC中。多变量Cox回归分析显示TLS具有很强的有利预后影响,并独立于临床病理学和分子因素。我们的数据表明,TLS在EC患者的预后中起关键作用,并确定了L1CAM可作为生物标志物。
研究中HALO的应用
本研究中,TLS由临床病理专家进行量化评估。当在子宫肌层壁或肿瘤浸润边界处观察到在中心具有任何L1CAM阳性的有组织的淋巴样聚集体时,作为TLS进行计算。不计算没有任何L1CAM阳性的淋巴聚集体。使用HALO组织分型的算法,定位和量化肿瘤上皮组织和肿瘤相关的间质区域。同时基于HALO Multiplex IHC细胞定量的方法,检测全组织切片肿瘤区域及间质区域内CD8+、CD20+阳性细胞的数量及密度。
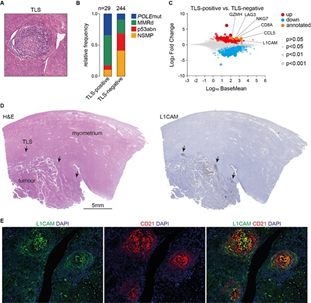
图7 L1CAM在三级淋巴结构成熟生发中心的表达。A. EC中TLS的代表性H&E图像;B. TLS阳性和TLS阴性UCEC TCGA病例中分子亚组的频率;C. TLS阳性与TLS阴性TCGA UCEC病例的差异基因表达; D. 代表性L1CAM阳性TLS病例。箭头表示TLS; E. L1CAM阳性TLS与L1CAM和CD21的免疫荧光分析
04 PD-1预测肺癌免疫治疗生存期

来自小鼠慢性病毒感染模型的证据表明,以受体PD-1不同表达水平为特征的CD8+T细胞亚群在其衰竭状态和通过PD-1阻断恢复活力的潜力方面存在差异。然而,基于PD-1表达水平,人类癌症中的T细胞是否采用类似的耗竭状态仍然未知。来自巴塞尔大学医院的团队比较了非小细胞肺癌患者肿瘤内CD8+T淋巴细胞高(PD-1T)、中等(PD-1N)和无PD-1(PD-1–)表达人群的转录组、代谢和功能特征。结果表明PD-1T 细胞与PD-1N和PD-1–淋巴细胞表现出明显不同的转录和代谢谱,以及固有的高肿瘤识别能力。当PD-1T淋巴细胞在经典效应细胞因子的产生中受损时,它们产生CXCL13并介导免疫细胞向三级淋巴结构募集。另外,在一组接受PD-1阻断治疗的非小细胞肺癌患者中,PD-1T细胞的存在对应答和生存都具有很强的预测作用。人类癌症中肿瘤反应性、PD-1淋巴细胞的独特状态的表征,仅部分类似于慢性感染中所见,为治疗干预提供了潜在途径。
研究中HALO的应用
本研究中,研究人员使用HALO分析了非小细胞肺癌病人的肿瘤浸润性T细胞的PD-1表达水平,并将其分为3组:无法检测到PD-1表达的CD8+肿瘤浸润性T细胞(即PD-1表达阴性,PD-1-)、与正常人外周血单核细胞PD-1表达水平相近的CD8+肿瘤浸润性T细胞(PD-1N)、高于正常人PD-1表达水平的CD8+T细胞(PD-1T)。结果发现人类肿瘤组织中的PD-1T肿瘤浸润性淋巴细胞不仅失去了经典的CD8+效应器,而且已经获得了新的功能;同时,PD-1T肿瘤浸润性T细胞的出现高度预测非小细胞肺癌对PD-1抑制剂的治疗反应和非小细胞肺癌病人的生存期,有利于临床工作中筛选适合免疫治疗的患者。此外,通过HALO对三级淋巴结构内/外分布的CD8+和PD-1细胞进行了定量分析。
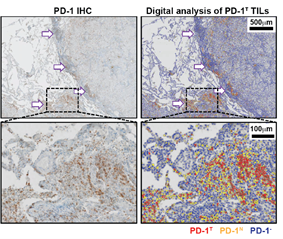
图8 病理专家对PD-1的判读以及使用HALO对PD-1T、PD-1N和PD-1–进行定量分析
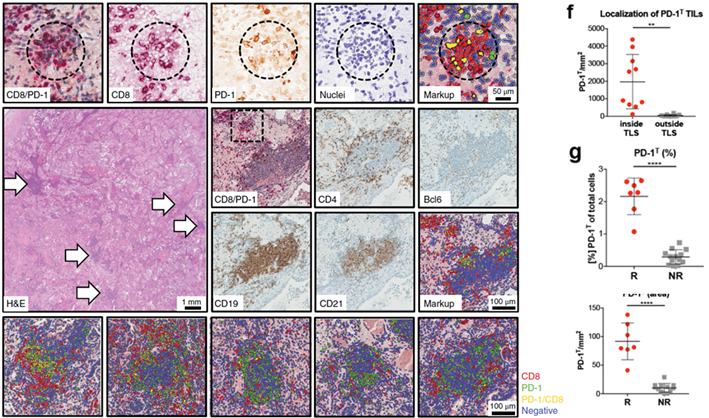
图9 肺癌组织样本中TLS中免疫组化分析
TLS因为其特殊的分布位置以及强大的免疫功能,在肿瘤免疫过程中发挥越来越大的功能。目前对TLS进行识别的主要方式包括通过H&E染色识别、免疫组化及多重免疫荧光通过B细胞、T细胞以及树突细胞等免疫标记物进行识别。基于HALO平台,可以高效的对TLS内部及周围组织实质内TILs的类型、功能及密度等进行定量检测。同时联合空间转录组学和单细胞转录组学的分析策略,可以针对TLS的特殊结构、细胞组成与基因表达情况,深入解析肿瘤的免疫机制和临床免疫治疗,在未来的科学领域将发挥重要的作用。
参考文献:
1]. Rodriguez A B, Peske J D, Woods A N, et al. Immune Mechanisms Orchestrate Tertiary Lymphoid Structures in Tumors Via Cancer-Associated Fibroblasts[J]. Cell Reports, 2021, 36(3).
2]. Chen L, Oke T, Siegel N, et al. The Immunosuppressive Niche of Soft-Tissue Sarcomas Is Sustained by Tumor-Associated Macrophages and Characterized by Intratumoral Tertiary Lymphoid Structures[J]. 2020, 26(15): 4018-4030.
3]. Horeweg N, Workel H, Loiero D, et al. Tertiary lymphoid structures critical for prognosis in endometrial cancer patients-a TransPORTEC study[J]. 2021.
4]. Thommen DS, Koelzer V H, Herzig P, et al. A Transcriptionally and Functionally Distinct Pd-1+ Cd8+ T Cell Pool with Predictive Potential in Non-Small-Cell Lung Cancer Treated with Pd-1 Blockade[J]. Nature Medicine, 2018, 24(7): 994-1004.







