GPCR
引言:G蛋白偶联受体(GPCR)构成了哺乳动物体内最大的膜蛋白家族,广泛遍布于中枢神经系统、免疫系统、心血管系统以及视网膜等多个关键器官和组织中。它们不仅参与机体的正常发育与功能维持,还扮演着调控细胞内信号通路的重要角色。然而,当这些通路调节出现异常,或外源性病原体利用GPCR作为入侵途径时,便可能引发一系列疾病。鉴于其重要性,GPCR已成为药物研发领域的关键靶点,其药物开发工作具有极高的科学价值与实际意义。
GPCR简介
G蛋白偶联受体(GPCR)的核心结构由七条穿越细胞膜的α螺旋所构成。其中,N端以及三个环状结构(loops)位于细胞外部,它们负责与配体进行相互作用;而C端与另外三个loops则位于细胞内,其中C端与第三个loop在GPCR与下游G蛋白的交互过程中扮演着至关重要的角色,介导细胞内的信号传递。当特定的配体与GPCR结合时,会触发G蛋白的活化,进而产生第二信使如Ca2+或cAMP,实现胞外信号向胞内的传递。然而,GPCR也具备不依赖于G蛋白的信号传导机制,例如通过与β-arrestin等分子相互作用来调节下游的信号通路。
关于GPCR超家族的分类,存在多种方法。其中较为流行的有两种:一种是A-F分类系统,它涵盖了所有生物体内的GPCR蛋白;另一种则是根据序列与功能的相似性,将GPCR分为五大类,分别是谷氨酸受体(Glutamate)、视紫红质受体(Rhodopsin)、粘附受体(Adhesion)、卷曲/味觉2受体(Frizzled/Taste2)以及促胰液素受体(Secretin),简称GRAFS分类系统。绝大多数的人源GPCR都可以被归入这五大类中。
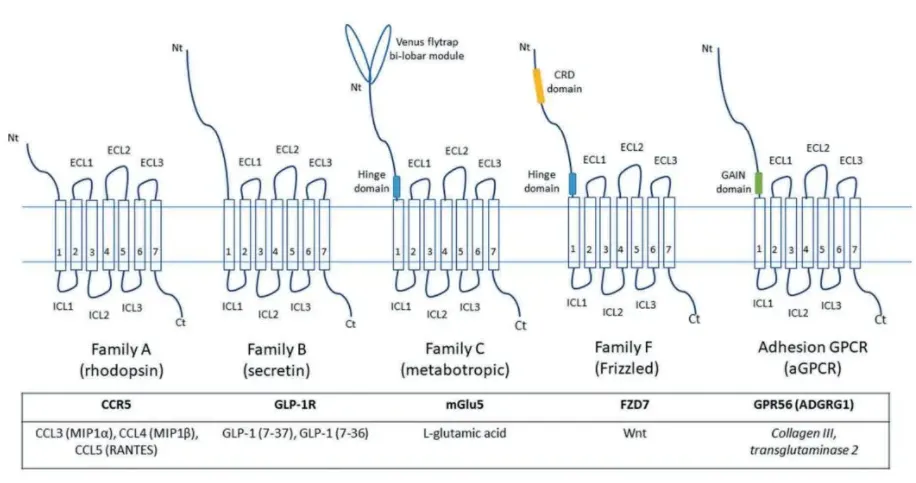
Rhodopsin受体家族,也被称作Class A家族,是GPCR超家族中最为庞大的分支。该家族成员普遍拥有较短的N端,其天然配体或是直接与跨膜区域结合,或是通过与胞外loop结构的相互作用间接地影响受体的构象。配体的种类相当丰富,涵盖了多肽、胺类、嘌呤等多种化合物。Rhodopsin受体家族可细分为α、β、γ和δ四个亚类。α亚类囊括了多种关键的胺类及小分子化合物受体,例如组胺受体、多巴胺受体、大麻素受体等。β亚类则主要包含了诸如内皮素受体、催产素受体等多肽受体。γ亚类中备受瞩目的是趋化因子受体家族,以及其他一些趋化素受体和神经肽受体。δ亚类则包括了一些糖蛋白受体和与嗅觉相关的受体。总体而言,Rhodopsin受体家族成员众多且复杂,难以仅凭结构、功能或表达分布等单一特征来进行明确的分类。
B类受体在结构上显著的特点是其较大的胞外区域。Secretin受体家族(Class B)目前已知包含15个成员,均为多肽类激素受体,这些多肽与受体的胞外区域中的多肽结合区域相结合,从而激活受体。而Adhesion受体家族(同样归为Class B)的大部分成员至今尚未发现其天然配体。Glutamate受体家族(Class C)则包括了8个促代谢的谷氨酸受体(GRMs)、2个GABA受体(GABABRs)、钙敏感受体(CASR)、甜味和鲜味味觉受体(TAS1R1-3)、GPRC6A以及若干孤儿受体。该家族中绝大多数成员的N端都拥有与内源配体结合的区域。
Frizzled/TAS2受体家族可以进一步细分为两个亚家族:一是frizzled和smoothened受体(Class F),其中包括10个frizzled受体(FZD1-10)和1个smoothened受体(SMO)。前者以Wnt糖蛋白作为天然配体,而后者的信号通路调节机制似乎并不依赖于受体本身。二是taste2受体,主要是一些苦味味觉受体,此外还有一些目前尚未确定配体的孤儿受体。
GPCR与疾病的关系
GPCR家族在人体内的分布极为广泛,其功能也极为复杂,因此与众多疾病的发生和发展过程紧密相连,在其中发挥着举足轻重的作用。根据目前已有的深入研究,GPCR所涉及的疾病主要可以归结为三大类:癌症、炎症以及心血管/代谢疾病。
在癌症方面,GPCR家族的多个成员都参与了各种癌症的形成和恶化过程。例如,激素受体类的GPCR在某些激素依赖的癌症中起到了关键作用。蛋白酶激活受体,如PAR1,在MMP-1的催化下被激活,进而激活下游信号通路,加速癌细胞的侵袭和恶化。此外,趋化因子受体,如CXCR2和CXCR4,在骨髓瘤、淋巴瘤细胞以及某些实体瘤细胞中,如胰腺癌,呈现高表达状态,参与细胞的迁移、血管生成等过程。
在炎症方面,趋化因子受体家族主要表达在免疫系统的各类细胞上,参与免疫细胞的发育、迁移、生存以及免疫功能的发挥等生理和病理过程。炎症反应正是由免疫细胞上的趋化因子受体在趋化因子的激活下,介导免疫细胞发挥宿主免疫功能而产生的一类病理现象。例如,CXCR1和CXCR2主要表达于中性粒细胞上,当机体某处发生感染或损伤时,中性粒细胞会在相应趋化因子(如CXCL1、CXCL2、CXCL8)的引导下向病灶迁移,并在到达病灶后释放炎症因子,从而引发局部的炎症反应。
在心血管/代谢疾病方面,与心血管疾病相关的GPCR成员主要分布在Class A家族的α亚类中,如血管紧张素系统(RAAS)中的AT1R、AT2R以及Mas-R。AT1R的激活会导致血管收缩、细胞增殖迁移、炎症纤维化、心肌再塑和肥厚、钠水潴留以及ROS生成等效应;而Mas受体的激活则主要产生血管舒张、抑制细胞增殖迁移、抗炎症纤维化、抗凝、促EDRF和NO生成以及抑制心肌肥厚和生长等效应,两者相互拮抗,共同维持人体的稳态。与代谢疾病相关的GPCR成员则主要分布在Class A家族的脂肪酸受体中,如GPR120、GPR41和GPR43等,以及Class B家族的Secretin受体家族中,包括GLP-1R和GCGR等。例如,胰高血糖素样肽1(GLP-1)通过激活GLP-1R,提高胰岛β细胞的胰岛素分泌水平,从而控制血糖;同时它还能产生饱腹感,减缓肠道蠕动,降低食物摄入。而胰高血糖素(GCG)则通过与其受体GCGR结合而被激活,增强肝糖原降解,并调节葡萄糖的从头合成途径,抵抗胰岛素的降血糖作用,从而升高血糖。在二型糖尿病患者中,高血糖往往伴随着高胰高血糖素症。
除了上述三类主要疾病外,还有其他一些疾病也被证明与GPCR相关。例如,CCR5参与HIV向T细胞的入侵过程,是治疗艾滋病的一个重要靶点;降钙素相关基因肽受体CGRPR和其配体CGRP表达于三叉神经元区域,两者的相互作用所激活的下游信号通路被证实与偏头痛有关。
GPCR药物开发现状
GPCR与众多生理和病理疾病之间存在着密切的联系,这其中包括糖尿病、肥胖症、癌症、阿尔茨海默病等许多严重危害人类健康的疾病。鉴于GPCR在人体内表达的广泛性和其在生命活动中的重要性,它们甚至在配体被发现之前就已经成为了药物研发的重要靶点。
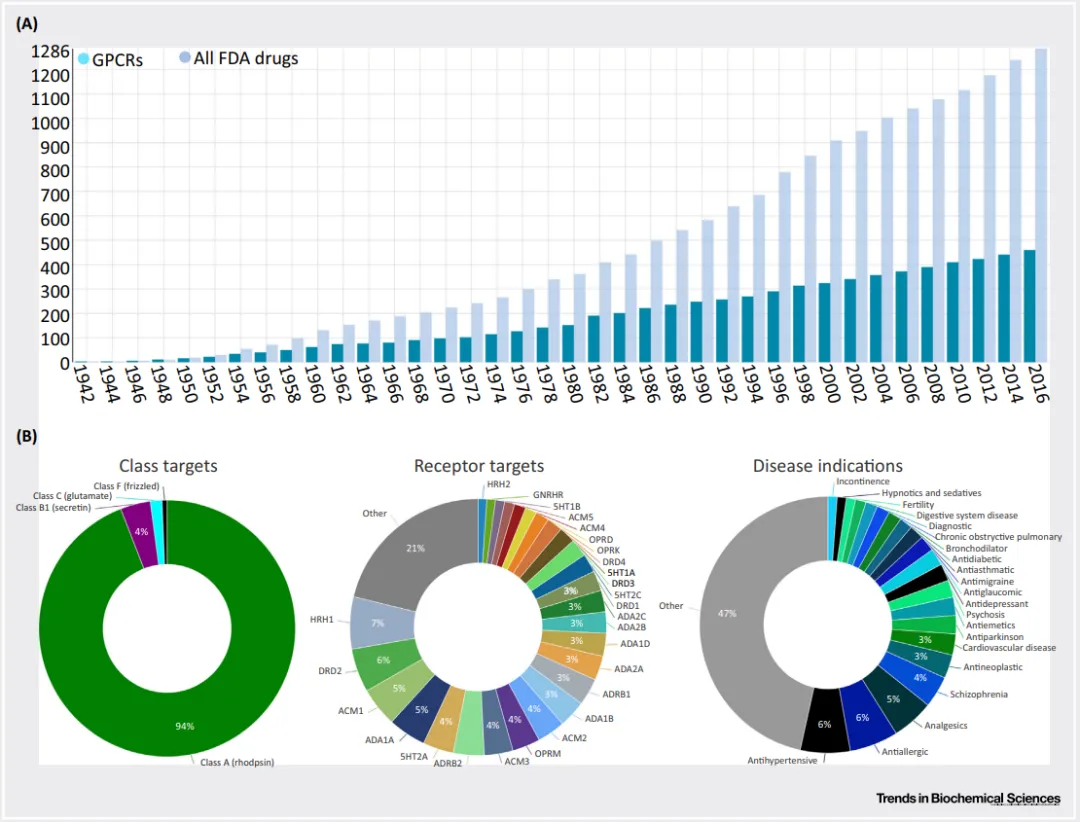
近年来,GPCR一直是制药公司关注的焦点。截至2016年,已经有1286种药物获得了美国食品药品监督管理局(FDA)的批准,其中高达460种药物(占比达到36%)是针对GPCR设计的。在这些靶向GPCR的药物中,绝大多数(94%)是针对A类GPCR的。由于A类GPCR能够作为多种配体(如小分子、肽和激素)的受体,因此它们成为了药物开发领域的最受欢迎的目标。相比之下,针对B类GPCR的药物占比较少(4%),而针对C类和F类GPCR的药物则更为稀少(各占2%)。
从当前使用的药物来看,最常靶向的受体包括HRH1、DRD2、ACM1和ADA1A。这些受体各自在GPCR总药物靶标数量中所占的比例都超过了5%,显示出它们在药物研发中的重要地位。从疾病适应症的角度来看,降压药、抗过敏药、镇痛药和精神分裂症药物是其中开发最多的药物类型。这些药物的研发成功不仅为患者提供了新的治疗选择,也进一步验证了GPCR作为药物靶点的重要性和潜力。
综上所述,GPCR作为人体内一类重要的蛋白质受体,在生理和病理过程中发挥着举足轻重的作用。随着对GPCR研究的不断深入和药物开发技术的不断进步,相信未来会有更多针对GPCR的药物问世,为人类健康事业做出更大的贡献。
GPCR药物未来发展趋势
在GPCR小分子药物的研发领域,尽管近年来取得了不少进展,但仍面临着结构生物学的挑战。过去五年间,虽然众多新的GPCR药物成功进入市场,但这些药物的发现大多依赖于已公布的GPCR结构信息。因此,结构生物学领域的突破性进展对于指导GPCR药物设计至关重要,它们为后期药物的研发提供了不可或缺的信息基础。随着研究的深入,科研人员对化合物与GPCR新型结合模式的理解将进一步拓展,有望为药物开发开辟新的机遇。
当前,大多数已批准的GPCR药物主要靶向传统的正构位点。这些位点通常位于细胞膜外,结构开放,便于配体结合而无需穿越细胞膜。然而,正构位点的高度保守性导致同类受体对相同正构药物的响应相似,从而限制了药物的特异性,可能引发额外的毒副作用。为解决这一问题,研究人员开始探索独特的变构受体位点,这些位点能够特异性地调节正构配体的活性,从而提高药物的靶向性和安全性。
此外,GPCR抗体相比小分子药物具有显著优势。抗体在体内的清除率更低,作用时间更长,因此可以降低给药频率。同时,抗体的选择性明显优于小分子药物,能够更精确地靶向目标受体。值得注意的是,由于血脑屏障的阻隔,抗体药物无法进入中枢神经系统。这一特性为针对在外周和中枢神经系统均有表达的GPCR设计药物提供了新思路:可以开发治疗性抗体,使药物主要分布在外周区域,从而降低对中枢神经系统的潜在毒副作用。
综上所述,随着对GPCR结构和功能的深入理解,以及抗体技术的不断发展,GPCR药物的研发将迎来更多创新和突破。未来,科研人员将不断探索新的结合模式和靶点,为治疗各种疾病提供更加安全、有效的药物选择。
靶向GPCR受体复合物:药物发现的新方向
药物发现领域正经历一场变革,传统上,科学家们主要聚焦于直接靶向受体蛋白,以激活或抑制其活性。然而,现在人们意识到,许多受体蛋白并非孤立存在,而是与各种受体相关蛋白形成复合物,共同发挥作用。这些受体复合物在功能特性、信号传导路径及定位上,往往与单独的受体蛋白截然不同,为药物研发开辟了新的视角。
通过靶向受体复合物,科学家们有机会调节特定的信号通路,这是传统方法难以实现的。此外,受体相关蛋白在不同组织或细胞类型中的差异表达,使得多蛋白受体复合物具有高度的组织特异性,为精准调节受体功能提供了可能。这种精准性有望推动新药研发,使药物更加有效,同时减少副作用。历史上,许多针对受体复合物的药物是通过表型筛选发现的。而近年来,高通量筛选(HTS)技术的兴起,为这一领域带来了革命性的变化,加速了针对此类复合物的小分子调节剂的发现。然而,受体复合物结构信息的缺乏一直是药物合理设计和基于结构药物设计的障碍。
幸运的是,随着科技的进步,特别是冷冻电镜技术的突破,我们对蛋白质复合物结构的理解取得了显著进展。这不仅使我们能够识别GPCR单体以及同二聚体和异二聚体的变构结合位点,还为开发能够调节亚型特异性受体复合物的小分子提供了可能。这些进展为药物研发领域带来了新的曙光,有望推动更多创新药物的诞生,为人类健康事业做出更大贡献。
总结
GPCRs(G蛋白偶联受体)作为治疗靶点的重要性日益凸显,这一点在过去十年的研究中得到了充分验证。随着对GPCR生物学特性的深入理解,特别是肿瘤免疫学领域的突破,GPCR作为抗体靶点的潜力被广泛认可。当前,针对GPCR的治疗性抗体研发正蓬勃发展,临床试验数量也在不断增加。
GPCR在多种生理和病理过程中发挥关键作用,因此,针对GPCR的药物开发具有广阔的应用前景。近年来,随着研究的深入,人们发现GPCR不仅可以作为单一疗法的靶点,还可以与其他药物联合使用,形成联合疗法,以更有效地治疗疾病。这种多样性的应用方式进一步增强了GPCR作为治疗靶点的吸引力。
特别是在肿瘤免疫学领域,GPCR的研究取得了显著进展。科学家们发现,GPCR在肿瘤细胞的生长、迁移和侵袭等过程中发挥着重要作用。因此,针对GPCR的治疗性抗体有望为肿瘤治疗提供新的策略和方法。综上所述,随着对GPCR生物学特性的不断深入研究,以及肿瘤免疫学等领域的突破,GPCR作为治疗靶点和抗体靶点的机会正在不断增加。未来,针对GPCR的治疗性抗体和联合疗法有望为多种疾病的治疗带来新的希望和机遇。
| 名称 | 货号 | 规格 |
| Human GPCR TGR7 Gene Knockout Kit(CRISPR) | abs6117234-1kit | 1kit |
| Human GPCR MRGX2 Gene Knockout Kit(CRISPR) | abs6108526-1kit | 1kit |
| Human GPCR MRGE Gene Knockout Kit(CRISPR) | abs6110449-1kit | 1kit |
| Human GPCR 2037 Gene Knockout Kit(CRISPR) | abs6115729-1kit | 1kit |






