Runx2
肌成纤维细胞,主要由肝脏中被激活的肝星状细胞(HSC)构成,是肝纤维化进程中不可或缺的角色。鉴于肌成纤维细胞在细胞外基质蛋白的合成、积累及重构方面的核心功能,将HSC作为治疗靶点被视为一种新兴的肝纤维化治疗策略,并正日益受到临床前研究与临床试验的关注。尽管先前的探索已揭示了runt相关转录因子2(Runx2)与非酒精性脂肪性肝病的进展存在关联,但Runx2在肝星状细胞活化以及肝纤维化中的确切作用机制仍尚待明确。
在2023年7月5日,重庆医科大学附属第一医院邓亮博士的研究团队在《临床与转化医学》(Clin Transl Med)期刊上发表了一篇题为“Runx2 activates hepatic stellate cells to promote liver fibrosis via transcriptionally regulating Itgav expression”的研究文章。该研究聚焦于人和小鼠的肝星状细胞(HSC),借助RNA-seq和ChIP-seq等先进的分析手段,深入揭示了Runx2在肝纤维化进程中通过转录水平调控Itgav(整合素α-V)表达对HSC活化的关键作用。这一发现暗示了Runx2可能成为肝纤维化治疗的一个有潜力的靶点。

研究摘要
本研究的核心发现指出,在人肝纤维化中,不论病因如何,Runx2的表达均呈现显著上升趋势;同样,在小鼠肝纤维化模型中,Runx2的表达也随病程发展逐渐增强,且主要定位于活化的肝星状细胞(HSC)内。通过基因敲除技术阻断HSC中的Runx2表达,可以显著减轻由多种因素(包括CCl4、DDC诱导以及蛋氨酸胆碱缺乏症)引发的肝纤维化程度。相反,通过注射HBAAV-Runx2或VA-Lip-Runx2实现Runx2的过表达,则加剧了CCl4诱导的肝纤维化。
体外实验进一步证实,Runx2对HSC的活化和增殖具有促进作用,而敲除Runx2则抑制了这些效应。结合RNA-seq和ChIP-seq分析,本研究揭示了Runx2通过与整合素α-V(Itgav)启动子的直接结合,上调其表达水平。进一步的研究表明,阻断Itgav的表达能够有效减弱Runx2诱导的HSC活化及肝纤维化进程。
此外,本研究还阐明了细胞因子(如TGF-β1、PDGF、EGF)通过激活蛋白激酶A(PKA)信号通路,促进HSC中Runx2的表达及核转位的机制。
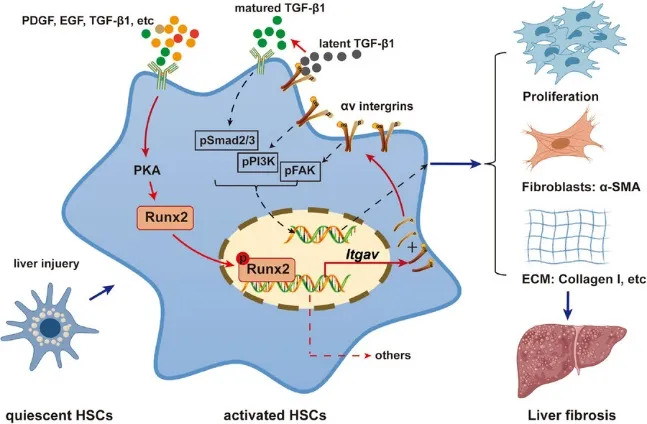 Runx2在肝星状细胞(HSC)活化及肝纤维化进程中的促进作用示意图
Runx2在肝星状细胞(HSC)活化及肝纤维化进程中的促进作用示意图
研究结果
(1)Runx2表达在不同肝纤维化样本中的上调情况:
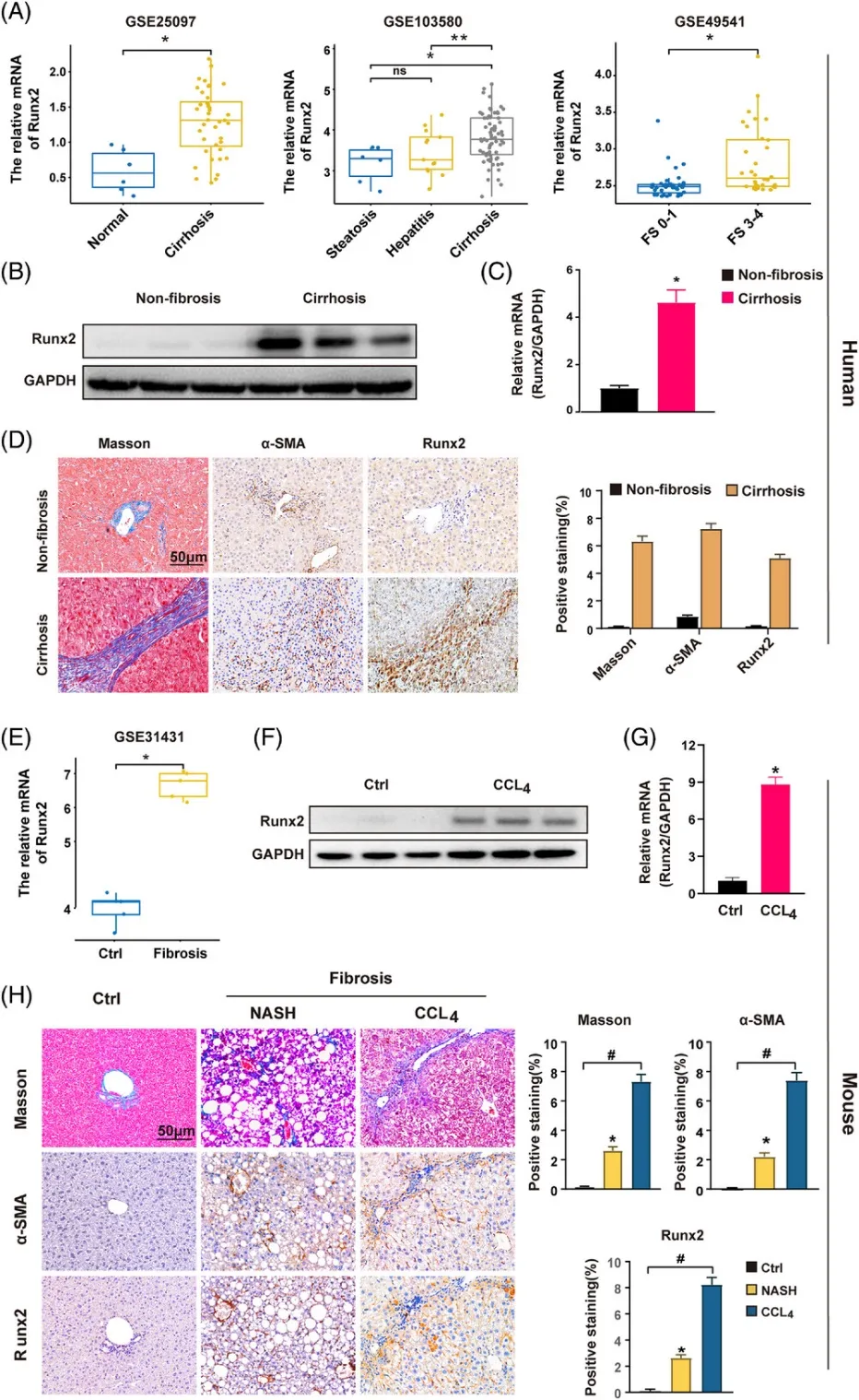
(A)相较于对照样本,Runx2在GSE25097队列的人肝硬化组织(左侧)、GSE103580队列的酒精性肝炎或肝硬化的人肝脏组织(中间)以及GSE49541队列的不同纤维化阶段(FS)的人肝纤维化组织(右侧)中的mRNA表达水平均有显著上升。
(B-C)利用Western blot分析和qRT-PCR技术,检测了人非纤维化与肝硬化肝样品中Runx2的蛋白和mRNA表达水平(样本数=3)。
(D)从非纤维化与肝硬化患者中采集肝脏组织样本,并进行Masson组织学染色、α-SMA和Runx2的免疫组化(IHC)染色分析。使用ImageJ软件对阳性染色区域进行定量检测。比例尺:50μm(样本数=10)。
(E)与对照样品相比,Runx2在GSE31431小鼠肝纤维化组织中的mRNA表达水平同样有所上升。
(F-G)通过腹腔注射CCl4(5μL/G体重)的方式,诱导小鼠肝纤维化持续4周。随后,利用Western blot和qRT-PCR技术,分析肝脏组织中Runx2的蛋白和mRNA表达水平(样本数=3)。
(H)给小鼠喂食高脂肪饮食12个月,以诱导NASH相关纤维化。随后,通过IP注射CCl4诱导小鼠肝纤维化4周。对肝脏组织进行Masson组织学染色、α-SMA和Runx2的IHC染色分析。使用ImageJ软件对阳性染色区域进行定量测量。比例尺:50μm(样本数=6)。数据表示为平均值±SEM,*p、**p<0.05表示与对照组相比有显著性差异,#p<0.01表示差异极显著;ns表示差异不显著。
(2)Runx2在活化HSC中的特异性定位及其体外活化过程中的时间依赖性增加
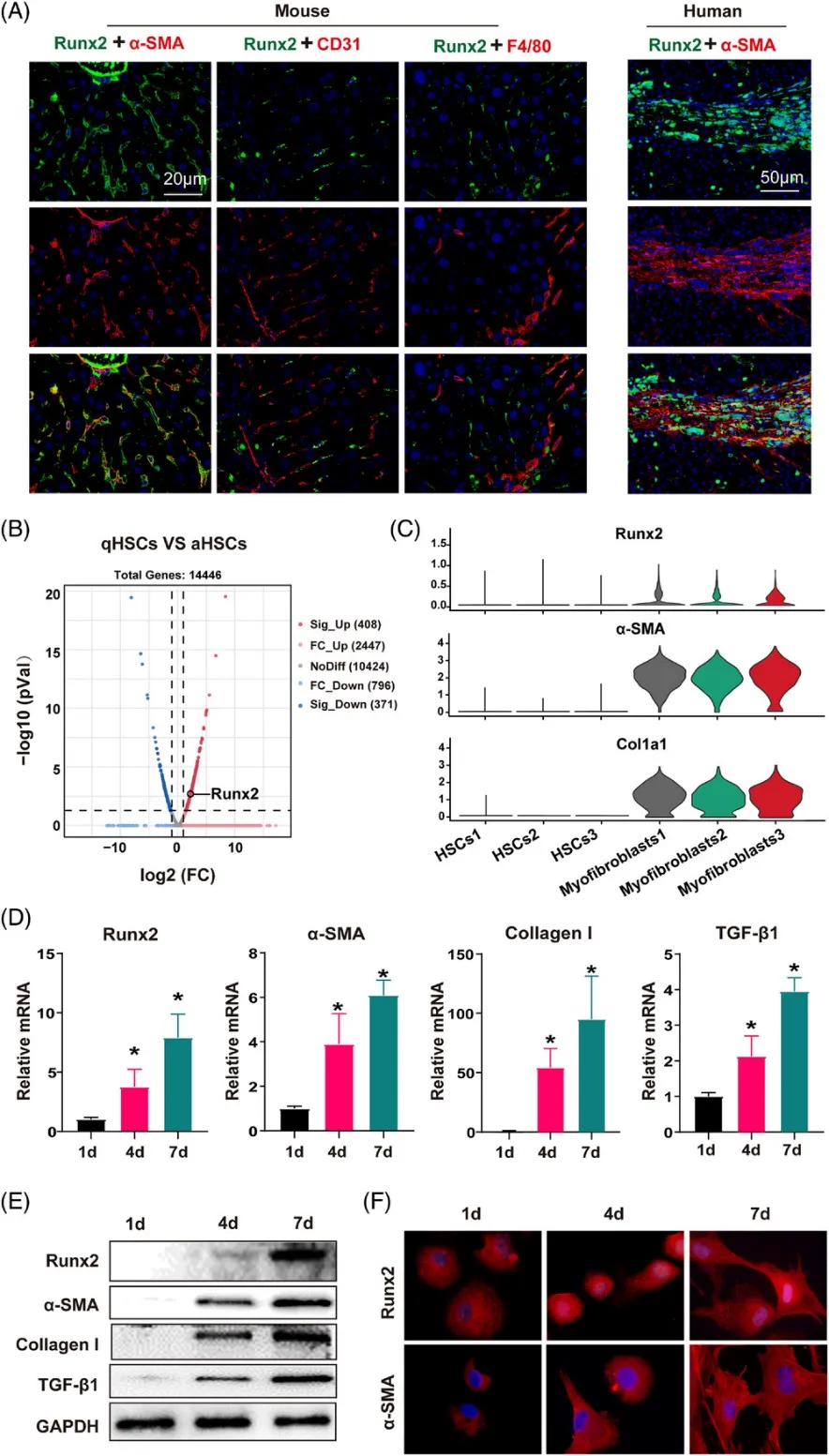
(A)通过免疫荧光显微镜观察CCl4处理的小鼠和肝硬化患者肝切片,对活化HSC(α-SMA,红色)、内皮细胞(CD31,红色)和Kupffer细胞(F4/80,红色)进行染色,同时显示Runx2(绿色)的定位。比例尺:小鼠为20μm,肝硬化患者为50μm(样本数=3)。
(B)对经olive或CCl4处理4周的小鼠进行原代HSC的分离,随后利用RNA-seq分析检测沉默HSC(qHSC,olive处理)和活化HSC(aHSC,CCl4处理)的基因表达差异,并通过火山图进行可视化。
(C)小提琴图展示了每个聚类中选定标记基因(Runx2、α-SMA和Col1a1)的相对表达水平;平均每个条件包含1000个细胞。
(D-E)从正常小鼠肝脏中分离出原代HSC,并在不同时间点(第1、4和7天)进行培养。通过Western blot和qRT-PCR技术检测Runx2、α-SMA、I型胶原(collagen I)和TGF-β1的蛋白和mRNA表达水平(样本数=5)。
(F)在指定时间点培养的原代HSC中,通过免疫荧光染色观察Runx2和α-SMA的表达情况,并展示高倍放大图像(样本数=3)。数据以平均值±SEM表示,与对照组相比,*p<0.05表示有显著性差异。
(3)HSC中Runx2的特异性敲除可减轻CCl4、DDC或MCD诱导的小鼠肝纤维化
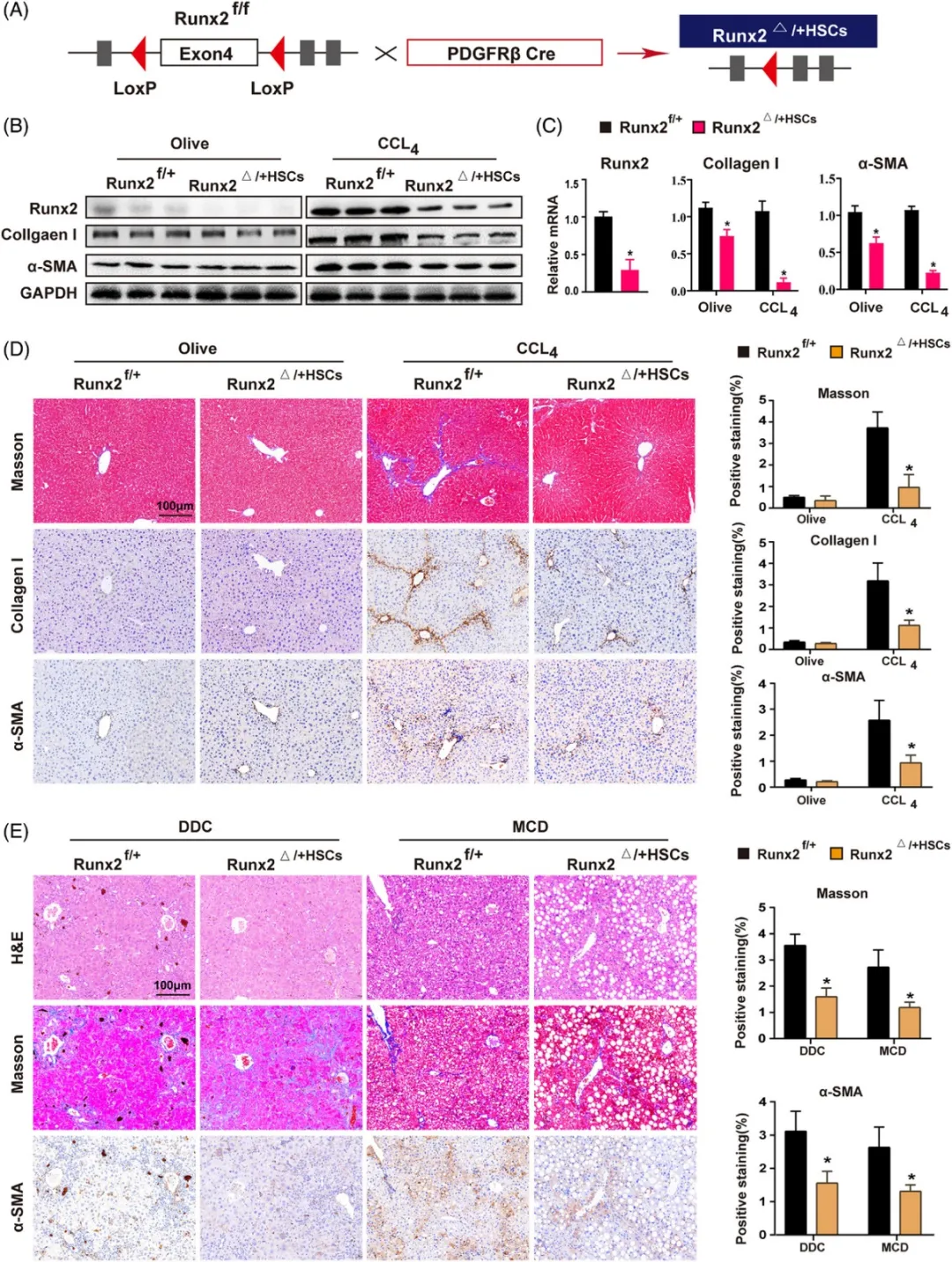
(A)构建小鼠HSC特异性Runx2敲除模型(Runx2△+HSC)的策略概览
(B-C)对HSC小鼠进行4周的olive或CCl4处理,随后采用Western blot和qRT-PCR技术,分析Runx2f+(野生型)和Runx2△+(Runx2敲除型)HSC中Runx2、I型胶原和α-SMA的蛋白质和mRNA表达水平(样本数=3)。
(D)展示olive或CCl4处理的Runx2f+和Runx2△+小鼠肝脏组织中I型胶原和α-SMA的Masson染色及免疫组化(IHC)染色的代表性图像。比例尺:100μm(样本数=5)。
(E)对Runx2f+和Runx2△+HSC小鼠进行0.1%DDC喂养4周以诱导胆汁淤积,或进行MCD喂养8周以诱导非酒精性脂肪性肝炎(NASH)。展示α-SMA的H&E染色、Masson染色及IHC染色的代表性图像。比例尺:100μm(样本数=3)。
(4) Runx2的过度表达加剧了CCl4诱导的肝纤维化
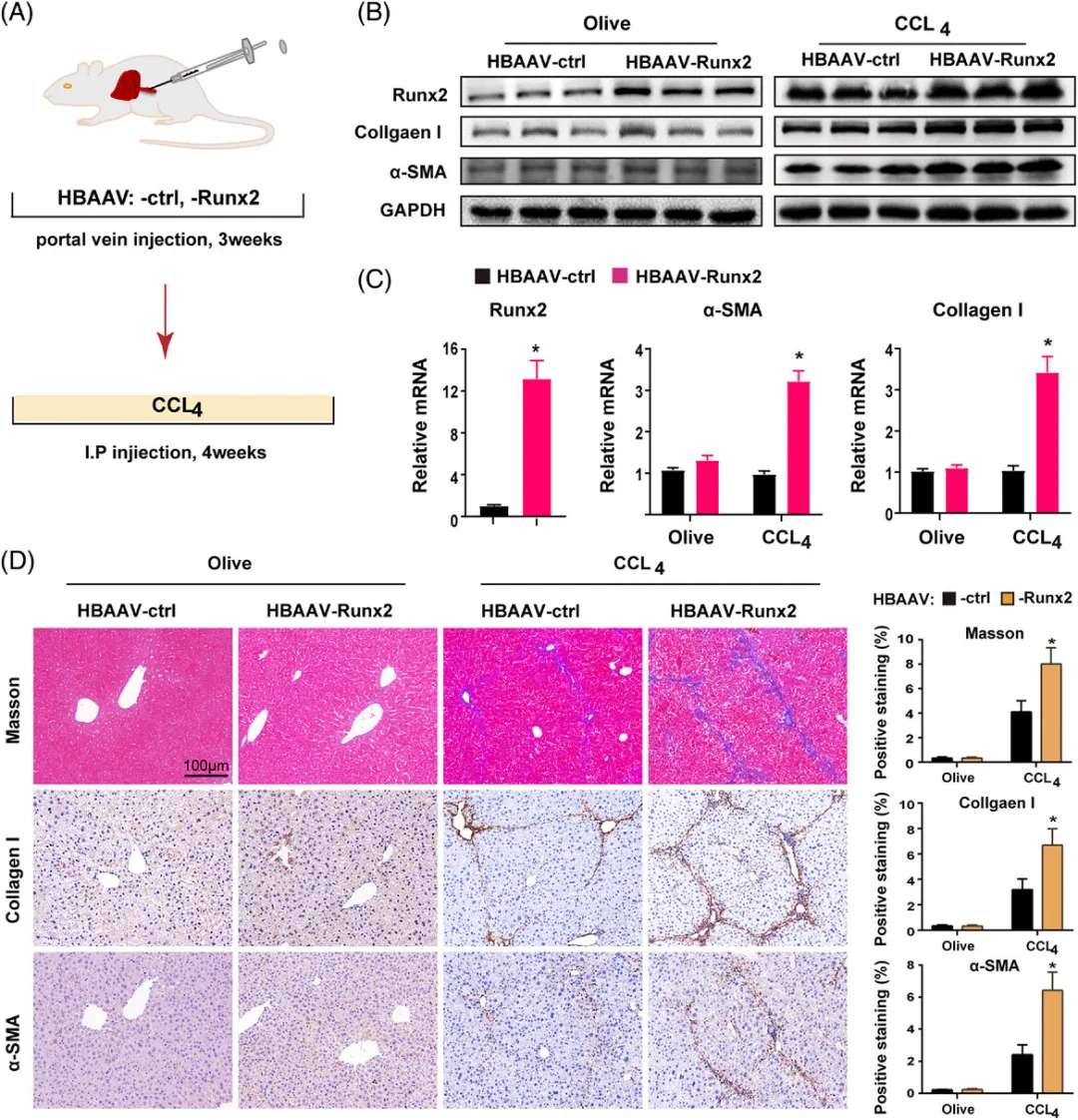
(A)实验设计概览:为探究Runx2过表达对肝纤维化的影响,我们设计了以下实验。小鼠在接受HBAAV-ctrl(对照组)或HBAAV-Runx2(实验组,100μL/只,浓度1×10^12 V g/mL,通过门静脉注射)3周后,连续4周接受olive或CCl4的注射。
(B-C)蛋白和基因表达检测:利用Western blot和qRT-PCR技术,我们检测了Runx2、I型胶原和α-SMA的蛋白和mRNA表达水平(样本数=3)。
(D)组织染色分析:在olive或CCl4处理的HBAAV-ctrl或HBAAV-Runx2小鼠中,我们对胶原I和α-SMA进行了Masson染色和免疫组化(IHC)染色,并展示了代表性图像。比例尺:100μm(样本数=5)。
(5)Runx2在体外对HSC活化的调控作用
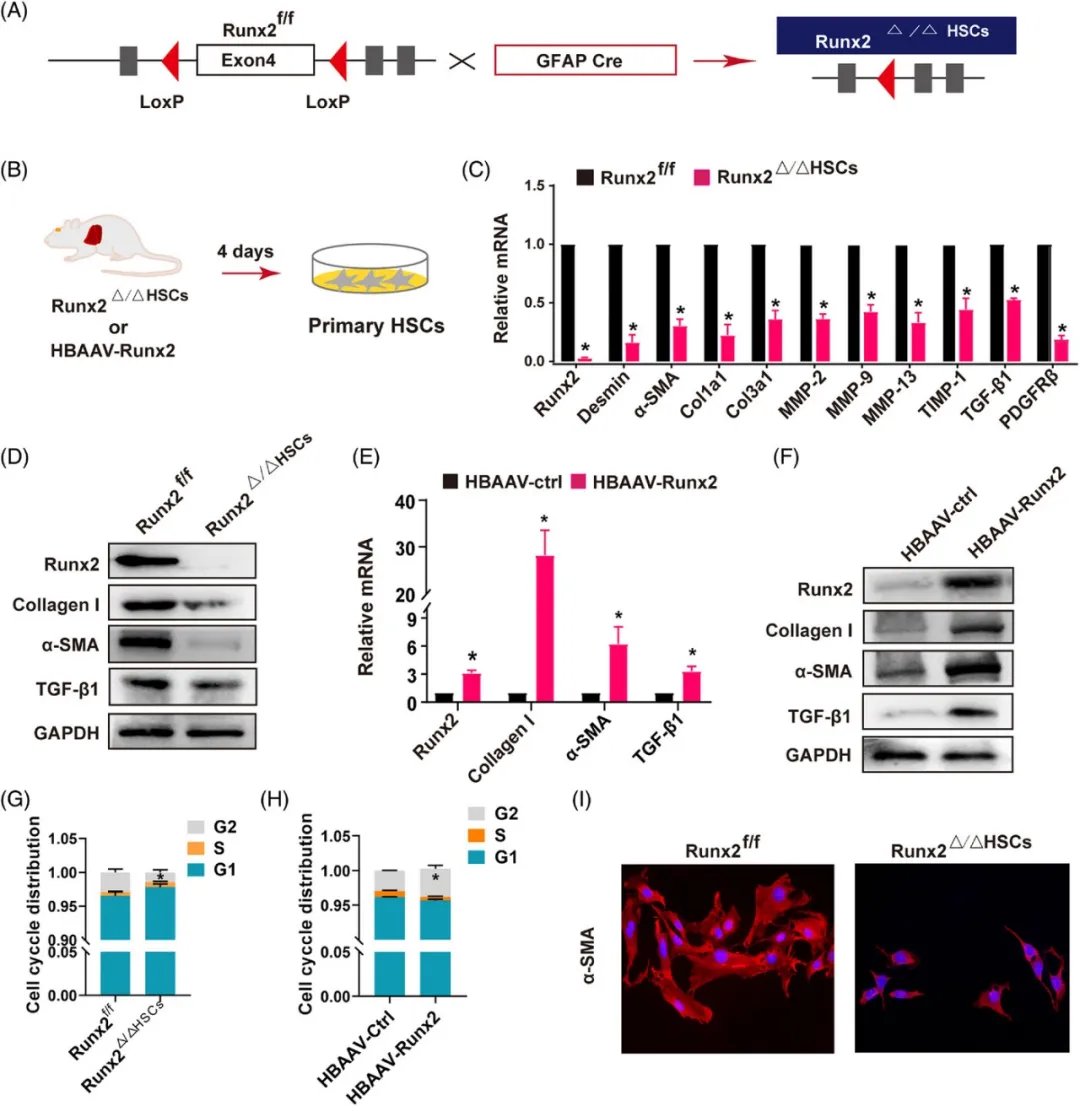
(A)示意图展示Runx2△/△HSC小鼠的HSC特异性缺失策略:该策略旨在探究Runx2在HSC活化过程中的作用。
(B)原代HSC的分离与培养:从Runx2△/△HSC或HBAAV-Runx2小鼠中分离出原代HSC,并在含有3%胎牛血清(FBS)的条件下培养4天,以观察其活化情况。
(C)纤维相关基因的检测:利用qRT-PCR技术,测定从Runx2f/f或Runx2△/△HSC小鼠中分离的原代HSC中纤维相关基因的表达水平。
(D)Western blot分析:对从Runx2f/f或Runx2△/△HSC小鼠中分离的原代HSC进行Western blot分析,检测Runx2、α-SMA、I型胶原和TGF-β1的蛋白表达。
(E-F)mRNA和蛋白表达分析:通过qRT-PCR和Western blot技术,分析从HBAAV-ctrl或HBAAV-Runx2小鼠中分离的原代HSC中Runx2、α-SMA、I型胶原和TGF-β1的mRNA和蛋白表达水平。
(G-H)流式细胞术分析:利用流式细胞术,分析原代HSC中各个细胞周期阶段的指数生长百分比,以评估Runx2对HSC增殖的影响。
(I)免疫荧光染色检测:对从Runx2f/f或Runx2△/△HSC小鼠中分离的原代HSC进行免疫荧光染色,检测α-SMA的活化特征,以进一步验证Runx2在HSC活化中的作用(样本数=3)。
(6)Itgav作为Runx2在肝纤维化中的直接下游靶点
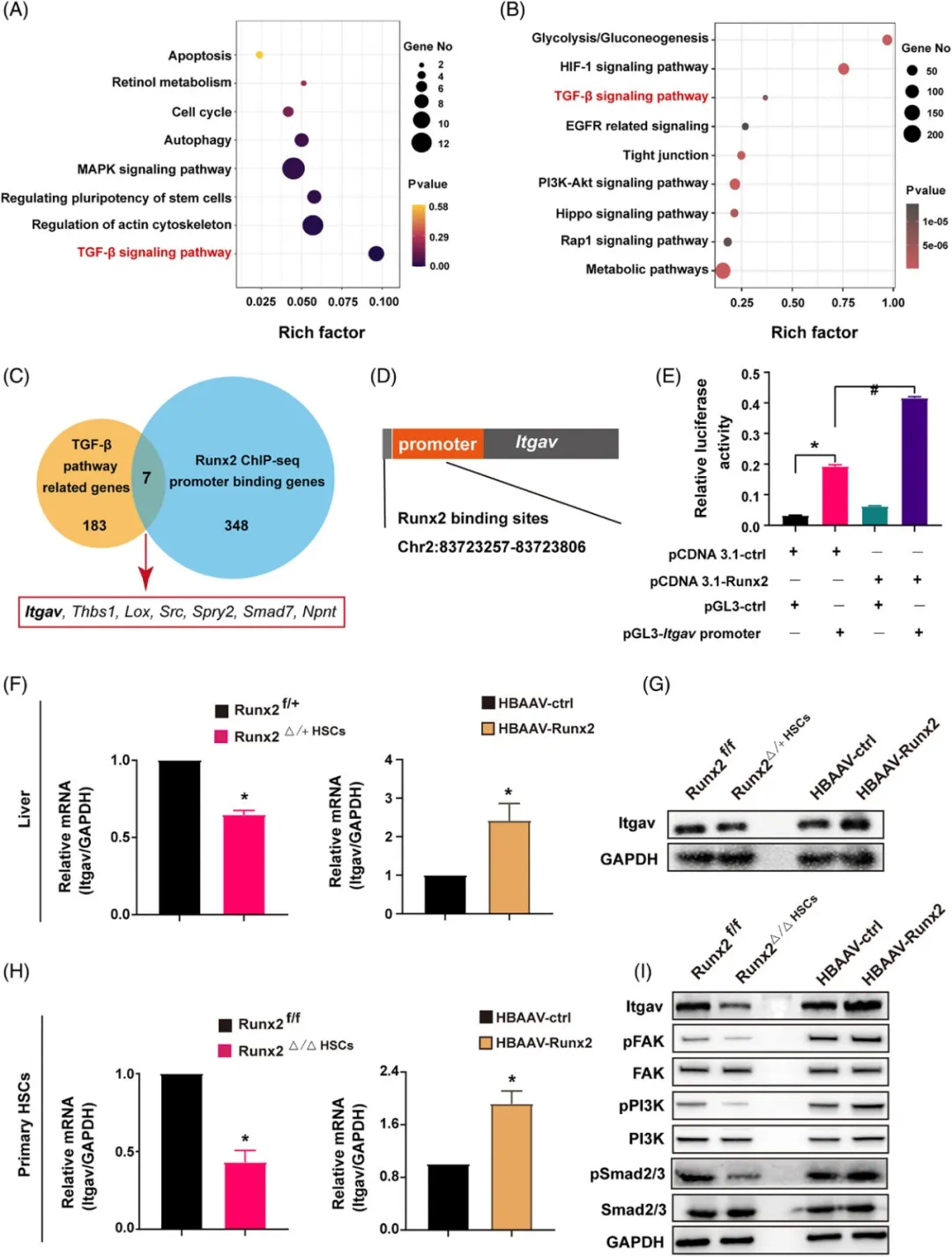
(A)RNA-seq分析:我们对使用Runx2或Scramble siRNA转染并培养3天的原代HSC进行了RNA-seq分析,随后对差异表达基因(DEG)进行了KEGG通路富集分析,以探究Runx2对HSC基因表达的影响。
(B)Runx2 ChIP-seq分析:从HBAAV-Runx2小鼠分离的原代HSC中,我们进行了Runx2的染色质免疫共沉淀测序(ChIP-seq)分析,并对DEG进行了KEGG通路富集分析,以揭示Runx2的潜在下游靶点。
(C)交叉分析:通过ChIP-seq分析,我们确定了348个与Runx2结合的基因启动子,并与183个TGF-β通路相关基因进行了交叉分析,以寻找Runx2与TGF-β通路之间的潜在联系。
(D)基因组图谱展示:我们展示了Itgav转录启动子区域的Runx2结合位点(位于Chr2:8372357-83723806),这进一步证实了Itgav作为Runx2下游靶点的可能性。
(E)荧光素酶报告基因分析:在转染了pCDNA 3.1-ctrl或pCDNA 3.1-Runx2的小鼠HSC细胞系上,我们进行了荧光素酶报告基因分析,以验证Runx2对Itgav启动子的直接调控作用。
(F-G)肝脏组织分析:从经CCl4处理4周的Runx2f/+、Runx2△/+HSC、HBAAV-ctrl和HBAAV-Runx2小鼠中采集肝脏组织,并通过qRT-PCR和Western blot分析Itgav的mRNA和蛋白表达水平。
(H-I)原代HSC分析:分别从Runx2f/f小鼠、Runx2△/△HSC小鼠、HBAAV-ctrl小鼠和HBAAV-Runx2小鼠中分离出原代HSC,并使用qRT-PCR分析Itgav的mRNA表达水平。同时,通过Western blot分析Itgav及其下游激酶(包括FAK、pFAK、PI3K、pPI3K、Smad2/3和pSmad2/3)的蛋白表达水平。数据以平均值±SEM表示;样本数=3,*p<0.05表示与对照组相比有显著性差异,#p<0.05表示与其他指定组相比有显著性差异。
(7)αv整合素抑制剂有效阻断Runx2过表达加剧的CCl4诱导肝纤维化
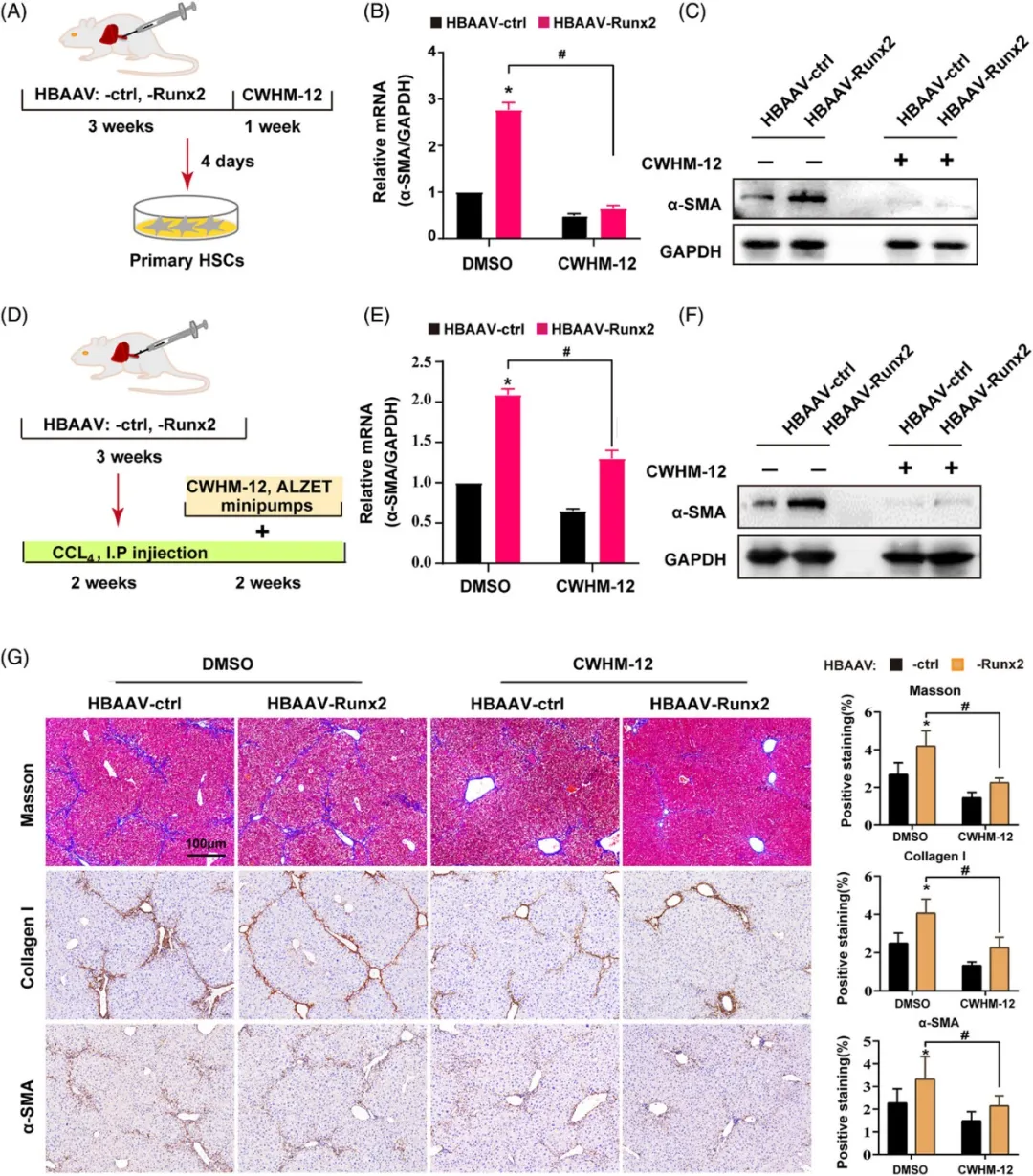
(A)体外实验处理方案:针对αv整合素的抑制剂CWHM-12被用于体外实验。HBAAV-ctrl小鼠或HBAAV-Runx2小鼠接受CWHM-12(剂量为100mg/kg/天)或安慰剂(载体)处理1周,随后分离出原代HSC进行进一步研究。
(B-C)原代HSC分析:利用Western blot和qRT-PCR技术,我们检测了原发性HSC中α-SMA的蛋白质和mRNA表达水平,以评估CWHM-12对HSC活化的影响(样本数=3)。
(D)体内实验处理方案:在体内实验中,小鼠首先接受2周的CCl4处理,然后植入含有CWHM-12(剂量为100mg/kg/天)或安慰剂(载体)的Alzet微型泵,并继续接受2周的CCl4处理。
(E-F)肝脏组织分析:通过qRT-PCR和Western blot分析,我们检测了接受或未接受CWHM-12处理的HBAAV-Runx2或HBAAV-ctrl小鼠肝脏组织中α-SMA的mRNA和蛋白表达水平,以评估CWHM-12在体内对肝纤维化的影响(样本数=3)。
(G)组织染色分析:我们展示了I型胶原和α-SMA的Masson染色和免疫组化(IHC)染色的代表性显微图像,以直观地展示CWHM-12对肝纤维化程度的改善效果。比例尺:100μm(样本数=5)。
(8)PKA调控Runx2活化及其在HSC中的核转位
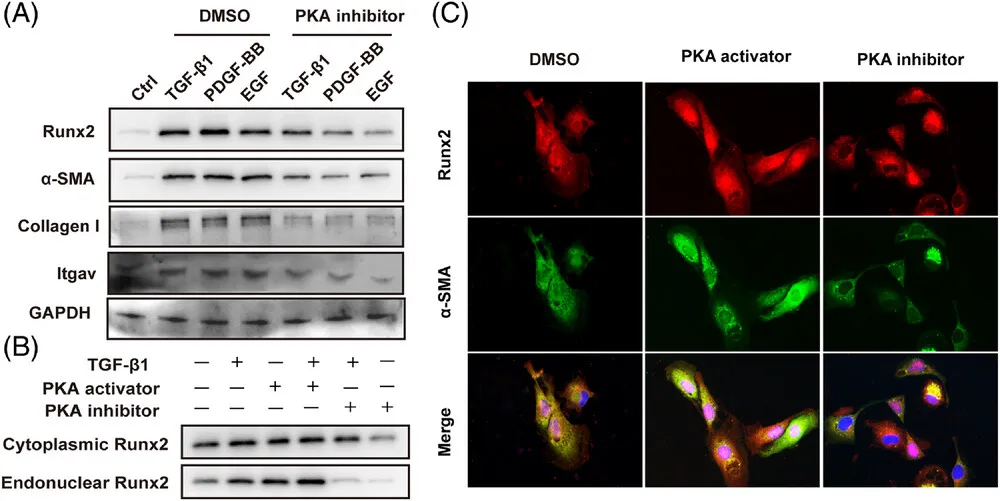
(A)Western blot分析:我们检测了经或未经TGF-β1(5 ng/mL)、PDGF-BB(5 ng/mL)、EGF(5 mg/mL)处理,并随后用DMSO或PKA抑制剂(PKI-6-22,10 nM/mL)处理12小时的原代HSC中Runx2、α-SMA、I型胶原和Itgav的蛋白表达水平。这一实验旨在探究生长因子和PKA抑制剂对HSC活化标志物的影响(样本数=3)。
(B)细胞质与细胞核Runx2分析:我们进一步分析了经或未经TGF-β1处理,并随后用PKA活化剂(8-Bromo-cAMP,0.5 nM/mL)或抑制剂处理的原代HSC中,Runx2在细胞质和细胞核内的分布。这一实验通过Western blot技术实现,旨在揭示PKA对Runx2核转位的调控作用(样本数=3)。
(C)免疫荧光染色分析:为了直观地展示PKA抑制剂或活化剂对Runx2和α-SMA表达及定位的影响,我们对处理后的原代HSC进行了免疫荧光染色。这一实验提供了关于PKA调控HSC活化标志物表达和分布的直观证据(样本数=3)。
| 名称 | 货号 | 规格 |
| RUNX2 (D1L7F) Rabbit mAb | 12556S | 100ul |
| RUNX2 (D1H7) Rabbit mAb | 8486S | 100ul |
| RUNX2 (27-K) | sc-101145 | 50ug/0.5ml |
| RUNX2 (C-12) | sc-390715 | 200ug/ml |







