YAP/TAZ因子
1、肥胖促进人和小鼠白色脂肪细胞YAP/TAZ激活
为了深入探究YAP(Yes-associated protein)和TAZ(Transcriptional co-activator with PDZ-binding motif)在白色脂肪组织中的活性状态及其与肥胖的关系,研究者对YAP/TAZ的亚细胞定位及其靶基因的表达水平进行了检测。实验结果显示,在肥胖患者及肥胖模型小鼠的白色脂肪细胞中,YAP/TAZ在细胞核内的表达显著高于细胞质中的表达,这一趋势与纤瘦个体形成鲜明对比,后者在细胞核与细胞质中的YAP/TAZ表达量并未表现出显著差异(如图1a、b、d、e所示)。进一步分析发现,肥胖个体中YAP/TAZ的靶基因表达水平也明显高于纤瘦个体(如图1c、f所示)。这些结果表明,在肥胖状态下,白色脂肪细胞中的YAP/TAZ处于持续激活状态,这提示YAP/TAZ可能在肥胖相关的生物学过程中发挥重要作用,并为理解肥胖及其相关代谢性疾病的发病机制提供了新的线索。

2、特异性脂肪细胞YAP/TAZ缺失导致肥胖脂肪细胞死亡增加
为了探讨YAP(Yes-associated protein)和TAZ在白色脂肪细胞中的具体功能,研究者采用了高脂饲料喂养tamoxifen诱导的iAd-Yap/Taz-KO(诱导型脂肪细胞特异性YAP/TAZ敲除)小鼠,并持续观察12周。结果显示,相较于野生型小鼠,iAd-Yap/Taz-KO小鼠的体重、空腹血糖水平、内脏脂肪(vWAT)及皮下脂肪(sWAT)重量均显著降低(图2a-c)。在细胞形态层面,尽管iAd-Yap/Taz-KO小鼠的脂肪细胞平均大小未发生明显变化,但脂肪组织中的脂肪细胞数量显著减少,同时脂肪细胞内冠状结构增多(图2d-f)。此外,高脂喂养的iAd-Yap/Taz-KO小鼠体内巨噬细胞数量及细胞凋亡数量均显著高于野生型小鼠(图2g, h),这表明在肥胖状态下,脂肪细胞中YAP/TAZ的缺失会加剧细胞死亡。
进一步地,当高脂饲料喂养时间延长至16周时,研究者发现iAd-Yap/Taz-KO小鼠体内YAP、TAZ的表达水平几乎恢复至与野生型小鼠相当。为了验证iAd-Yap/Taz-KO小鼠中YAP/TAZ敲除对脂肪生成的影响,研究者对Tamoxifen注射后的脂肪细胞进行了追踪观察。结果显示,在Tamoxifen注射1周后,几乎所有脂肪细胞均呈现绿色标记;而在8周和16周后,Tomato阳性的细胞数量逐渐增加(图2i-k),这表明这些细胞是由Tomato阳性的脂肪前体细胞分化而来。因此,可以推断,在iAd-Yap/Taz-KO小鼠中,脂肪细胞YAP/TAZ缺失后,原有脂肪细胞因死亡而减少,同时伴随着脂生成过程的加强,新生成的野生型脂肪细胞逐渐替代了原有的YAP/TAZ敲除脂肪细胞。这一发现不仅揭示了YAP/TAZ在维持脂肪细胞存活及脂肪组织稳态中的关键作用,也为肥胖及其相关代谢疾病的治疗提供了新的思路。

3、脂肪细胞的YAP/TAZ缺失导致细胞死亡和脂代谢障碍
为了更准确地评估YAP(Yes-associated protein)和TAZ在脂肪细胞中的作用,研究者采用了Ad-Yap/Taz-KO(脂肪细胞特异性YAP/TAZ敲除)小鼠模型,并排除了新生脂肪细胞对实验结果的潜在干扰。在连续20周的高脂饮食(HFD)喂养后,Ad-Yap/Taz-KO小鼠的体重、空腹血糖水平、内脏脂肪(vWAT)及皮下脂肪(sWAT)重量均显著低于野生型小鼠(图3a、b、c)。这一发现表明,YAP/TAZ对于脂肪组织的正常发育和维持至关重要。
进一步地,在HFD喂养14周后,研究者观察到Ad-Yap/Taz-KO小鼠的脂肪细胞中细胞死亡数量显著增加,冠状细胞结构也明显增多(图3d、e)。同时,脂滴特异性蛋白perilipin-1的表达显著减少,而巨噬细胞特异性蛋白CD68的表达则明显增多(图3f)。此外,M2型巨噬细胞标签基因(如Arg1、Mcr1、IL-10)的表达增多,而M1型巨噬细胞标签基因(如iNOS)的表达减少(图3g、h),这提示了脂肪组织中巨噬细胞极化的改变。值得注意的是,脂肪细胞标签基因的表达也普遍减少(图3i),这进一步证实了YAP/TAZ缺失对脂肪细胞功能的严重影响。
综上所述,这些结果表明YAP/TAZ在肥胖过程中是脂肪细胞存活和脂代谢功能所必需的。一旦YAP/TAZ缺失,将导致脂肪细胞凋亡增加、脂代谢功能障碍以及脂肪组织中巨噬细胞极化的改变,这些变化可能共同促进了肥胖相关代谢性疾病的发生和发展。

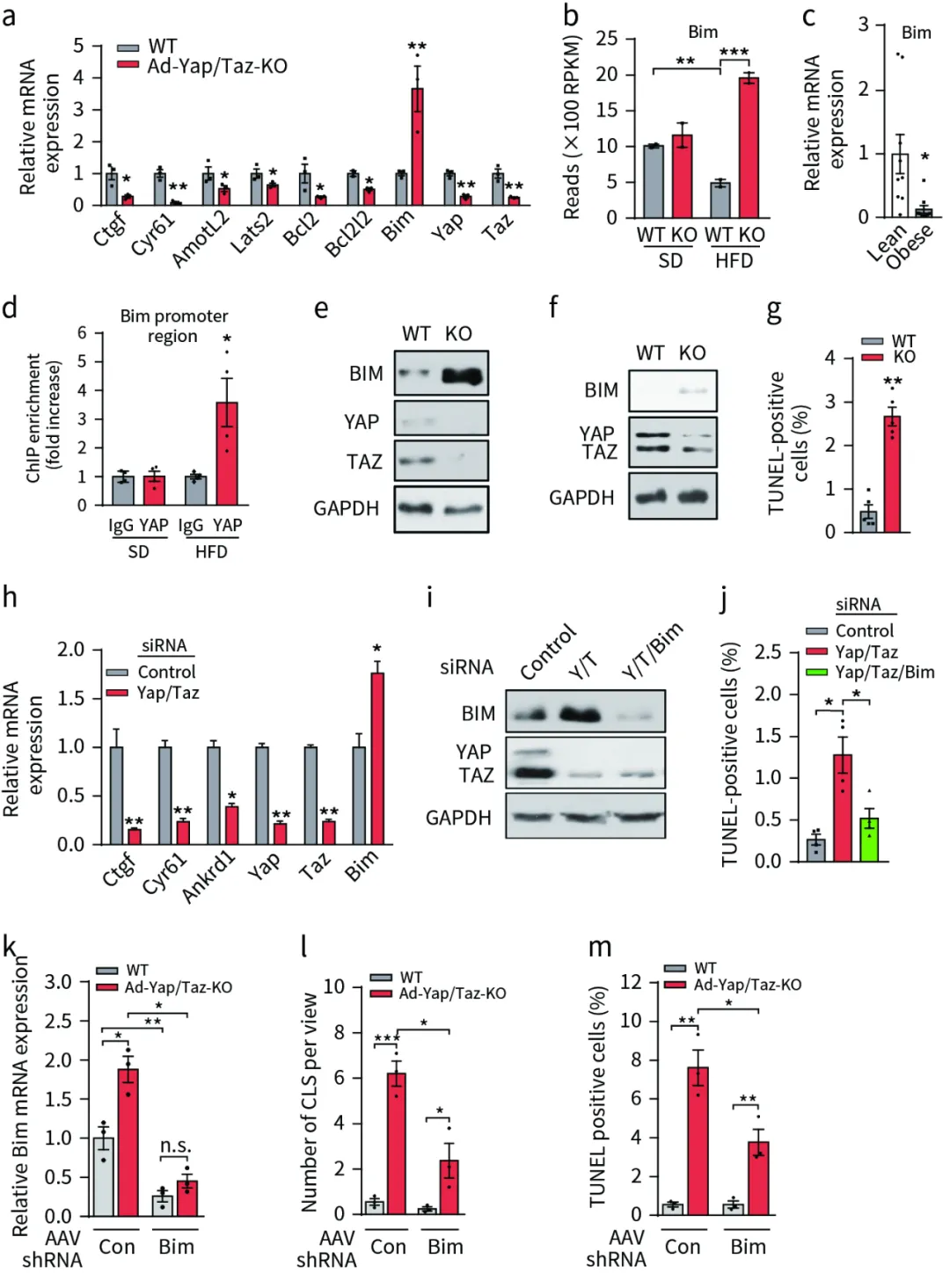
4、YAP/TAZ调控脂肪细胞促凋亡、抗凋亡的基因表达
为了深入探究YAP(Yes-associated protein)和TAZ如何调控脂肪细胞的生存机制,研究者对高脂饮食(HFD)喂养4周的Ad-Yap/Taz-KO(脂肪细胞特异性YAP/TAZ敲除)小鼠的脂肪细胞进行了基因表达分析。实验结果显示,相较于野生型小鼠,Ad-Yap/Taz-KO小鼠中YAP/TAZ靶基因以及抗凋亡基因的表达显著减少,而促凋亡基因的表达则明显增加(图4a-c)。
进一步地,研究者通过染色质免疫沉淀(ChIP)分析发现,在HFD喂养的小鼠脂肪细胞中,YAP与促凋亡基因Bim的启动子区域的一个TEAD结合位点结合增加,这提示了YAP可能直接参与调控Bim的表达(图4d)。同时,Ad-Yap/Taz-KO小鼠的脂肪组织和血管周围分数(SVF)组织中,BIM以及YAP/TAZ的表达均显著高于野生型小鼠(图4b-f),并且细胞凋亡的数量也明显增加(图4g)。
为了验证这一发现,研究者还在抑制分化的3T3-L1脂肪细胞中下调了Yap和Taz的表达,结果同样发现YAP/TAZ靶基因的表达受到抑制,伴随着Bim表达的增加和细胞凋亡的增多(图4h-j)。更重要的是,当使用shRNA技术抑制Ad-Yap/Taz-KO小鼠中BIM的表达时,冠状结构的形成和细胞凋亡均得到了明显的抑制(图4k-m)。
综上所述,这些数据有力地表明,YAP/TAZ通过抑制促凋亡基因Bim的表达来促进脂肪细胞的存活。这一发现不仅揭示了YAP/TAZ在调控脂肪细胞生存中的重要作用,也为肥胖及其相关代谢性疾病的治疗提供了新的潜在靶点。
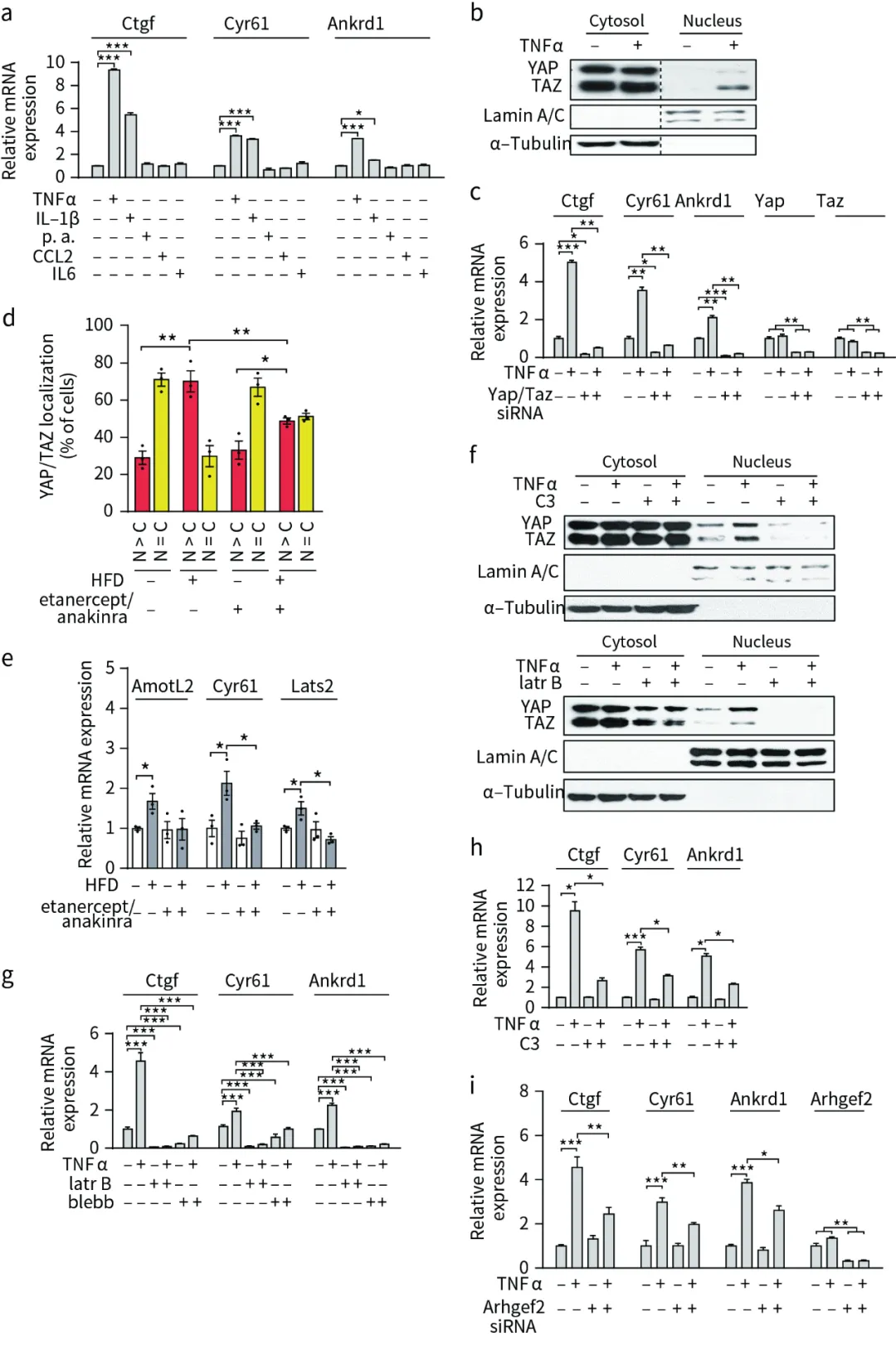
5、TNF-α和IL-1β诱导YAP/TAZ核转移和转录活性
为了深入探究肥胖过程中脂肪组织内YAP(Yes-associated protein)和TAZ激活的潜在信号机制,研究者对3T3-L1脂肪细胞进行了一系列实验。他们首先考察了软脂酸及多种细胞因子对YAP/TAZ靶基因表达的影响。实验结果显示,TNF-α(肿瘤坏死因子-α)和IL-1β(白细胞介素-1β)能够显著促进YAP/TAZ靶基因Ctgf、Cyr61和Ankrd1的表达,并诱导YAP/TAZ发生核转移。当使用YAP/TAZ特异性siRNA抑制其表达时,TNF-α和IL-1β对YAP/TAZ靶基因的促进作用也随之被抑制(图5a-c)。此外,TNF-α抑制剂Etanercept和IL-1β抑制剂Anakinra均能抑制高脂饮食(HFD)诱导的小鼠体内YAP/TAZ的核转移及靶基因表达(图5d、e)。
然而,值得注意的是,在脂肪细胞中,TNF-α和IL-1β并不能增加YAP/TAZ的表达量或促进其磷酸化,同时调节Hippo通路激酶LATS1/2的表达也并未对YAP/TAZ靶基因的表达产生显著影响。这表明,TNF-α和IL-1β对YAP/TAZ活性的调控并不依赖于Hippo通路。进一步地,研究者发现,使用C3(外源酶C3)、latr B(拉春库林B)和blebb(blebbisatin)等药物能够抑制YAP/TAZ的核转移及靶基因表达(图5f-h)。
为了确定参与TNF-α诱导的脂肪细胞RhoA激活的具体RhoGEF蛋白,研究者利用Arhgef2特异性siRNA干扰其表达(图5i),并发现这能够抑制YAP/TAZ靶基因的表达。这些结果表明,ArhGEF和RhoA介导的肌动球蛋白收缩对于TNF-α和IL-1β诱导的YAP/TAZ核转移及其随后的转录活性是必需的。这一发现不仅揭示了肥胖过程中YAP/TAZ激活的新机制,也为肥胖及其相关代谢性疾病的治疗提供了新的潜在靶点。
为了更全面地理解TNF-α(肿瘤坏死因子-α)和IL-1β(白细胞介素-1β)如何激活YAP(Yes-associated protein)和TAZ,研究者进一步探索了其中涉及的信号通路。他们测试了多种抑制剂对这两种细胞因子诱导的YAP/TAZ靶基因表达的影响。
实验结果显示,JNK(c-Jun N-terminal kinase,c-Jun氨基末端激酶)抑制剂能够显著抑制YAP/TAZ靶基因的表达(图6a)。同时,利用JNK1/2特异性siRNA干扰JNK的表达也导致了YAP/TAZ靶基因表达的下降(图6b)。然而,值得注意的是,C3(外源酶C3)和latr B(拉春库林B)这两种能够抑制YAP/TAZ核转移的药物,并未对TNF-α诱导的JNK磷酸化产生影响,这表明TNF-α诱导的JNK激活与Rho介导的通路是独立的。
尽管latr B能够抑制TNF-α和IL-1β诱导的YAP/TAZ核转移,但JNK抑制剂却未能产生相同的效果(图6c)。这一发现说明,JNK虽然能够调节YAP/TAZ的功能,但并不直接参与其核转移过程。另外,研究者还发现,c-Jun特异性siRNA能够干扰c-Jun的表达,并抑制TNF-α和IL-1β诱导的YAP/TAZ靶基因表达(图6d)。这进一步证实了JNK和c-Jun在介导TNF-α诱导的YAP/TAZ转录活性中的重要作用。
综上所述,这些实验结果表明,RhoA介导的肌动球蛋白收缩主要调节TNF-α和IL-1β诱导的YAP/TAZ核转移过程,而JNK/c-Jun信号通路则参与调控YAP/TAZ的转录活性。这一发现不仅加深了我们对YAP/TAZ激活机制的理解,也为肥胖及其相关代谢性疾病的治疗提供了新的思路和潜在靶点。

结论总结
在高脂饮食(HFD)饲养的小鼠模型中,白色脂肪细胞内YAP(Yes相关蛋白)和TAZ的缺失会导致严重的脂肪营养不良症状,并引发显著的脂肪细胞死亡。相反,在YAP/TAZ缺陷的小鼠体内,观察到促凋亡基因BIM的表达下调,进而减少了脂肪细胞的凋亡数量。在分化成熟的脂肪细胞中,TNF-α(肿瘤坏死因子-α)和IL-1β(白细胞介素-1β)通过激活RhoA介导的肌动球蛋白收缩机制,促进了YAP/TAZ的核内转移。同时,这两种细胞因子还激活了c-Jun、JNK(c-Jun氨基末端激酶)和AP-1(激活蛋白-1),增强了YAP/TAZ介导的转录调控活动。上述数据表明,YAP/TAZ信号通路在肥胖进程中可能发挥着调控脂肪细胞死亡以及代偿性脂肪生成的重要作用。
简而言之,本研究揭示了YAP/TAZ在脂肪细胞存活和肥胖相关代谢调节中的核心功能。YAP/TAZ的缺失会导致脂肪营养不良和细胞凋亡,而促凋亡基因的抑制可减轻这种影响。此外,TNF-α和IL-1β等炎症介质通过特定的信号转导途径,如RhoA介导的肌动球蛋白收缩和c-Jun/JNK/AP-1信号轴,促进YAP/TAZ的核转移和转录活性,可能在肥胖及其并发症的病理生理过程中扮演关键角色。这些发现为肥胖症及其相关疾病的治疗提供了新的潜在干预靶点和研究视角。
| 名称 | 货号 | 规格 |
| Rabbit anti-Phospho-YAP1(Ser127) Monoclonal Antibody | abs156033-50ul | 50ul |
| Rabbit anti-Phospho-YAP1(Ser127) Monoclonal Antibody(6C2) | abs159918-100ul | 100ul |
| sc-271134AF790 | 200ug/ml | |
| Rabbit anti-YAP1 Monoclonal Antibody(5E9) | abs159919-100ul | 100ul |








