T细胞激活
在人体免疫系统中,T淋巴细胞(T细胞)扮演着举足轻重的角色。它们不仅参与抵御外来病原体的入侵,还在监控和清除体内异常细胞(如肿瘤细胞)方面发挥着关键作用。然而,T细胞的功能并非一成不变,其活化状态直接影响免疫系统的效能。本文将深入探讨T细胞激活的机制、当前的技术进展,以及这些技术在免疫治疗中的应用,特别是在CAR-T细胞疗法、肿瘤浸润淋巴细胞(TIL)培养以及调节性T细胞(Treg)激活培养方面的最新成果。
一、T细胞激活的双信号机制
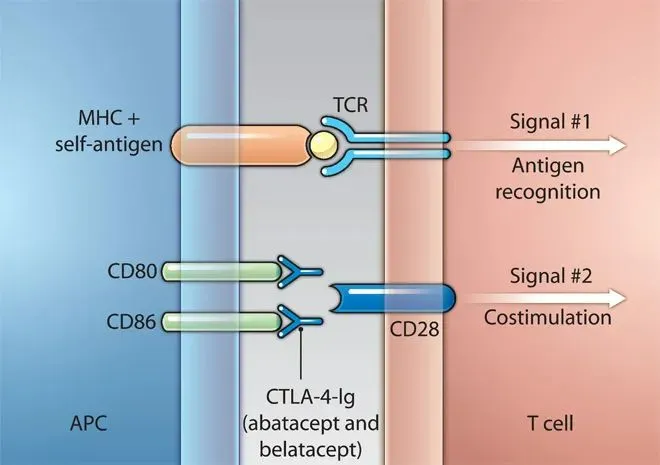
T细胞的活化是一个复杂而精细的过程,需要多重信号的协同作用。根据经典的“双信号模型”,T细胞的活化需要两个关键步骤:
-
第一信号:T细胞受体(TCR)/CD3复合物识别抗原呈递细胞(APC)表面的主要组织相容性复合体(MHC)-肽复合物。这一步骤确保了T细胞能够特异性地识别外来抗原或自身异常细胞。
-
第二信号:协同刺激分子间的相互作用,如CD28/B7、LFA-1/ICAM-1等。这些分子的结合为T细胞提供了额外的活化信号,确保T细胞在识别抗原的同时,也获得了足够的刺激以启动其活化程序。值得注意的是,如果T细胞仅接受到第一信号而缺乏第二信号的刺激,它们将迅速进入低反应性或失能状态,这被称为T细胞的“无能”现象。
二、体外T细胞激活技术
鉴于T细胞在免疫系统中的核心地位,如何在体外有效激活T细胞成为免疫治疗领域的研究热点。目前,常用的体外T细胞激活方法主要包括:
-
抗体包被法:使用抗CD3抗体和抗CD28抗体包被多孔板或磁珠,通过模拟体内的第一和第二刺激信号来激活T细胞。这种方法简单有效,是体外T细胞培养不可或缺的工具。
-
人工抗原呈递细胞(AAPC):通过基因工程手段改造的细胞,能够表达特定的抗原和协同刺激分子,从而模拟APC的功能,有效激活T细胞。
-
CAR基因修饰:在CAR-T细胞疗法中,通过基因工程技术将嵌合抗原受体(CAR)导入T细胞,使其能够特异性地识别并杀死目标细胞(如肿瘤细胞)。在CAR-T细胞的培养过程中,除了使用抗体包被法外,还可以利用目标抗原(如MSLN)与抗CD28抗体共同刺激T细胞,以提高CAR的表达阳性率和降低培养成本。
三、CAR-T细胞疗法:从实验室到临床的跨越
CAR-T细胞疗法是一种革命性的免疫治疗手段,通过基因工程改造患者的T细胞,使其能够识别并杀死特定的肿瘤细胞。CAR-T细胞的培养过程包括采血、分离T细胞、激活T细胞、CAR基因修饰、扩增CAR-T细胞以及回输患者体内等多个步骤。
在CAR-T细胞的培养过程中,T细胞的离体扩增需要持续的、适当的激活。传统的激活方法包括使用抗体包被的多孔板或磁珠。然而,近年来,研究人员开始探索更为高效、低成本的激活策略。例如,有研究团队在分选获得T细胞后,首先将针对特定抗原(如MSLN)的CAR基因导入T细胞,然后再使用该抗原与抗CD28抗体共同刺激T细胞。这种方法不仅降低了成本,还提高了CAR的表达阳性率,为CAR-T细胞疗法的临床应用提供了新的思路。
四、肿瘤浸润淋巴细胞(TIL)培养:从肿瘤组织中挖掘潜力
肿瘤浸润淋巴细胞(TIL)是一群从血液中迁移至肿瘤处发挥作用的淋巴细胞,它们对肿瘤细胞具有特异性的杀伤作用。然而,TIL的临床使用需要大量的细胞数量,且需要多个疗程的治疗。因此,如何在短时间内获得大量高质量的TIL成为研究人员面临的挑战。
Rosenberg开发的TIL细胞体外扩增方法是目前通用的方法。该方法通过消化肿瘤组织,分离出浸润淋巴细胞,然后使用含有IL-2的培养基进行体外诱导和扩增。然而,这种方法的周期较长,且CD3+CD8+杀伤性T细胞的比例较低。针对这些问题,研究人员开始探索更为高效的培养体系。通过在培养基中添加合适的细胞因子(如IL-7、IL-15、TNF-α)和抗体(如CD3抗体、CD28抗体),可以将诱导时间缩短至7天左右,并在25-30天内扩增至临床所需数量。这一进步极大地缩短了TIL细胞体外扩增的周期,提高了疗法的及时性,并获得了较高比例的CD3+CD8+T细胞,从而提高了临床疗效。

五、调节性T细胞(Treg)的激活培养:免疫调节的新策略
调节性T细胞(Treg)是免疫调节系统的重要组成部分,它们能够维持对自身抗原的耐受性并预防自身免疫疾病。近年来,越来越多的研究表明,对Treg细胞进行调控可以治疗自身免疫性疾病和癌症,并有利于器官移植和伤口愈合。
然而,Treg细胞在外周血中的比例较低,且难以分离和培养。因此,如何在体外有效激活和培养Treg细胞成为研究人员关注的焦点。目前,常用的方法包括使用CD3/CD28抗体偶联磁珠或抗体,并在培养基中添加IL-2和TGF-β等生长因子来激活刺激Treg细胞。这些方法的应用不仅提高了Treg细胞的纯度和活性,还为Treg细胞在免疫治疗中的应用提供了新的可能。
六、未来展望与挑战
尽管T细胞激活技术已经取得了显著的进展,但仍面临诸多挑战。例如,如何进一步提高T细胞的活化效率和特异性?如何降低CAR-T细胞疗法和TIL培养的成本和复杂性?如何更好地调控Treg细胞以治疗自身免疫性疾病和癌症?
为了应对这些挑战,研究人员正在探索新的激活策略和技术。例如,利用基因编辑技术(如CRISPR/Cas9)来优化CAR的设计和提高T细胞的活化效率;开发新型的人工抗原呈递系统来模拟体内的免疫环境;以及利用机器学习等技术来预测和优化T细胞的培养条件。
此外,随着对T细胞生物学和免疫调节机制的深入理解,研究人员还将探索更多基于T细胞的免疫治疗策略。例如,通过调控T细胞的代谢状态来增强其抗肿瘤活性;利用T细胞分泌的细胞因子来调节免疫微环境;以及开发针对特定肿瘤微环境的T细胞疗法等。
总之,T细胞激活技术作为免疫治疗领域的重要组成部分,正经历着快速的发展和变革。随着研究的不断深入和技术的不断进步,我们有理由相信,未来将有更多基于T细胞的免疫治疗策略问世,为更多患者带来生命的希望。同时,我们也期待这些技术能够在自身免疫性疾病、感染性疾病以及器官移植等领域发挥更大的作用,为人类健康事业做出更大的贡献。
| 名称 | 货号 | 规格 |
| 小鼠T细胞分化12色Panel | LXFM12-1 | 12色 |
| 人T细胞扩增培养基 | abs9823-1kit | 1kit |
| MC38结直肠癌小鼠肿瘤抗原特异性T细胞含量检测刺激试剂盒 | abs57007-20T | 20T |
| Hepa 1-6-OVA肝癌小鼠肿瘤抗原特异性T细胞含量检测刺激试剂盒 | abs57020-20T | 20T |