单细胞组学
引言
随着单细胞测序技术的飞速发展,科研人员得以从前所未有的深度和广度上解析生命体系的复杂性。从单细胞转录组、原位单细胞转录、单细胞DNA修饰到单细胞ChiP-Seq,这些技术为我们提供了丰富的细胞异质性信息,极大地推动了生物学、医学以及疾病研究的发展。然而,面对海量的单细胞组学数据,如何有效地解读、比较和整合成为了一个亟待解决的问题。近期,来自哈佛-麻省理工博德研究所(Broad Institute of Harvard and MIT)和密歇根大学的研究团队在Cell杂志上发表了一篇题为《Single-Cell Multi-omic Integration Compares and Contrasts Features of Brain Cell Identity》的研究论文,提出了一种名为LIGER(linked inference of genomic experimental Relationships)的新算法,为单细胞组学数据的整合提供了新的解决方案。

一、单细胞组学数据的挑战与机遇
单细胞测序技术的兴起,使得我们能够以前所未有的分辨率研究细胞间的异质性。不同器官组织、不同病理状态下的单细胞数据不断涌现,为我们揭示了细胞间复杂的相互作用和调控网络。然而,这些数据的复杂性也带来了前所未有的挑战。如何从这些海量数据中提取出有用的信息,如何比较不同来源、不同条件下的数据,以及如何整合多种类型的单细胞组学数据,成为当前研究的热点和难点。
二、LIGER算法的背景与意义
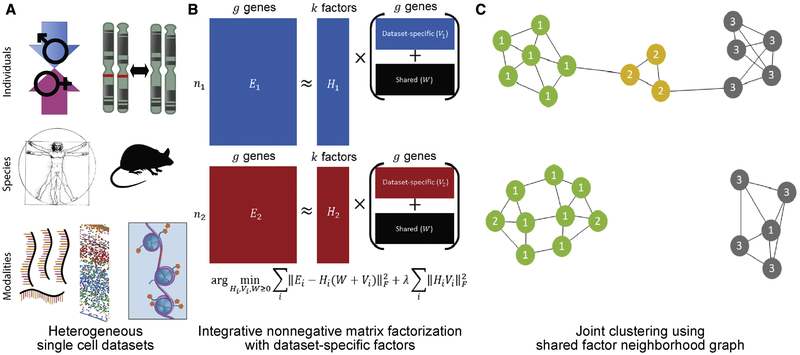
为了应对这些挑战,研究人员开发了一系列算法和工具来分析和整合单细胞组学数据。其中,LIGER算法以其强大的整合能力和灵活性脱颖而出。LIGER算法旨在整合比较不同性别、不同物种、不同实验条件下RNA转录组、原位转录组、表观修饰组的单细胞组学数据,从而揭示不同数据库之间的基因特征的共性和特性,以及标准化的表达谱。此外,LIGER还能将单细胞转录数据关联上空间信息,与表观修饰组的关联推测表观修饰对转录的调控关系及其多态性。
LIGER算法的出现,不仅为单细胞组学数据的整合提供了新的思路和方法,也为深入理解细胞异质性、揭示疾病发生发展的机制提供了有力的工具。通过整合多种类型的单细胞组学数据,我们可以更全面地了解细胞的特性和功能,从而更准确地预测疾病的进展和治疗效果。
三、LIGER算法的原理与方法
LIGER算法的核心是基于非负矩阵因子分解(NMF)的整合方法。NMF是一种常用的数据降维和特征提取技术,它能够将高维数据分解为低维的基矩阵和系数矩阵的乘积。在LIGER算法中,研究人员利用NMF将不同来源的单细胞组学数据分解为共享的生物学特征和特异性的技术或实验条件特征。
具体来说,LIGER算法首先对每个单细胞组学数据集进行预处理,包括数据清洗、质量控制和标准化等步骤。然后,利用NMF将每个数据集分解为共享的生物学特征矩阵和特异性的技术或实验条件特征矩阵。接下来,通过比较不同数据集之间的共享特征矩阵,可以揭示不同数据库之间的基因特征的共性和特性。同时,通过关联转录数据和表观修饰数据,可以推测表观修饰对转录的调控关系及其多态性。
此外,LIGER算法还结合了空间信息,将单细胞转录数据关联上空间位置,从而揭示了细胞在空间上的分布和相互作用。这一功能对于理解组织结构和功能具有重要意义。
四、LIGER算法的应用案例
为了验证LIGER算法的有效性和实用性,研究人员进行了多个应用案例的研究。以下是一些典型的应用案例:
- 大脑终纹床核(BNST)结构的细胞分类与性别二态性研究
研究人员利用LIGER算法对大脑终纹床核(BNST)结构的单细胞转录组数据进行了分析。通过对20万细胞进行聚类分析,共鉴定出41个神经元亚类。其中,70%的细胞位于终纹床核区域,且与前人报道一致,85.9%的神经元为抑制性神经元。此外,研究还发现该结构的神经元转录表达谱具有性别二态性,其中Xist、Tsix、Eif2s3y、Ddx3y和Uty是比较显著的两性差异表达基因。这一发现为理解性别差异对大脑功能的影响提供了新的线索。
- 人类大脑黑质结构的单细胞转录组研究
研究人员还利用LIGER算法对人类大脑黑质结构的单细胞转录组数据进行了分析。通过对7具人类遗体的大脑黑质结构进行测序和分析,共鉴定出24个已知细胞类群。在差异分析中,其中一个病人的样本特异factor 28显示在少突胶质细胞中高表达立早基因(IEGs),提示该病人可能存在急性损伤。此外,研究人员还将人的黑质数据与之前发表的小鼠黑质数据进行了比对分析。结果显示,人和小鼠之间细胞类群具有很强的对应关系。同源基因在人和小鼠黑质中的表达差异能够提示这些基因在该组织中的功能。这一发现为跨物种比较和疾病研究提供了有力的支持。
- 额叶皮层的单细胞转录组与原位单细胞转录组比对分析
研究人员还将课题组之前发表的额叶皮层的单细胞转录组数据与同一组织的原位单细胞转录组数据进行了比对分析。结果显示,LIGER算法能够很好地识别共有细胞类群,并利用原位单细胞数据为基于Drop-seq的单细胞转录组数据赋予空间信息。同时,整合的数据在细胞类群分析上具有更高分辨率。这一发现为理解组织结构和功能提供了新的视角和方法。
- 额叶皮层的单细胞转录组与DNA甲基化修饰组比对分析
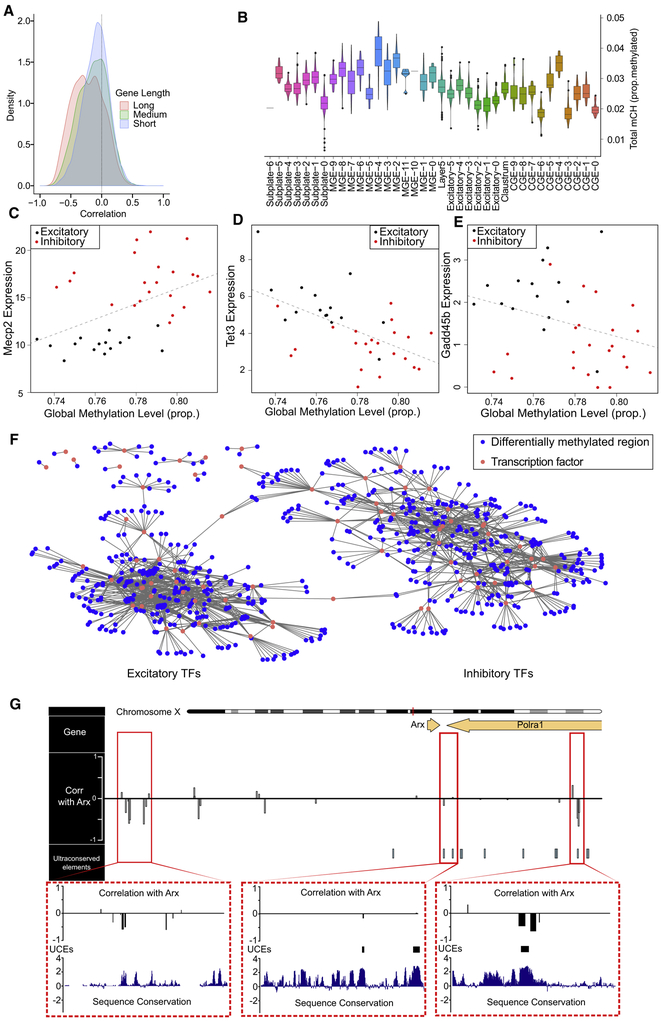
最后,研究人员还将额叶皮层的单细胞转录组数据与DNA甲基化修饰组数据进行了比对分析。结果显示,基因的表达谱与甲基化修饰成很好的负相关性,并且非CpG岛的甲基化比CpG岛的甲基化与基因表达的负相关性更强。此外,他们还发现Mecp2的表达与总体甲基化水平高度正相关,这一结果支持Mecp2通过结合甲基化碱基抑制基因表达的模型。这一发现为理解表观遗传调控机制提供了新的线索。
五、LIGER算法与其他算法的比较
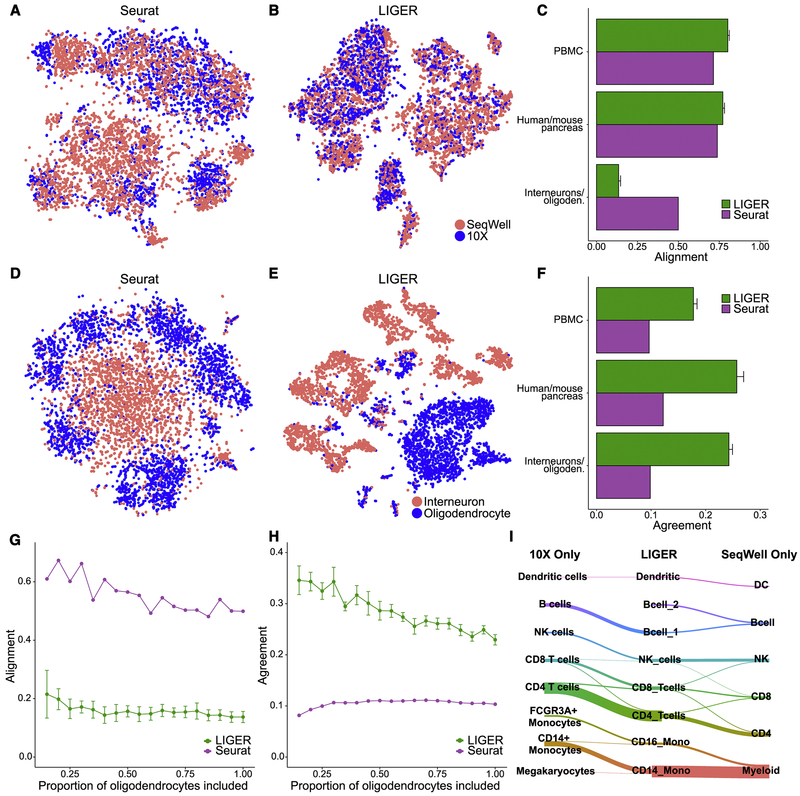
为了评估LIGER算法的性能和优势,研究人员还将其与其他常用的单细胞组学数据整合算法进行了比较。其中,Seurat是一种广泛使用的单细胞转录组数据分析工具,它提供了丰富的数据预处理、聚类分析和可视化等功能。通过比较LIGER和Seurat在比对小鼠和人的胰腺组织数据方面的表现,研究人员发现尽管两者在比对方面具有相似的表现,但LIGER在一致性和准确性方面表现得更好,产生的错误比对也更少。
此外,同期Cell杂志还发表了另一种集成算法,由Stuart等人研发。该算法使用典型相关分析(CCA)来识别最相关的共有子空间,并使用这些共有组件在不同数据中识别锚点。与LIGER相比,该算法解决了凸优化问题,从而保证确定性、全局最优解。然而,LIGER使用整合的非负矩阵因子分解法,解决了非凸优化问题,并产生了一个取决于初始化的不同分解。这使得LIGER能够推断可解释的数据间共有和特异因子,通常对应重要的生物学信号或技术信号,并将它们从下游分析中移除。这一特点使得LIGER在处理复杂数据集时具有更高的灵活性和准确性。
六、LIGER算法的未来展望与挑战
尽管LIGER算法在单细胞组学数据整合方面取得了显著的成果和进展,但仍面临着一些挑战和限制。首先,LIGER算法的计算复杂度和内存需求较高,对于大规模数据集的处理可能需要更多的计算资源和时间。其次,LIGER算法的结果受到初始化参数和数据质量的影响,因此需要谨慎选择参数并进行数据质量控制。此外,LIGER算法还需要与其他算法和工具进行集成和互补,以提供更全面的单细胞组学数据分析解决方案。
展望未来,随着单细胞测序技术的不断发展和完善,以及计算生物学和机器学习方法的不断进步,LIGER算法有望在单细胞组学数据整合方面发挥更大的作用。通过不断优化算法和提高计算效率,LIGER算法将能够处理更大规模、更复杂的数据集,并揭示更多关于细胞异质性、疾病发生发展和治疗反应的机制。同时,LIGER算法还可以与其他单细胞组学技术(如单细胞蛋白质组学、单细胞代谢组学等)进行集成和互补,以提供更全面的细胞异质性分析。这将为深入理解生命体系的复杂性和推动医学研究的进步提供有力的支持。
七、结论
LIGER算法作为一种新的单细胞组学数据整合方法,为揭示细胞异质性、理解疾病发生发展的机制提供了有力的工具。通过整合多种类型的单细胞组学数据,LIGER算法能够揭示不同数据库之间的基因特征的共性和特性,以及标准化的表达谱。同时,LIGER算法还能将单细胞转录数据关联上空间信息,与表观修饰组的关联推测表观修饰对转录的调控关系及其多态性。多个应用案例的研究结果验证了LIGER算法的有效性和实用性。尽管仍面临一些挑战和限制,但随着技术的不断进步和算法的不断优化,LIGER算法有望在单细胞组学数据整合方面发挥更大的作用,为生命科学和医学研究的发展做出更大的贡献。
| 名称 | 货号 | 规格 |
| 单细胞测序(Sc-seq)实验服务 | LX-sequencing | EA |
| 单细胞测序(Sc-seq)检测试剂盒 | LXR-sequencing | 1kit |
| 人单细胞BCR FL扩增试剂盒(BD平台) | abs60593-4T | 4T |
| 单细胞测序 | JL230619927 | EA |







