谷氨酰胺代谢(glutaminolysis)
01 研究背景
本篇文献聚焦于谷氨酰胺代谢(glutaminolysis)在肺纤维化病理过程中的作用,特别是其在肌成纤维细胞(myofibroblasts)这一纤维化进程中的核心效应细胞内的角色。研究背景揭示,谷氨酰胺代谢的异常已被证实与多种病理状态紧密相关。尽管当前研究已揭示器官纤维化中存在多种代谢途径的紊乱,但关于谷氨酰胺代谢是否直接调控肌成纤维细胞的促纤维化活性,仍是一个悬而未决的问题。因此,本研究的核心目的在于深入探究谷氨酰胺代谢是否对肌成纤维细胞中胶原蛋白的翻译过程及其稳定性产生调节作用,并进一步考察这一代谢途径是否通过影响哺乳动物雷帕霉素靶蛋白(mTOR)的激活以及脯氨酸羟化酶的功能,从而在纤维化进程中发挥关键作用。

02 设计思路概述
本研究旨在深入探究谷氨酰胺代谢在肺肌成纤维细胞中,特别是通过谷氨酰胺酶1(Gls1)介导的代谢过程,对胶原蛋白表达的影响及其潜在机制。首先,作者观察到在肺肌成纤维细胞中,谷氨酰胺代谢呈现出增强的趋势,这提示我们谷氨酰胺代谢可能与肺纤维化过程中的胶原蛋白产生存在某种关联。为了验证这一假设,作者采取了多种策略来抑制谷氨酰胺代谢,包括使用特定的Gls1抑制剂CB-839和BPTES,以及通过Gls1 siRNA进行基因沉默。
接着,作者观察了这些抑制剂对胶原蛋白表达的影响。实验结果显示,抑制谷氨酰胺代谢后,胶原蛋白的翻译和稳定性均受到显著影响,这表明谷氨酰胺代谢确实参与了胶原蛋白的调控过程。进一步的研究发现,谷氨酰胺代谢对胶原蛋白的调控作用是通过两个主要途径实现的:一是谷氨酰胺代谢依赖的mTOR复合体1激活,二是胶原蛋白脯氨酸羟化。这两个途径共同作用于胶原蛋白的生成和稳定,从而影响了肺纤维化的进程。
此外,作者还注意到谷氨酰胺代谢的最终产物α-酮戊二酸(α-KG)在肌成纤维细胞中的水平有所增加。进一步的研究表明,α-KG能够激活mTOR复合体1,进而促进胶原蛋白的表达。这一发现不仅揭示了α-KG在谷氨酰胺代谢调控胶原蛋白产生中的重要作用,也为治疗器官纤维化提供了新的思路。综上所述,本研究通过一系列精心设计的实验,揭示了谷氨酰胺代谢在肺肌成纤维细胞中调节胶原蛋白产生的新机制。这些发现不仅加深了我们对肺纤维化过程中代谢调控的理解,也为开发针对器官纤维化的新治疗策略提供了理论依据和潜在靶点。
03 结果分析
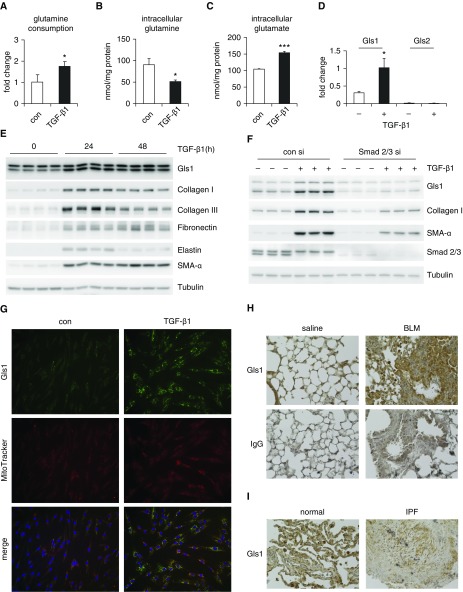
实验步骤
- 细胞饥饿与处理(A-C):
- 将人正常肺成纤维细胞置于含有0.1%胎牛血清(FBS)的Eagle最低必需培养基(EMEM)中饥饿24小时,以同步化细胞状态。
- 随后,用或不用2 ng/ml的TGF-β1处理细胞48小时。
- 测定上清液(A)和细胞内(B)的谷氨酰胺量,以及细胞内(C)的谷氨酸量。谷氨酰胺消耗量通过计算条件培养基与原始培养基中谷氨酰胺量的差值得出。
- mRNA水平检测(D):
- 采用与步骤1相同的细胞处理方式。
- 通过RT-PCR技术测定Gls1、Gls2和微管蛋白-α的mRNA量,以微管蛋白-α作为内参。
- 蛋白质水平检测(E):
- 同样采用与步骤1相同的细胞处理方式。
- 通过Western blotting技术测定指定蛋白质的量。
- Smad2/3敲低实验(F):
- 用对照siRNA或Smad2/3 siRNA转染人正常肺成纤维细胞。
- 转染后,用或不用TGF-β1处理细胞。
- 通过Western blotting技术测定指定蛋白质的量。
- 免疫荧光显微镜检测(G):
- 采用与步骤1相同的细胞处理方式。
- 使用免疫荧光显微镜技术测定Gls1的表达,同时用MitoTracker Deep Red标记线粒体,DAPI标记细胞核。
- 小鼠肺组织免疫组化检测(H):
- 通过免疫组化技术测定Gls1在正常小鼠肺和博来霉素诱导的肺纤维化小鼠肺中的表达和定位。
- 使用兔IgG作为阴性对照。
- 人肺组织免疫组织化学检测(I):
- 通过免疫组织化学技术测定Gls1在正常人肺和特发性肺纤维化(IPF)肺中的表达和定位。
结果分析
- 在A-C步骤中,结果显示TGF-β1处理组与未处理组相比,上清液和细胞内谷氨酰胺量以及细胞内谷氨酸量均有显著差异,提示TGF-β1可能影响肺成纤维细胞的谷氨酰胺代谢。
- D步骤中,RT-PCR结果显示TGF-β1处理组Gls1的mRNA量显著增加,而Gls2无显著变化,表明TGF-β1可能特异性地调控Gls1的表达。
- E步骤中,Western blotting结果显示指定蛋白质的量在TGF-β1处理组与未处理组之间存在显著差异,进一步验证了TGF-β1对蛋白质表达的影响。
- F步骤中,Smad2/3敲低实验结果显示Smad2/3的敲低能够影响TGF-β1诱导的蛋白质表达变化,提示Smad2/3可能参与TGF-β1对谷氨酰胺代谢的调控。
- G步骤中,免疫荧光显微镜结果显示Gls1在细胞内的表达与定位,同时显示了线粒体和细胞核的形态,为理解Gls1的功能提供了空间定位信息。
- H和I步骤中,免疫组化和免疫组织化学结果显示Gls1在正常肺组织和纤维化肺组织中的表达和定位存在差异,提示Gls1可能与肺纤维化的发生和发展有关。
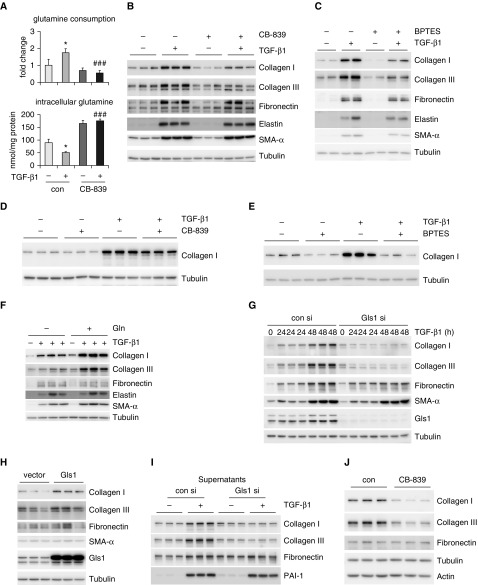
实验步骤
- 细胞饥饿与处理(A):
- 将人正常肺成纤维细胞在含有0.1%胎牛血清(FBS)的Eagle最低必需培养基(EMEM)中饥饿24小时。
- 随后,用或不用1 μM的CB-839(谷氨酰胺酶1抑制剂)预处理细胞1小时,再用或不用2 ng/ml的TGF-β1处理48小时。
- 测定上清液和细胞内谷氨酰胺(Gln)的量,并计算Gln消耗量。
- 蛋白质表达检测(B-C):
- 采用与步骤1相同的处理方式,但分别使用CB-839和另一种谷氨酰胺酶1抑制剂BPTES(2.5 μM)。
- 通过Western blotting技术测定指定蛋白质的量。
- 抑制剂后处理(D-E):
- 将细胞饥饿并处理后,再用含有载体、CB-839或BPTES的新鲜培养基再培养48小时。
- 通过Western blotting技术测定指定蛋白质的量。
- 谷氨酰胺添加实验(F):
- 将细胞饥饿后,用含有不同浓度谷氨酰胺和/或TGF-β1的新鲜培养基再培养48小时。
- 通过Western blotting技术测定指定蛋白质的量。
- Gls1敲低实验(G):
- 用对照siRNA或Gls1 siRNA转染人正常肺成纤维细胞。
- 将细胞饥饿并处理后,测定指定蛋白质的量。
- Gls1过表达实验(H):
- 用对照慢病毒或表达Gls1的慢病毒感染人正常肺成纤维细胞。
- 通过Western blotting技术测定指定蛋白质的量。
- 上清液蛋白质检测(I):
- 按照G步骤进行实验,但沉淀细胞上清液中的可溶性蛋白质,并通过Western blotting测定上清液中指示蛋白的量。
- 特发性肺纤维化肺成纤维细胞处理(J):
- 用或不用CB-839处理特发性肺纤维化肺成纤维细胞48小时。
- 通过Western blotting技术测定指示蛋白质的量。
预期结果与分析
- 在步骤A中,预期TGF-β1处理组细胞内的谷氨酰胺消耗量会增加,而CB-839预处理会抑制这种增加。
- 在步骤B和C中,预期CB-839和BPTES处理会改变指定蛋白质的表达量,特别是与谷氨酰胺代谢和TGF-β1信号通路相关的蛋白质。
- 在步骤D和E中,预期抑制剂后处理会进一步影响指定蛋白质的表达量,可能逆转或部分逆转先前由TGF-β1引起的变化。
- 在步骤F中,预期谷氨酰胺的添加会影响指定蛋白质的表达量,特别是当与TGF-β1共同作用时。
- 在步骤G中,预期Gls1敲低会改变指定蛋白质的表达量,特别是那些依赖于Gls1活性的蛋白质。
- 在步骤H中,预期Gls1过表达会增加指定蛋白质的表达量,特别是那些受Gls1调控的蛋白质。
- 在步骤I中,预期上清液中的指示蛋白量会受到Gls1敲低和TGF-β1处理的影响。
- 在步骤J中,预期CB-839处理会改变特发性肺纤维化肺成纤维细胞中指定蛋白质的表达量,这可能为肺纤维化的治疗提供新的线索。
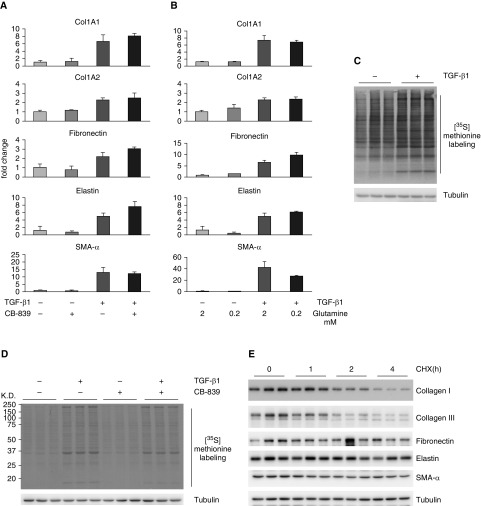
实验步骤与预期结果
-
基因表达分析(A)
- 步骤:将细胞饥饿后,用或不用CB-839预处理,再用或不用TGF-β1处理。通过RT-PCR测定指定基因的mRNA水平。
- 预期结果:CB-839预处理可能改变TGF-β1诱导的基因表达变化,表明谷氨酰胺代谢在调控这些基因表达中起作用。
-
谷氨酰胺浓度与基因表达的关系(B)
- 步骤:将饥饿后的细胞在不同浓度的谷氨酰胺和/或TGF-β1存在下再培养。通过RT-PCR测定指定基因的mRNA水平。
- 预期结果:谷氨酰胺浓度的变化可能影响指定基因的表达,且这种影响可能受到TGF-β1的调控。
-
蛋白质合成分析(C)
- 步骤:将饥饿后的细胞用或不用TGF-β1处理,然后补充[35S]蛋氨酸。通过放射自显影测定[35S]蛋氨酸掺入量。
- 预期结果:TGF-β1处理可能增加蛋白质合成,表现为[35S]蛋氨酸掺入量的增加。
-
CB-839对蛋白质合成的影响(D)
- 步骤:将饥饿后的细胞用或不用CB-839预处理,再用或不用TGF-β1处理。然后补充[35S]蛋氨酸,通过放射自显影测定[35S]蛋氨酸掺入量。
- 预期结果:CB-839预处理可能抑制TGF-β1诱导的蛋白质合成增加,表明谷氨酰胺代谢在调控蛋白质合成中起作用。
-
蛋白质翻译抑制剂的作用(E)
- 步骤:用不同时间的放线菌酮(CHX)处理细胞,通过Western blotting测定指定蛋白质的量。
- 预期结果:随着放线菌酮处理时间的延长,指定蛋白质的量逐渐减少,表明放线菌酮有效抑制了蛋白质翻译。这一实验为理解蛋白质合成调控提供了基础。
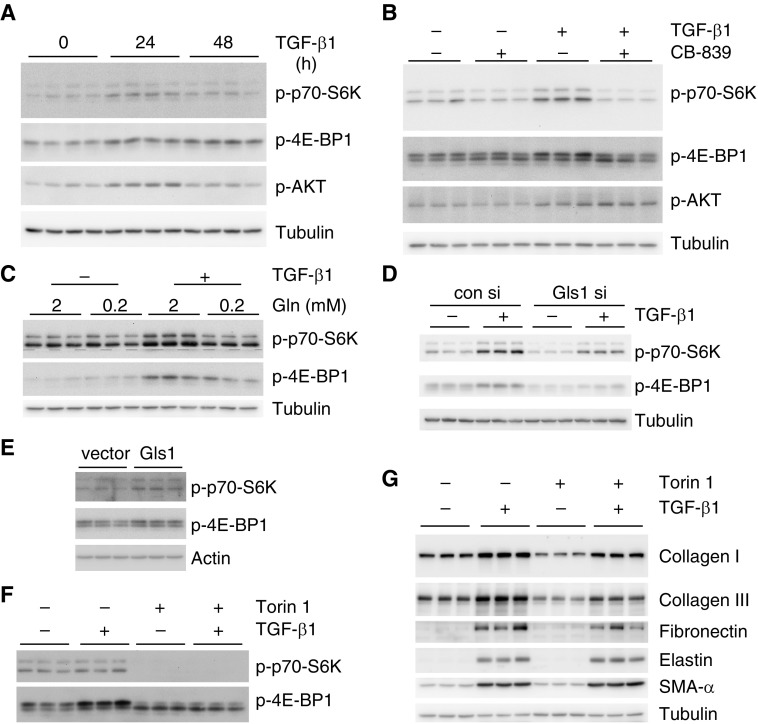
实验步骤与预期结果
-
TGF-β1时间梯度处理(A)
- 步骤:细胞饥饿后,用2 ng/ml TGF-β1处理0、24或48小时。
- 预期结果:随着TGF-β1处理时间的延长,指定蛋白质的表达水平可能发生变化,表现出时间依赖性。
-
CB-839与TGF-β1联合处理(B)
- 步骤:细胞饥饿后,用或不用1 μM CB-839预处理1小时,再用或不用2 ng/ml TGF-β1处理48小时。
- 预期结果:CB-839预处理可能抑制或改变TGF-β1诱导的蛋白质表达变化,表明谷氨酰胺代谢在调控这些蛋白质表达中起作用。
-
谷氨酰胺浓度与TGF-β1联合处理(C)
- 步骤:细胞饥饿后,用含有不同浓度谷氨酰胺和/或TGF-β1的新鲜培养基再培养48小时。
- 预期结果:谷氨酰胺浓度的变化可能影响指定蛋白质的表达,且这种影响可能受到TGF-β1的调控。同时,通过在同一张膜上切割并重新印迹p-p70-S6K,确保了实验的一致性和准确性。
-
Gls1敲低与TGF-β1处理(D)
- 步骤:用对照siRNA或Gls1 siRNA转染细胞,然后用或不用TGF-β1处理6小时。
- 预期结果:Gls1敲低可能改变TGF-β1诱导的蛋白质表达变化,进一步证实谷氨酰胺代谢在调控这些蛋白质表达中的重要性。
-
Gls1过表达(E)
- 步骤:用对照慢病毒或表达Gls1的慢病毒感染细胞。
- 预期结果:Gls1过表达可能导致指定蛋白质表达水平的变化,为理解Gls1在细胞功能中的作用提供线索。
-
Torin 1与TGF-β1联合处理(F & G)
- 步骤:细胞饥饿后,用或不用20 nM Torin 1预处理1小时,再用或不用2 ng/ml TGF-β1处理48小时。
- 预期结果:Torin 1作为mTOR信号通路的抑制剂,可能抑制或改变TGF-β1诱导的蛋白质表达变化,表明mTOR信号通路在调控这些蛋白质表达中起关键作用。实验G可能进一步验证了F中的发现或探索了其他相关蛋白质的表达变化。
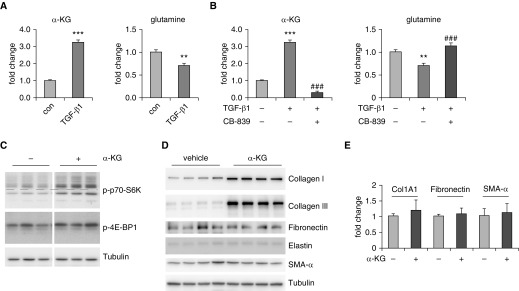
实验步骤与预期结果
-
TGF-β1处理对代谢物水平的影响(A)
- 步骤:细胞饥饿后,用或不用2 ng/ml TGF-β1处理48小时。通过质谱分析测定细胞内α-KG和谷氨酰胺的量。
- 预期结果:TGF-β1处理可能改变细胞内α-KG和谷氨酰胺的水平,表明TGF-β1信号通路可能调控谷氨酰胺代谢。
-
CB-839与TGF-β1联合处理对代谢物水平的影响(B)
- 步骤:细胞饥饿后,用或不用1 μM CB-839预处理1小时,再用或不用2 ng/ml TGF-β1处理48小时。通过质谱分析测定细胞内α-KG和谷氨酰胺的量。
- 预期结果:CB-839预处理可能进一步影响TGF-β1处理后的α-KG和谷氨酰胺水平,表明谷氨酰胺酶在调控这些代谢物水平中起关键作用。同时,与仅TGF-β1处理的对照组相比,联合处理可能产生显著不同的效果。
-
二甲基-α-KG处理对蛋白质表达的影响(C)
- 步骤:细胞饥饿后,用或不用2 mM 细胞渗透性二甲基-α-KG处理48小时。通过Western blotting测定指定蛋白质的量。
- 预期结果:二甲基-α-KG处理可能改变指定蛋白质的表达水平,特别是那些与谷氨酰胺代谢和mTOR信号通路相关的蛋白质,如p-p70-S6K。
-
二甲基-α-KG处理对蛋白质表达的进一步验证(D)
- 步骤:与C中处理相同,通过Western blotting测定指定蛋白质的量。
- 预期结果:进一步验证C中的发现,确保结果的可靠性和一致性。
-
二甲基-α-KG处理对基因表达的影响(E)
- 步骤:细胞处理与C中相同,通过RT-PCR确定指定基因的量。
- 预期结果:二甲基-α-KG处理可能改变指定基因的表达水平,这些基因可能参与谷氨酰胺代谢、mTOR信号通路或其他相关途径。
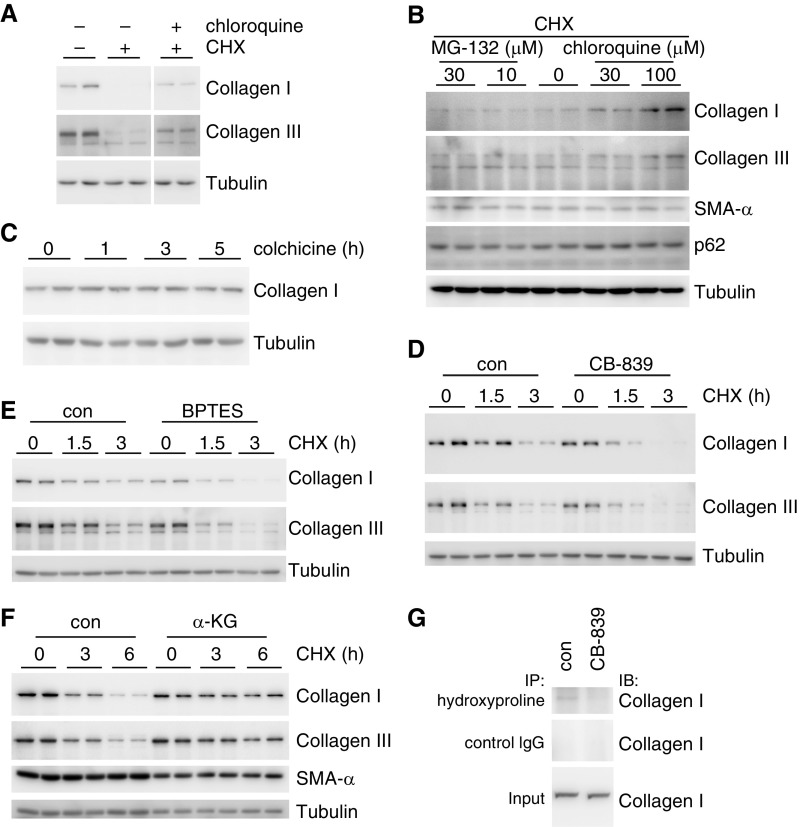
实验步骤与预期结果
-
溶酶体抑制剂氯喹与蛋白合成抑制剂CHX的联合处理(A)
- 步骤:细胞培养后,用或不用氯喹预处理,再在有或没有CHX的情况下处理。
- 预期结果:氯喹预处理可能抑制溶酶体介导的蛋白质降解,而CHX则抑制蛋白质合成。通过比较不同处理组的蛋白质水平,可以评估溶酶体在蛋白质降解中的作用。
-
氯喹与蛋白酶体抑制剂MG-132的联合处理(B)
- 步骤:细胞培养后,用或不用氯喹或MG-132预处理,再用CHX处理。
- 预期结果:比较氯喹和MG-132对蛋白质降解的影响,可以区分溶酶体和蛋白酶体在蛋白质降解途径中的不同作用。
-
蛋白分泌抑制剂秋水仙碱的处理(C)
- 步骤:细胞培养后,用秋水仙碱处理指定时间。
- 预期结果:秋水仙碱抑制蛋白质分泌,通过观察细胞内蛋白质水平的变化,可以评估蛋白质分泌对细胞内蛋白质稳态的影响。
-
谷氨酰胺酶抑制剂CB-839与CHX的联合处理(D)
- 步骤:细胞培养后,用或不用CB-839预处理,再用CHX处理不同时间。
- 预期结果:CB-839抑制谷氨酰胺酶,可能影响谷氨酰胺代谢和随后的蛋白质合成或降解。通过比较不同时间点的蛋白质水平,可以评估谷氨酰胺代谢在蛋白质稳态中的作用。
-
BPTES(另一种谷氨酰胺酶抑制剂)与CHX的联合处理(E)
- 步骤:与D相似,但使用BPTES代替CB-839。
- 预期结果:进一步验证谷氨酰胺酶抑制剂对蛋白质稳态的影响,并比较CB-839和BPTES的效果。
-
二甲基-α-KG处理与CHX的联合处理(F)
- 步骤:细胞培养后,用二甲基-α-KG处理,再用CHX处理不同时间。
- 预期结果:二甲基-α-KG是α-KG的细胞渗透性形式,可能影响谷氨酰胺代谢和蛋白质合成。通过比较不同时间点的蛋白质水平,可以评估α-KG对蛋白质稳态的直接影响。
-
CB-839预处理后的免疫沉淀测定(G)
- 步骤:细胞培养后,用或不用CB-839预处理,然后进行免疫沉淀(IP)测定。
- 预期结果:使用抗羟脯氨酸抗体进行IP测定,可以特异性地检测胶原蛋白。通过比较不同处理组的IP结果,可以评估CB-839对胶原蛋白稳定性和/或合成的影响。
04 总结
本文的实验研究揭示了谷氨酰胺代谢在肺肌成纤维细胞中对胶原蛋白产生的重要促进作用。具体而言,谷氨酰胺代谢通过增强胶原蛋白的翻译和稳定性来实现这一效果,而这一过程又依赖于其代谢产物α-酮戊二酸(α-KG)所介导的mTOR复合体1的激活以及胶原蛋白脯氨酸的羟化作用。这些发现不仅阐明了谷氨酰胺代谢在器官纤维化,特别是肺纤维化中的核心作用,还为开发针对谷氨酰胺代谢途径的新型治疗策略奠定了坚实的理论基础。
| 名称 | 货号 | 规格 |
| L-谷氨酰-1-萘胺一水 | abs42020582-1g | 1g |
| L-alpha-谷氨酰-L-半胱氨酰甘氨酸谷胱甘肽 | abs42020946-2.5mg | 2.5mg |
| Α-L-谷氨酰-L-谷氨酸 | abs45126995-1g | 1g |
| Z-异亮氨酰-谷氨酰-苏氨酰-天冬氨酸-AFC | abs45133088-5mg | 5mg |







