Inhibiting PLA2G7 reverses the immunosuppressive function of intratumoral macrophages and augments immunotherapy response in hepatocellular carcinoma
在抗击癌症的战场上,科研人员始终致力于寻找能够精准打击肿瘤的关键点,以期为患者带来更好的预后。近日,复旦大学附属中山医院董玲团队与复旦大学基础医学院张思团队在Journal for ImmunoTherapy of Cancer期刊上发表了一项重要研究,揭示了肝细胞癌(HCC)微环境中一类具有极高免疫抑制性的肿瘤相关巨噬细胞(TAMs)的新特征,并发现了通过抑制血小板活化因子乙酰水解酶(PLA2G7)来改善免疫微环境,从而增援HCC免疫治疗的新策略。

研究的背景与意义
在肿瘤微环境中,免疫抑制性细胞如TAMs等扮演着重要角色,它们通过抑制抗肿瘤免疫应答,为肿瘤的生长和扩散提供有利条件。针对TAMs进行干预,以增效免疫治疗,已成为近年来肝癌研究领域的热点方向。然而,尽管TAMs在HCC微环境中的免疫抑制性“统治力”已广受关注,但其具体的作用机制及调控靶点仍有待深入探究。
在此背景下,复旦团队的研究显得尤为重要。他们不仅深入剖析了HCC微环境中TAMs的特征,还发现了PLA2G7这一全新靶点,为逆转肝癌免疫抑制性微环境提供了新的突破口。这一发现不仅有助于深入理解肝癌免疫逃逸的机制,更为开发更有效的免疫治疗策略提供了理论依据和实验依据。
研究方法与过程
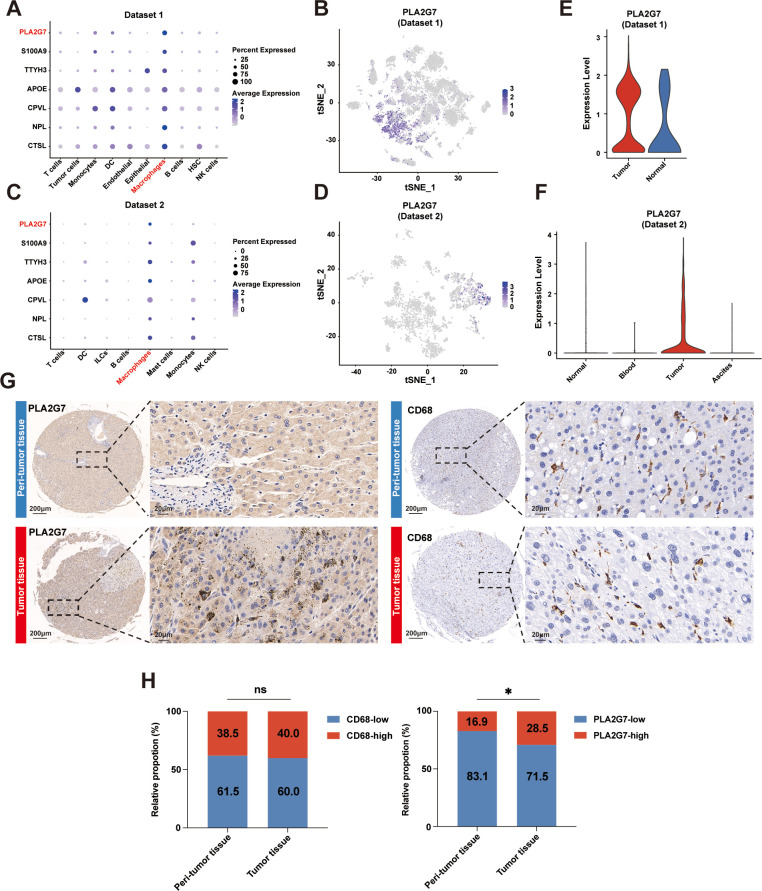
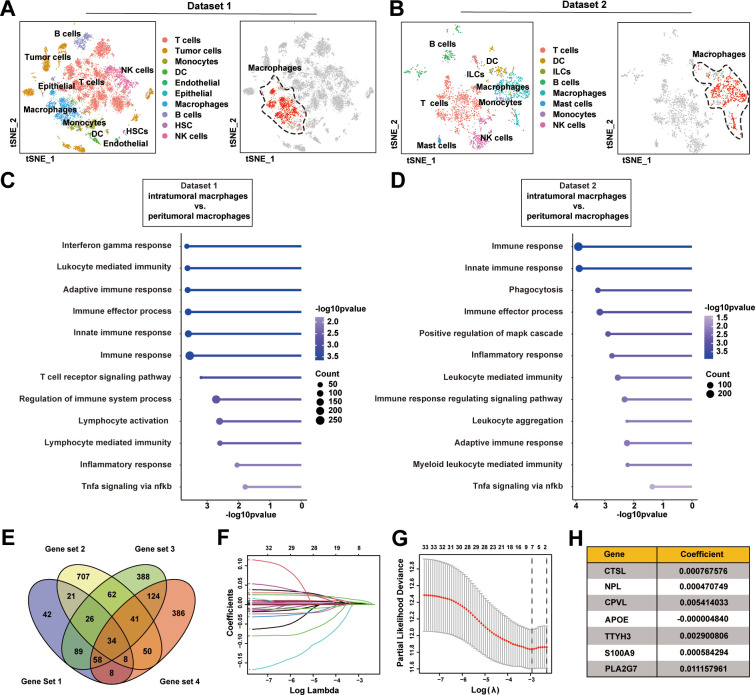
复旦团队的研究基于既往的HCC单细胞测序数据,专门针对TAMs展开了深入的生物信息学分析。他们首先比较了HCC微环境中TAMs与正常巨噬细胞之间基因表达的差异,找出了34个可能参与TAMs介导HCC免疫抑制性微环境的差异表达基因。随后,结合患者预后数据,他们进一步筛选和验证了这些基因,最终将目标缩小到了7个,其中就包括PLA2G7。
为了验证PLA2G7在HCC微环境中的关键作用,研究者们进行了多项实验。他们发现,PLA2G7仅在HCC微环境内的巨噬细胞(特征为CD68+)中高表达,而在单核细胞和树突状细胞等其它髓系细胞中表达中等,在其它免疫细胞内则很少见。这提示PLA2G7可能是调控TAMs功能的关键点。
进一步的研究显示,高表达PLA2G7与HCC患者总生存期(OS)较短显著相关,同时高表达PLA2G7和CD68更是预后不良的标志。在接受PD-1抑制剂治疗的另一个HCC患者队列中,研究者们发现实现部分缓解(PR)患者的肿瘤中PLA2G7和CD68的表达水平均显著低于疾病进展(PD)患者。此外,PLA2G7和CD68的表达水平还与CD8+T细胞浸润程度密切相关,这进一步证实了TAMs中的PLA2G7对抗肿瘤免疫的影响。
PLA2G7的功能与机制
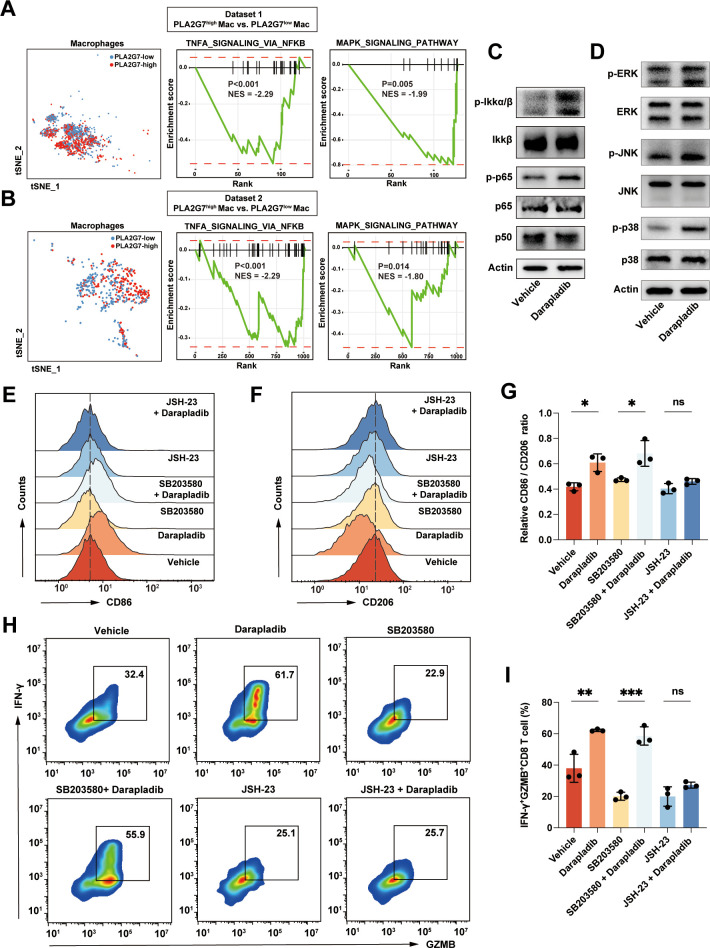
为了深入了解PLA2G7在TAMs中的功能及其影响免疫治疗的机制,研究者们进行了更为深入的实验。他们发现,沉默PLA2G7表达或使用小分子抑制剂darapladib可以在一定程度上使TAMs整体向有利免疫治疗的M1型极化。这提示PLA2G7可能是调控TAMs极化状态的关键分子。
进一步的研究显示,PLA2G7高表达会使TAMs内的NF-κB信号通路活性显著下降。NF-κB信号通路在调控免疫反应和炎症过程中起着重要作用,其活性下降可能导致TAMs呈高度免疫抑制性。这可能是PLA2G7导致TAMs免疫抑制性的关键机制之一。然而,更详细的分子机制仍有待后续研究进一步探索。
PLA2G7与免疫治疗协同增效
基于上述发现,研究者们进一步探索了抑制PLA2G7与免疫治疗协同增效的可能性。他们发现,在使用PD-1抑制剂治疗的同时,沉默PLA2G7表达或使用darapladib可以显著增强免疫治疗的疗效。这一发现为开发更有效的免疫治疗策略提供了新的思路。
值得注意的是,darapladib作为一种小分子抑制剂,曾在心血管疾病领域被寄予厚望,但两次折戟关键临床III期研究。此次复旦团队的研究或许能为darapladib找回新的应用前景。当然,即使darapladib在HCC免疫治疗中的应用前景有限,针对PLA2G7进行突破仍然是冲开HCC免疫抑制性微环境枷锁的重要方向。
研究的意义与展望
复旦团队的研究不仅揭示了PLA2G7在HCC微环境中TAMs免疫抑制性中的关键作用,还为开发更有效的免疫治疗策略提供了新的理论依据和实验依据。这一发现不仅有助于深入理解肝癌免疫逃逸的机制,更为临床治疗提供了新的思路和可能。
然而,研究也指出了一些需要进一步探索的问题。例如,PLA2G7导致TAMs免疫抑制性的详细分子机制仍有待深入探究;darapladib在HCC免疫治疗中的具体应用前景也需要更多的临床试验来验证。此外,是否还有其他分子或信号通路与PLA2G7共同调控TAMs的功能也是未来研究的重要方向。
尽管如此,复旦团队的研究仍然为肝癌免疫治疗领域带来了新的曙光。他们不仅为逆转肝癌免疫抑制性微环境提供了新的策略,还为开发更有效的免疫治疗药物提供了新的靶点。随着研究的深入和临床试验的推进,相信这一发现将为更多的肝癌患者带来福音。
结语
在抗击癌症的道路上,科研人员始终在不懈探索。复旦团队的研究揭示了PLA2G7在肝癌免疫抑制性微环境中的关键作用,为开发更有效的免疫治疗策略提供了新的突破口。这一发现不仅有助于深入理解肝癌的发病机制和免疫逃逸过程,更为临床治疗提供了新的思路和可能。我们期待在不久的将来,这一研究成果能够转化为实际的临床应用,为更多的肝癌患者带来希望和康复的可能。同时,我们也期待更多的科研人员能够加入到这一领域的研究中来,共同推动肝癌免疫治疗的发展和进步。
| 名称 | 货号 | 规格 |
| Recombinant Mouse CSF1 Protein | abs04383-50ug | 50ug |
| Recombinant Mouse CSF1 Protein | abs04383-10ug | 10ug |
| Recombinant Mouse CSF1 Protein | abs04383-1mg | 1mg |
| Recombinant Mouse CSF1 Protein | abs04383-500ug | 500ug |