Autophagy
自噬是一种高度保守的细胞过程,通过溶酶体降解细胞质成分和细胞器,清除功能失调的细胞结构及病原体,并回收代谢物质以维持细胞稳态 。最初被视为饥饿应答机制,现已发现多种应激源(如能量耗尽、高温、激素及免疫信号)可诱导自噬,而自噬失衡与癌症、神经退行性疾病、感染及衰老密切相关 。
自噬的三种主要类型
1. 巨自噬(Macroautophagy)
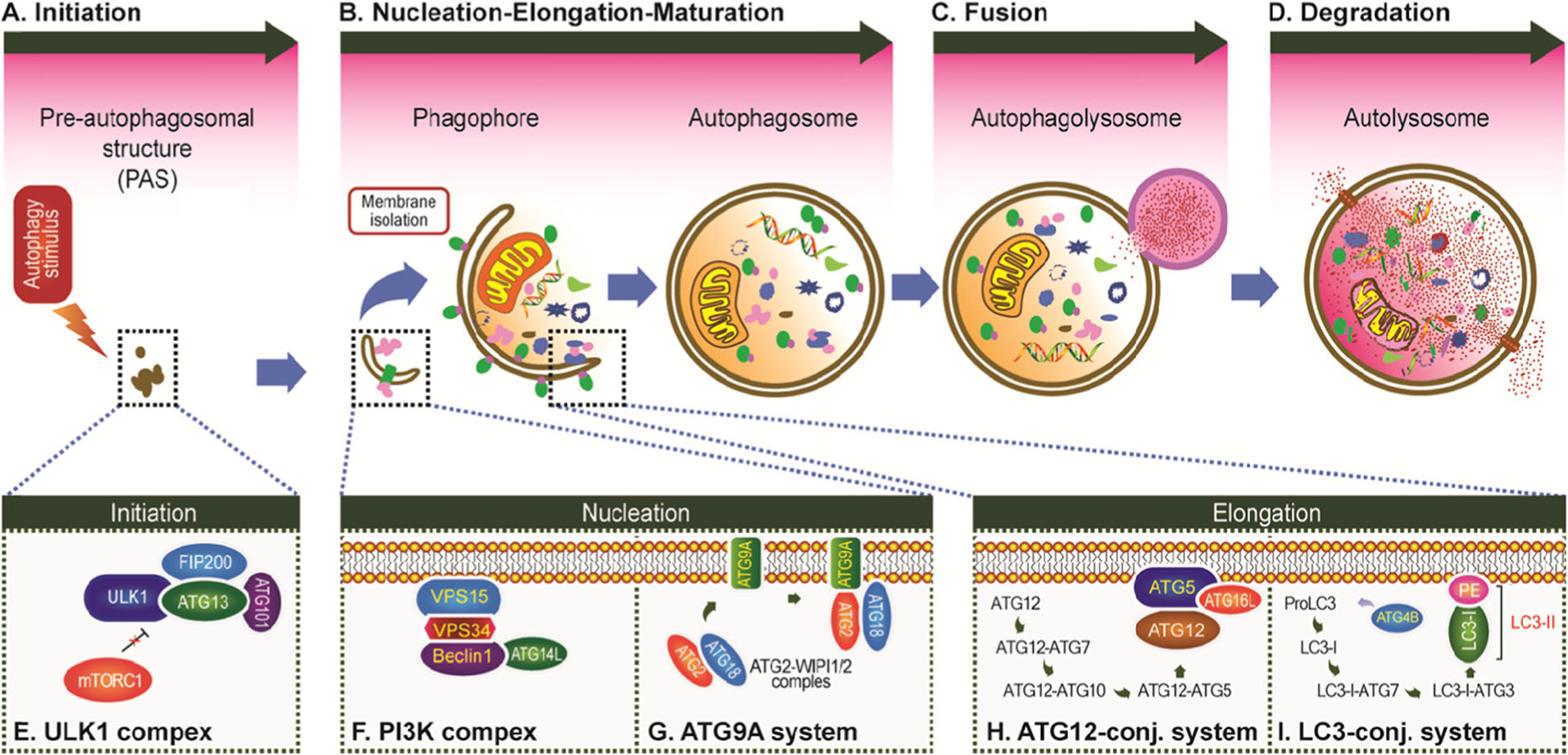
巨自噬是最经典的自噬形式,通过形成自噬体包裹大量细胞质内容物,最终与溶酶体融合降解。其过程分为四个阶段:
-
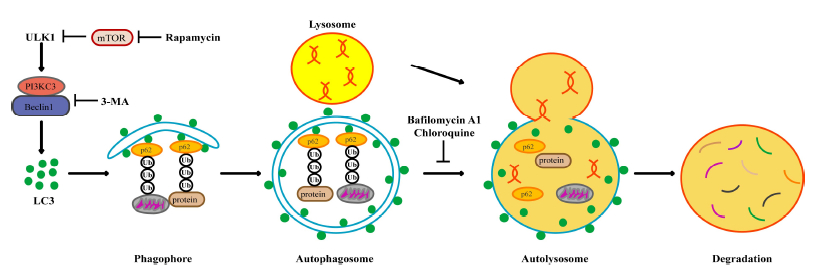
起始:由Ulk激酶复合物触发,启动自噬体形成的吞噬泡组装位点(PAS)。
-
成核:Beclin-1与III类PI3K复合物结合,促进吞噬泡膜延伸。
-
膜扩张:Atg12/5/16复合物介导LC3脂化(LC3-II),标记自噬体膜并协助货物识别 。
-
融合与降解:自噬体与溶酶体结合形成自噬溶酶体,内容物被水解酶分解 。
2. 微自噬(Microautophagy)
微自噬通过溶酶体膜直接内陷包裹底物,降解少量细胞质组分。其机制涉及GTP酶Vps1p和部分Atg蛋白,但研究工具有限,主要依赖电子显微镜观察溶酶体内陷囊泡 。

3. 伴侣介导自噬(CMA)
CMA特异性转运含KFERQ基序的胞质蛋白至溶酶体,依赖Hsc70伴侣与溶酶体膜受体Lamp-2A的相互作用。底物蛋白经多聚化Lamp-2A通道易位,并由溶酶体Hsc70协助降解 。CMA活性可通过Lamp-2A表达水平及与Hsc70共定位评估。
巨自噬的评估方法
1. 电子显微镜(TEM)
透射电镜可直观识别自噬体(含完整细胞器)和自噬溶酶体(部分降解内容物),但依赖经验判断且难以定量 。
2. LC3与p62/SQSTM1检测
-
LC3-II脂化:通过Western blot检测LC3-I向LC3-II的转化,或免疫荧光观察LC3斑点数。需注意LC3-II在自噬溶酶体形成后会降解 。
-
p62降解:p62蛋白通过自噬清除多泛素化底物,其水平与自噬活性负相关。需结合其他指标排除转录调控干扰 。
3. 溶酶体标记物与自噬相关蛋白
- Lamp-1/2:溶酶体膜标志物,与LC3共定位可确认自噬体-溶酶体融合。
- Beclin-1与Atg蛋白:Beclin-1斑点提示自噬诱导,而Atg5/14需与其他标记联用以避免非特异性信号 。
4. 组织蛋白酶(Cathepsin)活性
荧光标记的Cathepsin底物(如Magic Red)可动态监测溶酶体酶活性,配合吖啶橙染色区分自噬阶段 。
5. 自噬流(Autophagic Flux)分析
动态评估自噬通量比静态检测更可靠。常用方法包括:
-
溶酶体抑制剂(如氯喹):阻断自噬体降解,观察LC3-II和p62累积量。
-
双荧光报告系统(如mRFP-GFP-LC3):GFP在溶酶体酸性环境中淬灭,红色荧光保留可区分自噬体与自噬溶酶体 。
研究自噬的意义与挑战
自噬调控机制复杂,需结合多种方法(如分子标记、动态通量分析)避免误判。例如,LC3-II水平受细胞类型影响,而p62降解可能受泛素-蛋白酶体系统干扰 。未来开发微自噬特异性工具及CMA定量技术将深化对自噬病理机制的理解。
| 名称 | 货号 | 规格 |
| Autophagy Antibody MiniAb Set | S0M1005-1 Kit | 1 Kit |
| Apoptosis activator-2 | abs810359-5mg | 5mg |
| Apoptosis MiniAb Set II | S0M1027-1Kit | 1Kit |
| PE Annexin V Apoptosis Detection Kit I | 559763 | 100Tst |







