TAK-500
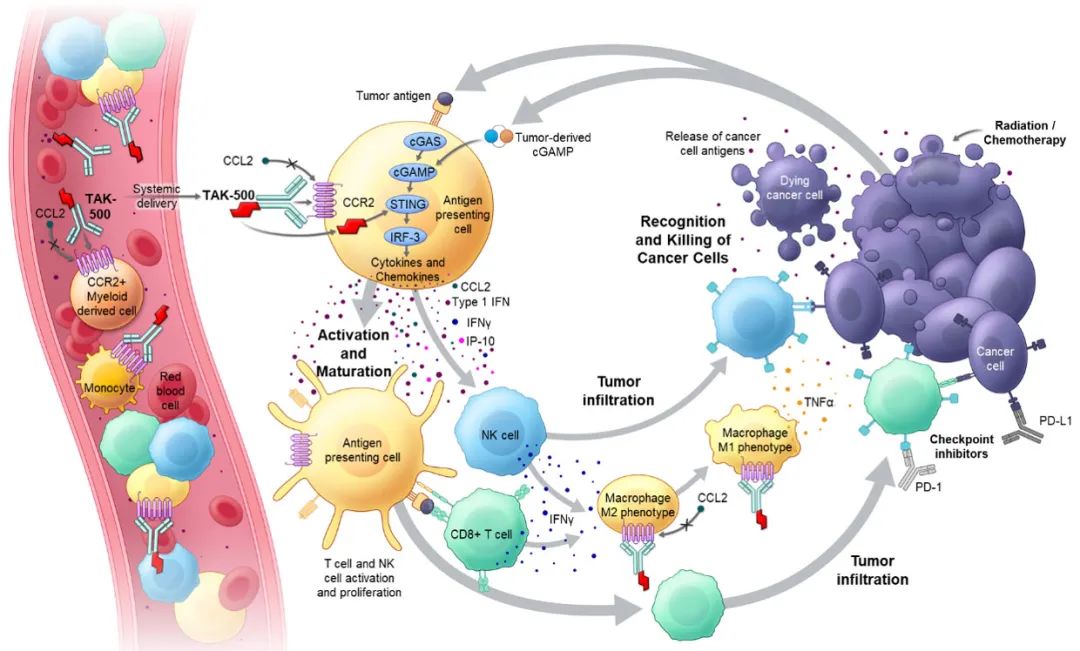
TAK-500是一款首创的STING激动剂免疫刺激抗体药物偶联物(iADC),能够将达唑替尼递送至肿瘤微环境中的CCR2+髓系细胞。目前,TAK-500正在进行临床1/2期试验。研究表明,TAK-500能够增强STING激动剂的疗效,激活免疫细胞产生抗肿瘤免疫反应。CCR2在多种人类肿瘤的髓样细胞中高表达,与临床特征相关,为癌症免疫治疗提供了新策略。
研究背景
免疫检查点抑制剂在治疗癌症方面存在局限性,而STING通路的激活成为增强抗肿瘤免疫的新方向。CCR2在多种细胞中表达,肿瘤微环境中的CCR2+髓样细胞表型复杂,影响肿瘤免疫。研究人员假设,通过靶向CCR2+髓样细胞递送STING激动剂,可以增强抗肿瘤效果,减少全身炎症反应。基于此假设,开发了TAK-500并展开了相关研究。
材料和方法
细胞系和小鼠模型
实验所用细胞系来源明确,培养条件规范,经支原体和鼠病原体检测,部分细胞系进行了STR鉴定。动物实验遵循相关委员会批准,使用多种小鼠肿瘤模型。
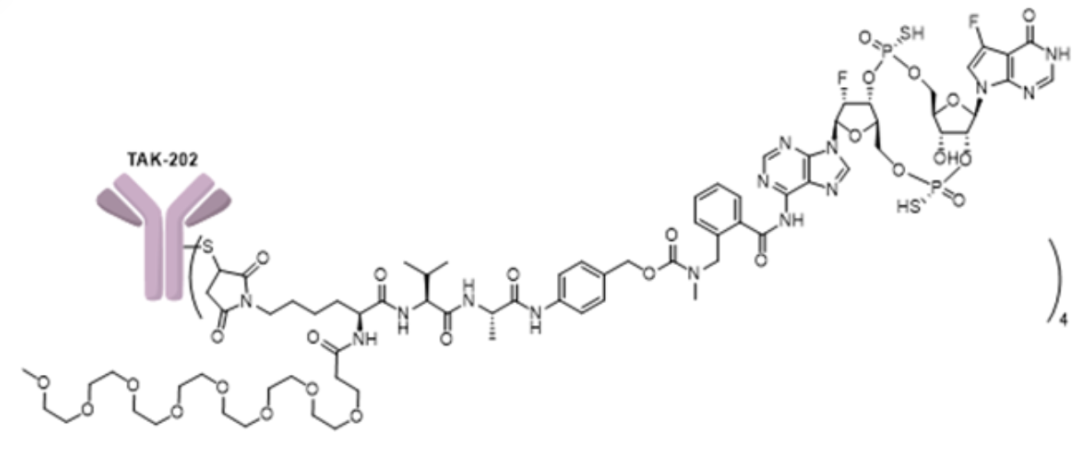
TAK-500和mTAK-500的合成及分析
介绍了TAK-500和mTAK-500的合成方法,以及用于评估合成质量的分析方法,包括SEC、HIC和QTOF-LCMS等。
体外实验
多种体外实验评估了TAK-500和mTAK-500的活性。使用细胞系报告基因检测STING激活,流式细胞术测量受体占有率,分离人PBMCs评估单核细胞激活,CRISPR敲除THP1细胞CCR2研究其功能,检测人全血中细胞因子诱导情况,评估对T和NK细胞激活的影响,以及检测在人和鼠细胞中的结合情况。应用Meso Scale Discovery(MSD)技术检测细胞因子浓度,具体涉及在体外评估人全血中细胞因子诱导情况以及在体内评估荷瘤小鼠模型中细胞因子表达。
体内实验
在荷瘤小鼠模型中评估了mTAK-500的药代动力学、疗效、细胞因子诱导和免疫细胞调节作用。还进行了免疫细胞耗竭、与抗PD-1联合治疗和与放疗联合治疗实验,以探究mTAK-500的作用机制和联合治疗效果。使用mQIF评估人肿瘤样本中CCR2表达,分析其与临床和分子特征的关系。
研究结果
TAK-500的优势
TAK-500和mTAK-500能够特异性结合CCR2,增强STING通路激活,相比未结合的达唑替尼效力更强。mTAK-500在荷瘤小鼠中显示出良好的药代动力学特性,肿瘤内抗体和达唑替尼暴露时间延长。
体外免疫激活
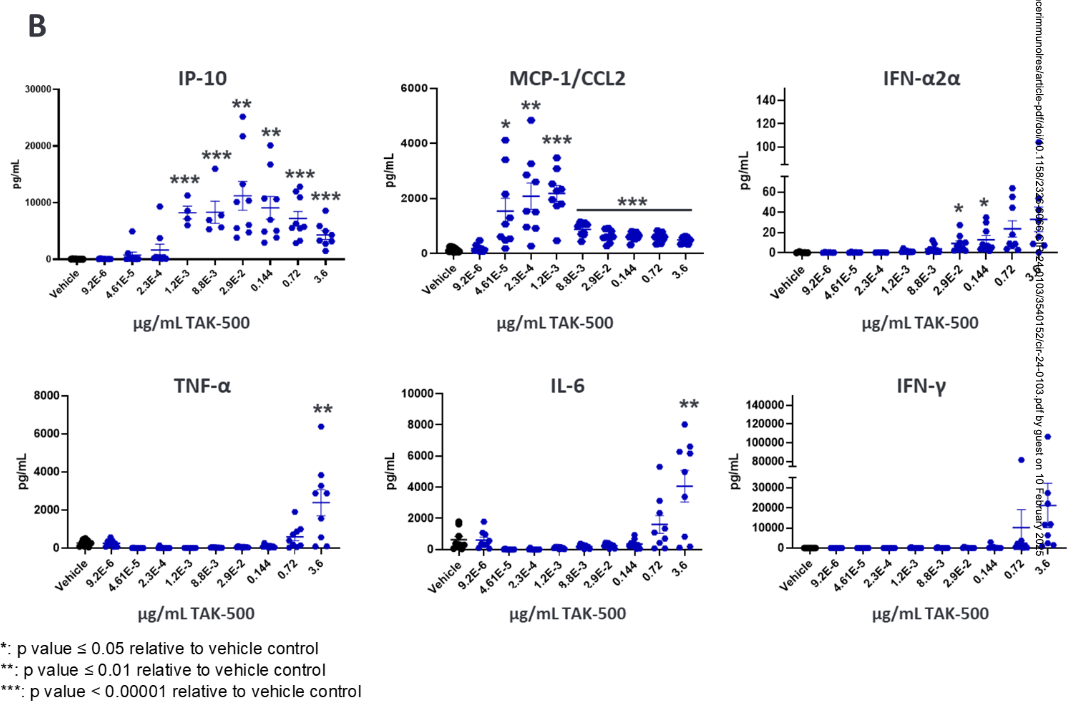
TAK-500处理人PBMCs,可剂量依赖性降低经典单核细胞频率,减少部分供体单核细胞CCR2表达,增加CD80表达,还能激活多种免疫细胞,诱导人全血中多种细胞因子产生,NK细胞是IFNγ的主要产生细胞。例如,图2B展示了TAK-500不同浓度下,IP-10、MCP-1/CCL2、IFN-α2a等多种细胞因子的浓度变化趋势,表明TAK-500能够诱导人全血中多种细胞因子的产生,引发免疫反应,支持其具有促炎效应,为研究TAK-500激活免疫细胞、发挥抗肿瘤作用提供依据。
体内抗肿瘤效果及免疫调节
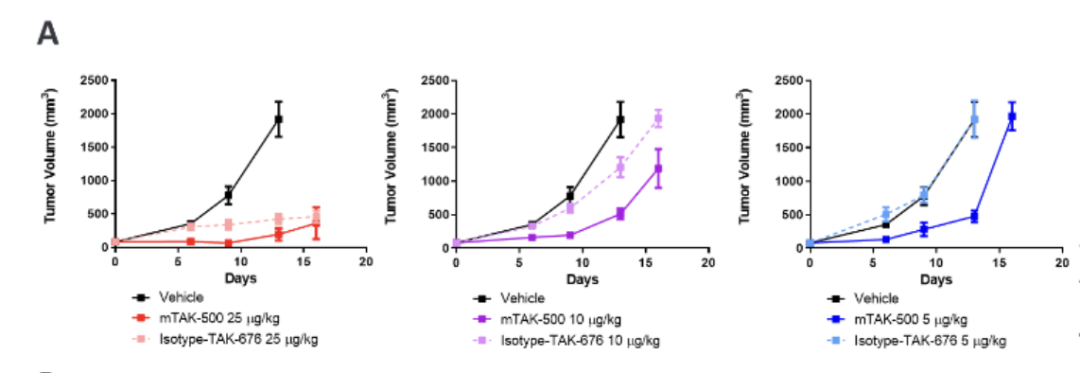
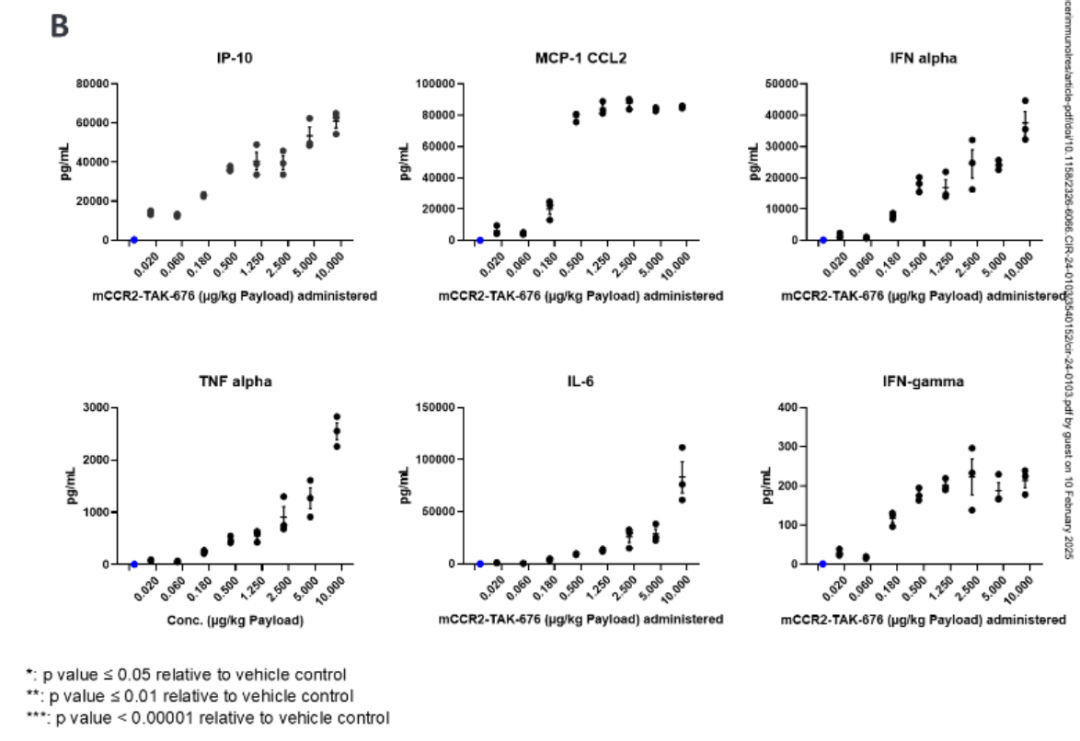
mTAK-500在荷瘤小鼠中具有剂量依赖性抗肿瘤活性,能激活先天和适应性免疫细胞,包括减少单核细胞频率和CCR2表达、增加单核细胞激活、增强DCs和CD8+ T细胞的激活与增殖。免疫细胞耗竭实验表明,mTAK-500的抗肿瘤作用依赖于DCs、CD4+和CD8+ T细胞。图3展示了mTAK-500在MC38荷瘤小鼠模型中的抗肿瘤作用和细胞因子反应。
联合治疗效果
mTAK-500与抗PD-1联合治疗,增强了抗肿瘤效果,增加了肿瘤浸润淋巴细胞的激活;与放疗联合,提高了CT26荷瘤小鼠的治疗效果,改变了肿瘤微环境中的免疫细胞组成和功能。
CCR2表达与临床特征关系
在多种人类肿瘤中,CCR2主要在肿瘤内髓样细胞中高表达,在不同肿瘤类型中的表达存在差异。高CCR2表达与NSCLC中CD8+ TILs增加、PD-L1表达和cDC1标记物水平相关,在CRC中与MSI-H状态相关。
研究结论
TAK-500通过靶向CCR2+细胞增强STING激动作用和促炎反应,iADCs TAK-500和mTAK-500在人和荷瘤小鼠中诱导免疫细胞激活和抗肿瘤效应。CCR2在人类肿瘤髓样细胞中高表达,与局部适应性免疫反应和特定临床分子肿瘤亚群相关。TAK-500的作用机制包括选择性消耗CCR2+髓样细胞、极化巨噬细胞、激活DCs和动员CD8+ TILs,联合PD-1阻断剂或放疗可增强疗效,为癌症免疫治疗提供了新策略。然而,研究存在局限性,需进一步探索。如果您对MSD电化学发光技术或相关检测方法有更多兴趣,欢迎了解MSD超敏高通量多因子分析系统,该系统提供了更全面和深入的技术信息。