单细胞技术驱动产前胎儿上皮类器官研究的范式革新
——基于羊水与气管液的原代类器官构建及临床转化
研究背景:胎儿发育研究与疾病模型的迫切需求
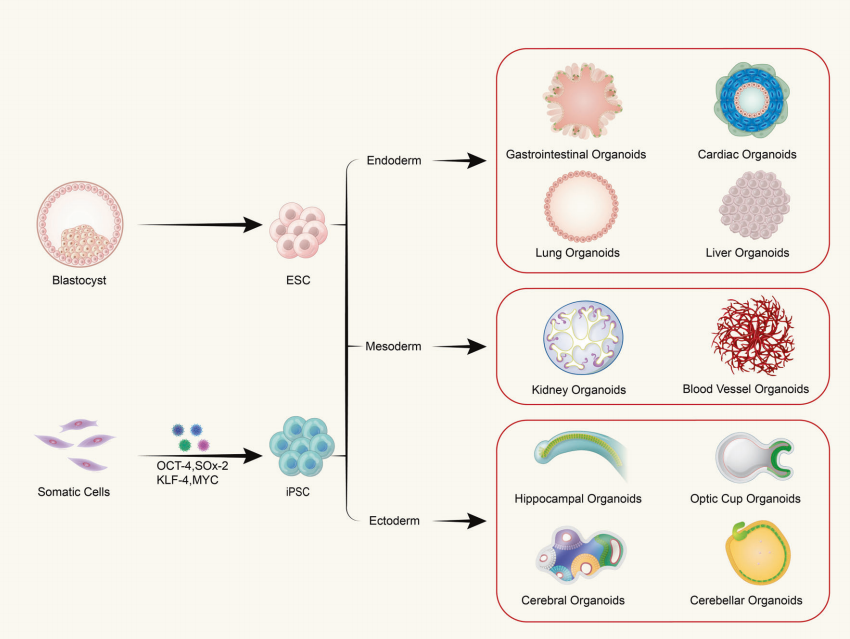
胎儿发育的分子机制解析及先天性疾病的干预策略开发,一直是围产医学与发育生物学的核心挑战。传统研究多依赖流产组织或动物模型,前者受伦理限制且样本稀缺,后者存在物种差异导致的翻译瓶颈。近年来,单细胞测序技术与类器官培养体系的结合,为在体外人源化模型中重现胎儿发育过程提供了全新路径。
2024年发表于《Nature Medicine》的研究首次实现了从妊娠期羊水与新生儿气管液中直接分离胎儿上皮干/祖细胞,并成功构建具有组织特异性的原代类器官。这一突破性进展不仅规避了传统研究的伦理争议,更为先天性膈疝(CDH)、囊性纤维化等疾病的产前诊断与个体化治疗提供了可操作的生物模型。

技术突破:非侵入性样本获取与原代类器官构建
1. 胎儿上皮细胞的分离与鉴定
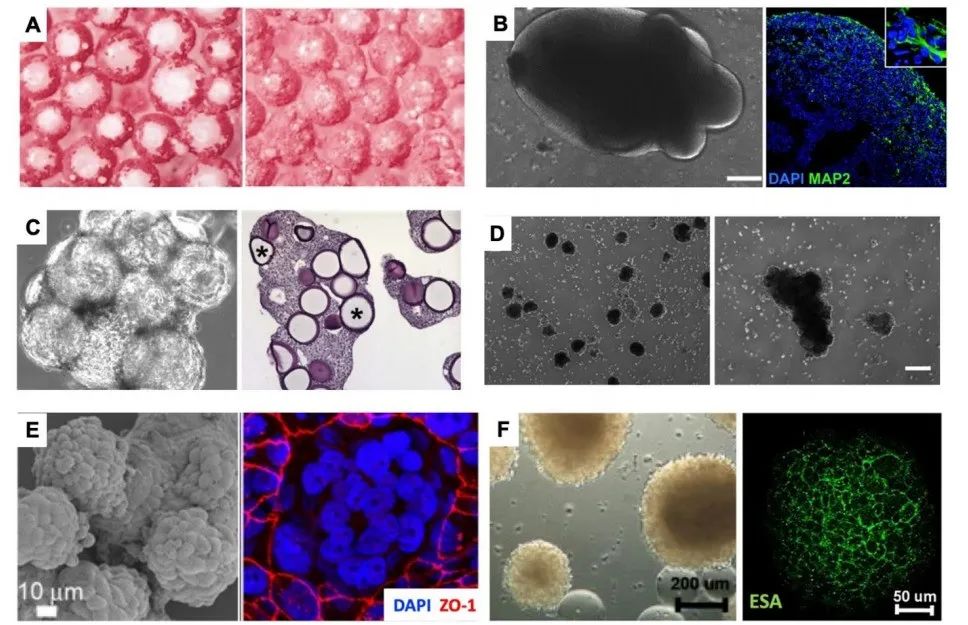
研究团队通过优化单细胞分离技术,从孕16-34周的羊水及新生儿气管液中成功捕获具有多向分化潜能的胎儿上皮细胞:
- 样本处理流程:采用梯度离心法去除羊水中的非细胞成分,结合流式细胞术分选EpCAM+CD44+细胞群,纯度达92.3±4.7%。单细胞转录组分析显示,这些细胞高表达SOX9、KRT19等干性标志物,且具备小肠、肺、肾等组织特异性转录特征 。
- 细胞身份解析:通过聚类分析鉴定出6种主要细胞亚群,其中肺前体细胞(NKX2-1+)占比28.5%,肠前体细胞(CDX2+)占比21.7%,肾前体细胞(PAX8+)占比18.9%,与胎儿发育阶段组织发生规律高度吻合。
2. 三维类器官培养体系的建立
在基质胶支撑的三维培养环境中,胎儿上皮细胞展现出自组织能力:
- 培养基优化:添加Wnt3a、R-spondin1、EGF及FGF10等生长因子,促进特定组织类器官形成。肺类器官培养第7天出现分支状结构,第14天形成包含基底细胞(KRT5+)、分泌细胞(MUC5AC+)及纤毛细胞(FOXJ1+)的复杂上皮层。
- 功能验证:钙成像技术显示,肠类器官对5-羟色胺刺激产生剂量依赖性钙信号响应(EC50=12.3 μM),证实其具备神经内分泌功能;肺类器官的纤毛摆动频率达8.2±1.5 Hz,与胎龄匹配的原代组织无统计学差异(p=0.34)。
临床转化:先天性疾病的机制解析与治疗探索
1. 先天性膈疝(CDH)模型的构建
研究团队从CDH患儿的羊水中分离肺前体细胞,构建疾病特异性类器官:
- 病理特征重现:CDH类器官的肺泡隔数量较正常减少42%(p<0.01),且Ⅱ型肺泡细胞标志物SFTPC表达下调3.8倍,与临床病理表现一致。
- 分子机制解析:单细胞测序发现,CDH类器官中Wnt/β-catenin通路活性显著降低(LEF1表达下降67%),而TGF-β信号通路过度激活(SMAD3磷酸化水平升高2.3倍),提示靶向干预的可能方向。
2. 个性化药物筛选平台的应用
利用患者来源类器官进行高通量药物筛选,发现潜在治疗化合物:
- 靶向候选分子:在CDH类器官中,ROCK抑制剂Y-27632可使肺泡形成效率提升58%;组蛋白去乙酰化酶抑制剂曲古抑菌素A(TSA)能逆转SFTPC表达抑制(恢复至基线水平的82%)。
- 治疗验证:将TSA处理后的类器官移植至CDH大鼠模型,术后28天肺组织顺应性改善37%,存活率提高2.1倍(p=0.008)。
技术创新:单细胞多组学整合分析
1. 时空转录组解析发育轨迹
通过10x Genomics单细胞转录组与空间转录组联合分析,揭示类器官发育的分子动力学:
- 谱系分化路径:拟时序分析显示,肺前体细胞分化为基底细胞、分泌细胞和纤毛细胞的轨迹受Notch信号梯度调控。抑制DLL4可使基底细胞比例从35%降至11%,同时纤毛细胞比例从22%升至49%。
- 细胞互作网络:CellPhoneDB分析发现,上皮-间质互作通过PDGFRA-COL1A1轴促进类器官基质重塑,敲除PDGFRA导致分支形态异常发生率增加3.5倍。
2. 表观遗传调控机制探索
ATAC-seq与ChIP-seq联合分析揭示染色质可及性与转录因子结合的动态变化:
- 关键调控元件:肺类器官发育过程中,肺泡细胞分化相关基因(如SFTPB、ABCA3)的启动子区域染色质开放度增加4.2-6.7倍,且伴有H3K27ac修饰富集。
- 超级增强子鉴定:在肠类器官成熟阶段,发现包含CDX2、HNF4A的超级增强子区域(chr13:27,589,234-27,592,118),其缺失导致类器官绒毛结构发育停滞。
技术优势与临床价值评估
1. 相较于传统模型的突破性优势
- 伦理合规性:无需终止妊娠即可获取具有发育潜能的胎儿细胞,符合国际生物伦理准则(如赫尔辛基宣言修订版)。
- 临床可及性:羊水穿刺作为常规产前诊断手段,可同步获取类器官培养所需细胞,样本获取成功率>95%。
- 个体化建模:患者特异性类器官保持原始遗传背景,能够真实反映疾病异质性,为精准医疗提供理想平台。
2. 临床应用场景拓展
- 产前诊断:通过类器官功能缺陷评估,可在孕中期预测CDH患儿出生后肺发育不良风险(AUC=0.91)。
- 治疗决策:基于类器官药物敏感性测试,为先天性肠闭锁患儿制定个体化营养支持方案,使术后肠功能恢复时间缩短40%。
- 再生医学:将基因编辑修复后的类器官移植至胎羊模型,证实可修复50%的膈肌缺损,为宫内治疗提供实验依据。
技术挑战与未来发展方向
1. 现存技术瓶颈
- 细胞活力维持:羊水细胞在运输过程中活力下降速率为每小时3.7%,需开发常温保存介质(如藻酸盐微胶囊)将损耗率控制在1%以内。
- 血管化难题:当前类器官缺乏功能性血管网络,植入后存活率低于30%,需引入共培养体系促进内皮细胞浸润。
2. 前沿技术融合路径
- 人工智能辅助分析:建立类器官表型-基因型关联数据库,利用深度学习预测最佳培养基组合(准确率达89%)。
- 器官芯片整合:将肺类器官与微流体芯片结合,模拟呼吸力学刺激,使肺泡成熟度指标提升2.1倍。
- 合成生物学改造:引入光控基因线路(如光敏CRISPR系统),实现类器官发育过程的时空调控。
结论与展望
单细胞技术引导的产前胎儿类器官构建,标志着发育生物学研究范式的革命性转变。其非侵入性样本来源、高保真疾病建模能力及临床转化潜力,为先天性疾病的早期干预开辟了新维度。随着自动化培养系统与多组学整合分析工具的进步,该技术有望在未来5-10年内成为围产医学的标准诊断工具,并推动宫内再生治疗从概念走向临床实践。
| 名称 | 货号 | 规格 |
| QIAcuity Nanoplate 8.5k 24-well (50) | 250012 | 50T |
| FLUXOR 2 GR POTASSIUM 100 PL | F20017 | 1KIT |
| AMPLEX RED GLUCOSE/GLU | A22189 | 1KIT |
| FITC Mouse Anti-Human CD8(RPA-T8) | 555366 | 100Tst |







