Titration of RAS alters senescent state and influences tumour initiation
一、引言
细胞衰老是一个与多种生理和病理过程相关的复杂现象,其中包括发育、伤口愈合、器官功能随年龄增长而衰退以及癌症等。特别是癌基因诱导的衰老(OIS)作为细胞对癌基因激活的一种防御机制,近年来受到了广泛关注。RAS是人类癌症中频繁突变的基因之一,但其致癌机制,特别是与OIS和肿瘤发生之间的关系,尚未完全阐明。英国剑桥大学的Masashi Narita团队在《自然》杂志上发表的题为《Titration of RAS alters senescent state and influences tumour initiation》的文章,通过体外和体内实验揭示了RAS基因剂量递增对肿瘤发展的影响,为理解早期肿瘤发生中的衰老和肿瘤起始表型提供了新的视角。
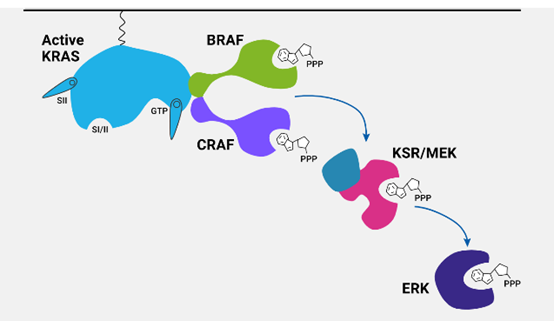
RAS信号通路示意图
二、文献背景
- 细胞衰老与OIS
细胞衰老是细胞对分子损伤的一种应激反应,这些损伤可能由复制性耗竭、异常的癌基因激活或化疗药物治疗等引起。衰老细胞的特征包括细胞周期延长、功能改变、产生复杂的分泌蛋白质组(SASP)以及经历转录、表观遗传、形态和代谢等方面的特征性变化。
OIS是细胞对癌基因激活的一种防御机制,通过诱导细胞衰老来防止细胞不受控制地增殖。这是一种与恶性肿瘤前期相关的自主肿瘤抑制机制,有助于防止癌症的发生。
- RAS基因与癌症
RAS是人类癌症中经常发生突变的基因之一,但仅靠一个致癌RAS等位基因本身并不足以引发癌症的发展。进一步增加突变RAS及其下游效应子(如MAPK途径)的活性似乎是必要的。然而,OIS通常需要过度的RAS活动,而低致癌剂量引起的表型尚不清楚。
三、研究方法与结果
1. 构建致癌RAS剂量递增模型
研究人员首先在体外和体内构建了致癌RAS剂量递增模型,以揭示RAS剂量驱动的下游表型的非线性连续体。通过流体动力尾静脉注射(HDTVi)稳定地传递含有致癌NRASG12V的转座元件,使转基因被一部分肝细胞吸收,从而在体内建立肝细胞OIS模型。
2. 单细胞RNA测序分析
对注射后第6天的肝细胞进行免疫组化(IHC)分析,结果显示肝细胞出现NRAS表达水平的显著异质性。随后,对流式分选后的肝细胞进行单细胞测序(scRNA-seq),以探索NRAS剂量的异质性是否转化为单细胞水平上的下游转录组差异。
- 分析结果:根据NRAS表达量的不同,肝细胞分化为具有OIS特征或祖细胞样特征的多个群落。伪时间分析显示,NRAS的表达水平与细胞群落的进展密切相关,NRAS剂量是细胞群落形成的主要驱动力。
- 基因表达:与衰老相关的基因表达水平与NRAS剂量呈线性相关,而SASP基因的表达则在不同群落中表现出异质性。
这些结果表明OIS在体内的异质性及其与NRAS剂量的依赖性。
3. 体外实验探究RAS基因对细胞周期的影响
为了更系统地探索对RAS不同水平的反应,研究人员开发了体外系统,用于滴定细胞中表达的异位RAS的剂量。构建了一个包含诱导型ER–HRAS(G12V)融合蛋白的预测报告系统,并通过4-羟基他莫昔芬(4-OHT)的添加来控制HRAS(G12V)的表达。
- 实验结果:低水平的HRAS(G12V)表达有助于RPE1细胞保持增殖能力,而高水平的表达则导致细胞衰老标志物的增加和细胞周期进展的减少。尽管高RAS表达的细胞群体中细胞增殖能力下降,但仍有部分细胞保持了增殖能力,表明在RAS诱导的衰老样状态下,细胞的增殖状态是异质性的。
这些结果显示了RAS基因剂量对RPE1细胞衰老和细胞周期进程的非线性剂量依赖性影响。
4. 体内实验探究NRAS剂量对肿瘤发生的影响
为了直接研究亚OIS剂量致癌RAS在体内的长期影响,研究人员在小鼠肝脏模型中应用了上述剂量滴定策略。通过使用不同强度的启动子来调控RAS蛋白的表达水平,并观察免疫细胞的募集情况、肿瘤的发生以及肿瘤细胞的特征。
-
实验结果:
- 在PGK-NRAS(G12V)或UBC-NRAS(G12V)小鼠中,免疫细胞的募集减少,这与低表达NRAS的肝细胞的免疫逃逸有关。
- 低剂量的致癌性RAS有助于肿瘤发生,这不仅是通过减弱免疫介导的清除,还可能是通过获得细胞自主变化,如增加的可塑性。
- scRNA-seq分析显示,在低NRAS表达的细胞中,存在一个高表达肝母细胞标记物的细胞群,这些细胞可能代表肿瘤发生状态。
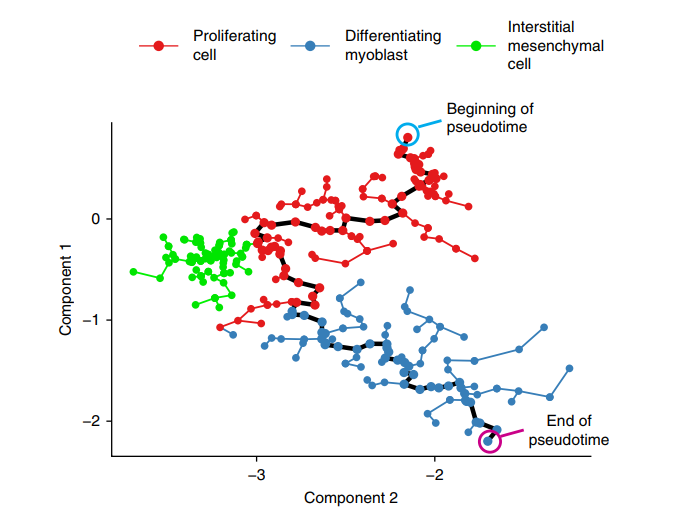
5. 肿瘤类型的鉴定与分子特征分析
研究人员分析了注射不同剂量NRAS(G12V)的小鼠发展出的肿瘤,特别是PGK-NRAS(G12V)或UBC-NRAS(G12V)模型,评估了肿瘤的分化程度,并将其与肿瘤发生的潜伏期相关联。
-
实验结果:
- 早期发生的肿瘤多为未分化,具有多形性肿瘤细胞和肉瘤样特征,这些肿瘤细胞通常表达CK19,但缺乏胆管癌的特定组织学特征。
- 晚期发生的肿瘤则为更分化的肝细胞癌(HCC),这些肿瘤细胞通常不表达nestin/NOTCH1。
- 相对高水平的RAS可以诱导衰老或祖细胞样状态(Notch1和Nes),导致侵袭性未分化肿瘤;而低水平的RAS诱导明显的祖细胞样状态(Dlk1, Gpc3和Afp),发展成分化程度更高、潜伏期更长的HCC。
6. 与人类肝脏肿瘤的相关性探究
研究人员探究了上述发现与人类肝脏肿瘤的相关性,通过基因表达相似性分析、预后评估以及在人类肝硬化患者中的观察,揭示了小鼠模型中的肿瘤发生状态与人类HCC的特定亚类之间的密切联系。
-
实验结果:
- 小鼠中的肿瘤细胞根据其分化程度和特定的分子标记(如NOTCH1、nestin、Dlk1)与人类HCC的早期或晚期亚类呈现出显著的基因表达相似性。
- 与特定HCC亚类相关的基因特征能够预测患者的预后,特别是对于分化较差的HCC亚类。
- 在人类肝硬化患者中也观察到了与小鼠模型中相似的肿瘤发生状态,表明这些状态可能在人类HCC的发展中也起着作用。
四、研究结果与讨论
本研究通过体外和体内实验,揭示了RAS基因剂量递增对肿瘤发展的影响。主要研究结果如下:
- NRAS剂量与OIS表型的关系:NRAS(G12V)的表达水平与肝细胞OIS表型和肿瘤免疫清除有关。高剂量的NRAS(G12V)诱导OIS,从而抑制肿瘤的发生;而低剂量的NRAS(G12V)则导致免疫逃逸和肿瘤的发生。
- 不同NRAS水平导致不同肿瘤类型:根据NRAS表达量的不同,肝细胞分化为具有OIS特征或祖细胞样特征的多个群落。这些群落进一步发展为不同类型的肿瘤,包括早期发生的未分化肿瘤和晚期发生的分化肝细胞癌。
- 与人类肝细胞癌亚类的相关性:小鼠中的肿瘤细胞与人类HCC的早期或晚期亚类呈现出显著的基因表达相似性。这些发现为理解HCC的发病机制和开发新的治疗策略提供了重要的线索。
本研究的结果定义了致癌剂量驱动的OIS谱系,调和了早期肿瘤发生中的衰老和肿瘤起始表型。通过体外和体内模型,本研究提供了关于RAS剂量相关衰老和免疫微环境演变的见解,揭示了至少两条通向肝脏肿瘤发生的不同路径。这些发现不仅加深了我们对RAS致癌机制的理解,还为肿瘤的预防和治疗提供了新的策略。
五、表格展示
以下表格展示了本研究中的关键发现和实验数据:
| 实验内容 | 实验方法 | 主要发现 |
|---|---|---|
| 构建致癌RAS剂量递增模型 | 流体动力尾静脉注射(HDTVi) | 揭示了RAS剂量驱动的下游表型的非线性连续体 |
| 单细胞RNA测序分析 | scRNA-seq | 肝细胞分化为具有OIS特征或祖细胞样特征的多个群落 |
| 体外实验探究RAS基因对细胞周期的影响 | 构建诱导型ER–HRAS(G12V)融合蛋白报告系统 | 低水平HRAS(G12V)表达有助于细胞增殖,高水平表达导致细胞衰老 |
| 体内实验探究NRAS剂量对肿瘤发生的影响 | 使用不同强度的启动子调控RAS蛋白表达水平 | 低剂量NRAS有助于肿瘤发生,与免疫逃逸和细胞自主变化有关 |
| 肿瘤类型的鉴定与分子特征分析 | 组织学分析、基因表达分析 | 早期发生未分化肿瘤,晚期发生分化肝细胞癌 |
| 与人类肝脏肿瘤的相关性探究 | 基因表达相似性分析、预后评估 | 小鼠模型中的肿瘤发生状态与人类HCC的特定亚类密切相关 |
肿瘤微环境示意图
六、结论与展望
本研究通过构建致癌RAS剂量递增模型,揭示了RAS基因剂量递增对肿瘤发展的影响。研究结果表明,NRAS(G12V)的表达水平与肝细胞OIS表型和肿瘤免疫清除有关,不同NRAS水平导致不同肿瘤类型,并与人类肝细胞癌亚类相关。这些发现为理解RAS致癌机制提供了新的视角,也为肿瘤的预防和治疗提供了新的策略。
未来的研究可以进一步探索RAS诱导的衰老样状态的分子机制,以及不同RAS表达水平下细胞状态与肿瘤发生潜力的关系。此外,还可以将本研究的结果应用于临床实践中,为肝细胞癌患者的诊断和治疗提供新的思路和方法。
| 名称 | 货号 | 规格 |
| BV510 Rat Anti-Mouse CD45(30-F11) | 563891 | 50ug |
| BrdU Pure 3D4 100ug | 555627 | 100ug |
| AFP (C3) | sc-8399 | 200μg/ml |
| p21 Waf1/Cip1 (F-5) | sc-6246 | 200μg/ml |







