先导编辑系统的结构与机制——基于“Structural basis for pegRNA-guided reverse transcription by a prime editor”的研究
引言
在基因编辑技术的不断发展中,先导编辑(Prime Editing, PE)作为一种新兴的精准基因编辑工具,正逐渐展现出其独特的优势和应用潜力。由化脓性链球菌Cas9 nickase (nSpCas9)和Moloney小鼠白血病病毒逆转录酶(M-MLV RT)组成的先导编辑系统,在先导编辑指导RNA (pegRNA)的引导下,能够在不引发双链断裂(DSB)或依赖供体DNA模板的情况下,实现基因组特定位置的碱基替换、小片段插入或删除。这一技术不仅理论上能够修复高达90%的人类致病基因突变,而且已被广泛应用于人类细胞和各种生物(如植物、斑马鱼、小鼠和果蝇)中,以实现精确的基因组编辑。
然而,尽管先导编辑技术在实验和应用中取得了显著进展,但其分子机制,特别是pegRNA指导的先导编辑器逆转录的过程,仍然缺乏详尽的结构信息。这一知识空白限制了我们对先导编辑技术更深层次的理解和优化。2024年5月29日,东京大学Osamu Nureki及博德研究所张锋等团队合作在《Nature》在线发表了题为“Structural basis for pegRNA-guided reverse transcription by a prime editor”的研究论文,该研究通过冷冻电镜技术(cryo-EM)揭示了SpCas9-M-MLV RTΔRNaseH-pegRNA-target DNA复合物在多种状态下的结构,为理解先导编辑的分子机制提供了关键性的理论支撑。

先导编辑系统的基本组成与工作原理
先导编辑系统的组成
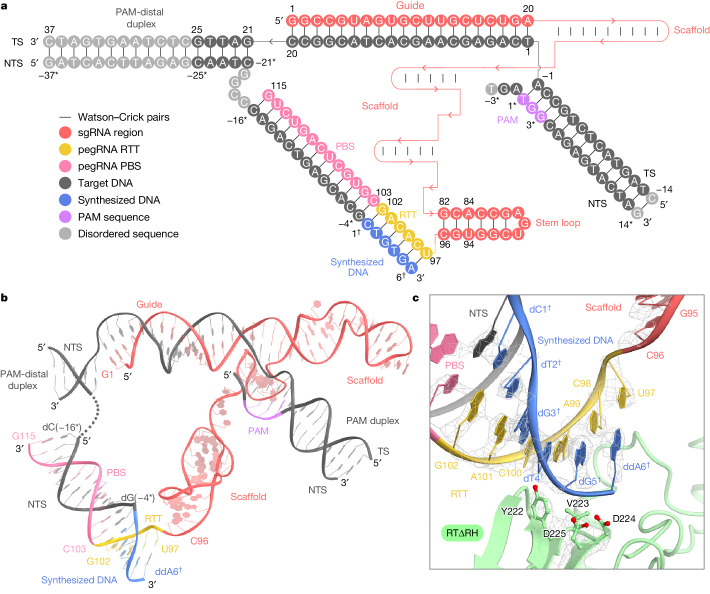
先导编辑系统由两个核心组件构成:一是先导编辑器,它由化脓性链球菌Cas9切口酶(nSpCas9)和经过基因工程改造的莫洛尼氏鼠白血病病毒逆转录酶(M-MLV RT)融合而成;二是先导编辑指导RNA (pegRNA),它包含sgRNA区域和3'延伸区域。其中,sgRNA区域设计有用于精准靶向目标序列的引导序列和与SpCas9相互作用的支架结构,而3'延伸区域则包含了逆转录模板(RTT)和引物结合位点(PBS)。
- nSpCas9:作为先导编辑器的一部分,nSpCas9负责识别与sgRNA引导序列相匹配的双链DNA靶标,并在非靶链(NTS)位置进行单链切割。这一步骤为后续的逆转录过程提供了必要的起始条件。
- M-MLV RT:经过基因工程改造的M-MLV RT在先导编辑系统中扮演了逆转录酶的角色。它能够与PBS-NTS形成的杂合双链相结合,启动逆转录过程以合成RTT序列,从而实现基因组的精确编辑。
- pegRNA:作为先导编辑系统的“导航员”,pegRNA通过其sgRNA区域引导nSpCas9精准定位到目标DNA序列,并通过其3'延伸区域的RTT和PBS指导逆转录过程。
先导编辑的工作原理
在先导编辑过程中,nSpCas9首先识别与sgRNA引导序列相匹配的双链DNA靶标,并在NGG(其中N为任意核苷酸)相邻原间隔基序(PAM)的指导下,对非靶链(NTS)进行单链切割。随后,M-MLV RT与PBS-NTS杂合双链结合,启动逆转录过程以合成RTT序列。这一过程中,M-MLV RT沿着RTT序列进行逆转录,将所需的编辑整合到目标位点中,从而实现基因组的精确编辑。
研究背景与动机
尽管先导编辑技术在实验和应用中取得了显著进展,但由于缺乏详尽的结构信息,我们对先导编辑器如何精准识别PBS-NTS杂合双链,进而启动并终止RTT序列的逆转录过程,这一关键机制仍然知之甚少。这一知识空白限制了我们对先导编辑技术更深层次的理解和优化,也阻碍了其在临床和生物医学领域的广泛应用。
为了揭示先导编辑器的分子机制,东京大学Osamu Nureki及博德研究所张锋等团队合作开展了本研究。他们利用冷冻电镜技术(cryo-EM)对SpCas9-M-MLV RTΔRNaseH-pegRNA-target DNA复合物在多种状态下的结构进行了详细分析,为理解先导编辑的分子机制提供了关键性的理论支撑。
研究方法与结果
研究方法
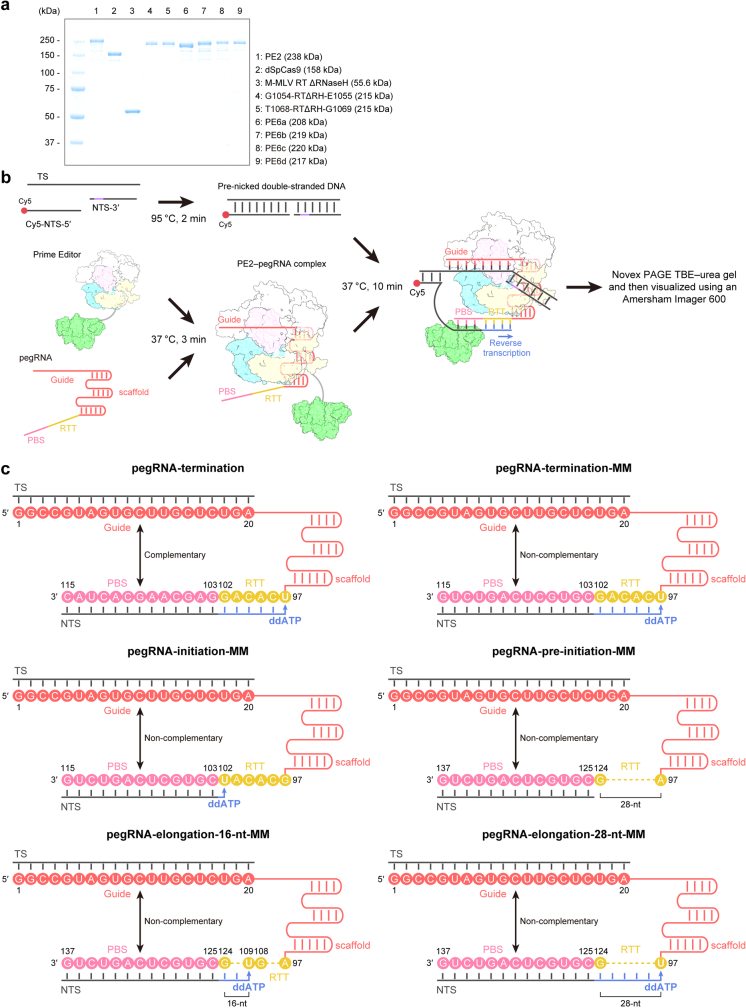
为了揭示先导编辑器的分子机制,研究人员采用了冷冻电镜技术(cryo-EM)对SpCas9-M-MLV RTΔRNaseH-pegRNA-target DNA复合物在多种状态下的结构进行了详细分析。他们首先纯化了内源性Prime editor 2 (PE2),并使用pegRNA和5'-cy5标记的预缺口dsDNA底物进行了体外Prime editing实验。随后,他们设计了多种pegRNA变体和Prime editor变体,并对M-MLV RT进行了截短和融合,以开发更小尺寸的Prime editor变体(PECO-Mini)。
在冷冻电镜实验中,研究人员使用了多种状态下的复合物样品,包括终止状态、起始状态和延伸状态等。他们通过收集大量高质量的电镜图像,并利用单颗粒重构技术对这些图像进行处理和分析,最终获得了复合物的高分辨率三维结构模型。
研究结果
- 终止状态下的结构分析
研究人员首先分析了终止状态下的SpCas9-M-MLV RTΔRNaseH-pegRNA-target DNA复合物结构。他们发现,在终止状态下,M-MLV RT将逆转录延伸到了预期的位点之外,导致支架衍生的结合,从而在目标位点上引起了不希望的编辑。这一发现揭示了M-MLV RT在逆转录过程中的非特异性延伸现象,为后续的变体设计和优化提供了重要线索。
为了更详细地了解逆转录酶在逆转录模板序列的终止点之后的延伸情况,研究人员对冷冻电镜结构进行了深入分析。他们发现,尽管M-MLV RT在逆转录过程中一直进行到RTT的末端,但SpCas9和RTΔRH之间存在大约10-Å的分离。在支架区域的3'端,C96与RTΔRH的关键残基形成广泛的相互作用,特别是C96的核糖部位分别与L99和R116形成堆叠和氢键,而G82-C96碱基对与Y64形成堆叠相互作用。这些相互作用表明,如果不被ddATP阻止,RTΔRH将继续在RTT之外逆转录进入骨架区域。
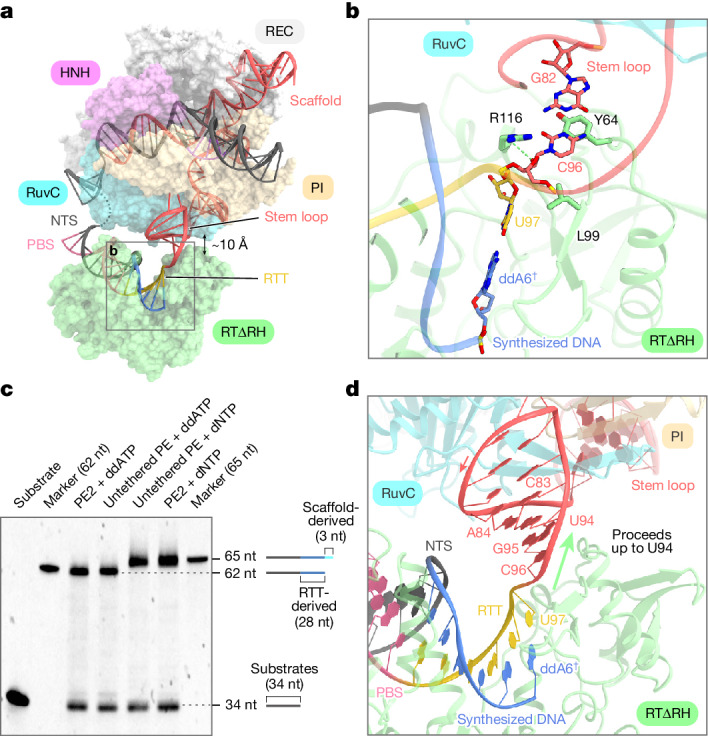
为了验证这一发现,研究人员进行了体外Prime editing试验,并使用ddATP和dNTP作为逆转录底物进行了比较。他们发现,具有dNTP的逆转录产物始终比具有ddATP的逆转录产物长3个核苷酸,表明PE2和非接触的PE的逆转录并不终止于RTT末端,而是进展到骨架区域的U94。这些结果表明,M-MLV RT将逆转录延伸至RTT上游3个核苷酸的pegRNA的U94,并通过与pegRNA解离而终止逆转录。
- 起始状态和延伸状态下的结构分析
除了终止状态外,研究人员还对起始状态和延伸状态下的SpCas9-M-MLV RTΔRNaseH-pegRNA-target DNA复合物结构进行了分析。他们发现,在起始状态下,M-MLV RT相对于SpCas9处于一个固定的位置,并与PBS-NTS杂合双链形成广泛的相互作用。这些相互作用为逆转录过程的启动提供了必要的结构基础。
在延伸状态下,M-MLV RT沿着RTT序列进行逆转录,并合成了与RTT序列互补的DNA链。这一过程中,pegRNA合成的DNA杂化双链沿着SpCas9表面建立,并与SpCas9形成稳定的相互作用。这些相互作用为逆转录过程的顺利进行提供了必要的结构支撑。
基于结构见解的变体设计
在获得SpCas9-M-MLV RTΔRNaseH-pegRNA-target DNA复合物的高分辨率三维结构模型后,研究人员基于这些结构见解合理地设计了pegRNA变体和先导编辑变体。他们通过修饰pegRNA的U94-C96区域以匹配目标位点,并调节A84-G82以维持茎环结构,成功地设计了能够消除支架衍生结合的pegRNA变体。此外,他们还通过融合M-MLV RT和SpCas9,开发了更小尺寸的Prime editor变体(PECO-Mini),为开发多功能Prime editing工具箱铺平了道路。
讨论
先导编辑技术的优势与挑战
先导编辑技术作为一种新兴的精准基因编辑工具,具有显著的优势和广泛的应用前景。与传统的CRISPR-Cas9基因编辑技术相比,先导编辑技术能够在不引发双链断裂(DSB)或依赖供体DNA模板的情况下实现基因组的精确编辑,从而降低了脱靶效应和细胞毒性的风险。此外,先导编辑技术还能够实现几乎任何所需的碱基替换、小片段插入或删除,为基因治疗和遗传病治疗提供了新的思路和方法。
然而,先导编辑技术也面临着一些挑战和限制。首先,由于缺乏详尽的结构信息,我们对先导编辑器如何精准识别PBS-NTS杂合双链并启动逆转录过程的机制仍然知之甚少。这一知识空白限制了我们对先导编辑技术更深层次的理解和优化。其次,先导编辑技术的编辑效率仍然有待提高,特别是在一些难以编辑的基因组区域。此外,先导编辑技术还需要进一步的临床验证和安全性评估,以确保其在临床和生物医学领域的广泛应用。
本研究的贡献与意义
本研究通过冷冻电镜技术(cryo-EM)揭示了SpCas9-M-MLV RTΔRNaseH-pegRNA-target DNA复合物在多种状态下的结构,为理解先导编辑的分子机制提供了关键性的理论支撑。首先,本研究揭示了M-MLV RT在逆转录过程中的非特异性延伸现象,并指出了导致不希望编辑的原因。这一发现为后续的变体设计和优化提供了重要线索。其次,本研究通过比较起始状态、终止状态和延伸状态下的复合物结构,揭示了M-MLV RT相对于SpCas9在逆转录过程中的位置变化以及pegRNA合成的DNA杂化双链的堆积方式。这些发现为理解先导编辑的逐步机制提供了重要的结构基础。最后,本研究基于结构见解合理地设计了pegRNA变体和先导编辑变体,为开发多功能Prime editing工具箱铺平了道路。
| 名称 | 货号 | 规格 |
| InVivoMAb anti-mouse IFNγ | BE0312-5mg | 5mg |
| InVivoMAb anti-mouse IFNγ | BE0312-100MG | 100mg |
| InVivoMAb anti-mouse IFNγ | BE0312-50mg | 50mg |
| InVivoMAb anti-mouse IFNγ | BE0312-25MG | 25mg |