免疫组化是基于免疫学基本原理——抗原抗体反应,即抗原与抗体之间特异性结合的原理,通过化学反应使标记在抗体上的显色剂(如荧光素、酶、金属离子、同位素等)发生显色反应,从而确定组织细胞内的抗原(多肽和蛋白质),并对其进行定位、定性以及相对定量分析的一种技术,也被称为免疫组织化学技术或免疫细胞化学技术。
一、原理
在免疫组化检测中,基于抗原抗体反应及化学显色原理,组织切片或细胞标本中的抗原首先与一抗特异性结合。随后,利用标记有生物素、荧光素等的二抗与一抗发生反应。在此基础上,再借助标记辣根过氧化物酶(HRP)或碱性磷酸酶(AKP)等的抗生物素(如链霉亲和素等)与生物素结合。最终,通过呈色反应或荧光信号,在光学显微镜或荧光显微镜下清晰呈现细胞或组织中化学成分的分布与含量。这一过程使得细胞爬片或组织切片上抗原抗体反应产物得以原位可视化,为研究细胞内特定化学成分的分布和含量提供了有力手段。
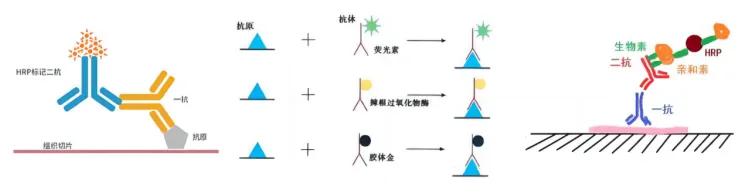
二、分类
按照标记物的种类,免疫组化技术可分为以下几种主要方法:



免疫组化技术的原理与方法比较
一、免疫组化技术原理
免疫组化技术的核心原理是利用一抗特异性结合目标蛋白,再通过二抗进行信号放大,从而实现对目标蛋白的检测和定位。
二、按染色步骤分类
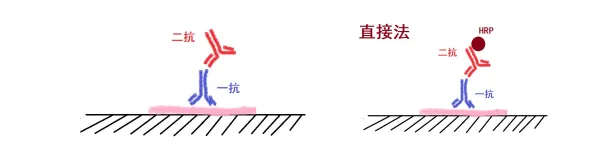
直接法(一步法)
原理:直接在二抗上标记酶(如辣根过氧化物酶,HRP),用于显色反应。
优点:操作简便,成本较低。
缺点:灵敏度较低,对于低丰度蛋白的检测效果不佳。
间接法(二步、三步或多步法)
原理:通过多步反应逐步放大信号,提高检测灵敏度。
优点:灵敏度显著提高。
缺点:操作步骤相对复杂。

三、按结合方式分类
抗原-抗体结合
过氧化物酶-抗过氧化物酶(PAP)法
原理:二抗标记HRP,再孵育能结合HRP的一抗。
优点:灵敏度较高。
缺点:非特异性增高,已逐渐被淘汰。
亲和连接
卵白素-生物素-过氧化物酶复合物(ABC)法
原理:二抗标记生物素,孵育后加入亲和素及标记HRP的生物素,通过聚合方式放大信号。
优点:灵敏度成倍提高。
缺点:非特异性增高。
链霉菌抗生物素蛋白-过氧化物酶连结(SP)法
原理:在亲和素上直接标记HRP,减少非特异性结合。
优点:灵敏度高,非特异性低,孵育时间短(通常10分钟)。
缺点:成本较高。
聚合物链接
即用型二步法
原理:在二抗上标记聚合的HRP,放大信号。
优点:灵敏度高,操作步骤简单。
缺点:成本较高。
适用范围:尤其适合内源性生物素含量高的组织抗原检测。
四、免疫荧光技术
免疫荧光技术主要采用以下方法进行信号放大:
直接法:操作简便,成本低,但灵敏度差。
LSAB法:灵敏度高,步骤相对简单。
三抗法:通过直接标记或LSAB标记的三抗进一步放大信号。
1. SP三步法操作流程
a. 脱蜡
-
步骤:将组织切片置于60℃恒温箱中20分钟,随后依次使用二甲苯I和二甲苯II各处理10分钟。
-
目的:去除切片中的石蜡,使后续试剂能够充分接触组织。
b. 梯度水化
-
步骤:依次使用100%乙醇I、100%乙醇II、95%乙醇、80%乙醇、70%乙醇,每种浓度处理3-5分钟。
-
目的:逐步降低乙醇浓度,使组织切片从脱蜡状态恢复到水化状态,为后续处理做好准备。
c. 灭活内源性过氧化物酶
-
步骤:在常温下,使用3%过氧化氢溶液避光孵育10分钟,随后用PBS缓冲液冲洗3次,每次3分钟。
-
目的:消除内源性过氧化物酶的活性,防止其干扰后续的免疫组化反应。
d. 抗原修复
-
步骤:将切片置于0.01M枸橼酸缓冲液(pH 6.0)中,使用微波炉高火加热4次,每次6分钟,自然冷却30分钟以上,至室温后用PBS缓冲液冲洗3次,每次3分钟。
-
目的:通过加热使固定过程中封闭的抗原决定簇重新暴露,提高抗原检测率。
e. 封闭
-
步骤:使用封闭液(一般与二抗来源一致,如正常羊血清工作液)封闭切片,常温下孵育10-30分钟,倾去封闭液,勿洗。
-
目的:封闭组织切片上的非特异性结合位点,减少背景染色。
f. 一抗孵育
-
步骤:滴加适宜浓度的一抗,4℃冰箱孵育过夜(最常用),37℃复温45分钟,用PBS缓冲液冲洗5次,每次3分钟(用PBS缓冲液代替一抗作阴性对照)。
-
目的:使一抗与组织中的目标抗原特异性结合。
g. 二抗孵育
-
步骤:滴加生物素标记的二抗,37℃孵育30分钟,用PBS缓冲液冲洗5次,每次3分钟。
-
目的:通过二抗与一抗结合,进一步放大信号。
h. SP反应
-
步骤:滴加辣根过氧化物酶标记的链霉亲和素工作液,37℃孵育30分钟,用PBS缓冲液冲洗5次,每次3分钟。
-
目的:通过链霉亲和素与生物素的高亲和力结合,进一步放大信号。
i. DAB显色
-
步骤:配置DAB/H₂O₂反应液,孵育组织切片,镜下控制显色时间,一般3-10分钟,自来水充分冲洗。
-
目的:通过DAB显色反应,使目标抗原显色,便于观察。
j. 苏木素复染
-
步骤:根据目标抗原的定位,胞浆蛋白或胞膜蛋白可适当染色几十秒至几分钟,胞核蛋白则染色几秒。若过染,可用1%盐酸褪色。
-
目的:形成细胞轮廓,便于对目标蛋白进行定位。
k. 常规脱水
-
步骤:依次使用50%、70%、95%、95%、100%、100%乙醇处理,每次1-2分钟。
-
目的:通过梯度脱水,使切片从水化状态恢复到脱水状态,为后续透明处理做好准备。
l. 透明
-
步骤:使用二甲苯I和二甲苯II各处理1-2分钟。
-
目的:使切片透明,便于后续封片和观察。
m. 封片
-
步骤:使用中性树胶封片。
-
目的:保护切片,防止切片干燥或损坏,便于长期保存和观察。
2. 免疫组化的关键环节
① 脱蜡和水化
-
目的:使后续试剂能够充分与组织中的抗原结合反应。
-
操作:脱蜡可先60℃处理20分钟,然后使用二甲苯处理1-3次,每次10分钟(具体时间根据二甲苯的新鲜程度和室温调整)。当天制好的切片一般先60℃处理3-4小时。水化则使用梯度乙醇(由高到低)。若脱蜡和水化不完全,易出现局灶性反应和浸洗不全,导致非特异性背景着色。
② 抗原修复
-
目的:通过抗原修复,使细胞内抗原决定簇重新暴露,提高抗原检测率。
-
方法:常用修复方法从强到弱分为高压修复、微波修复、胰酶修复。修复液也分为若干种(中性的、高pH的等)。
③ 灭活内源性过氧化物酶和生物素
-
目的:防止内源性过氧化物酶和生物素干扰免疫组化反应。
-
操作:在传统ABC法和SP法中,使用3%过氧化氢灭活内源性过氧化物酶,常温下处理10分钟左右;0.3%过氧化氢则可适当延长处理时间至10-30分钟。用甲醇配置过氧化氢比双蒸水或PBS更好,有助于保护抗原和固定组织。过氧化氢孵育时间过长易引起脱片,需现用现配,配好后4℃避光保存。
④ 血清封闭
-
目的:防止组织切片上的非特异性结合位点与一抗结合,造成假阳性结果。
-
操作:封闭血清一般与二抗来源一致,如正常羊血清工作液。血清中的抗体可预先与组织中有交叉反应的位点结合。也可使用小牛血清、BSA、羊血清等,但不能与一抗来源一致。一般室温孵育10-30分钟,但需防止封闭过度。
⑤ 一抗和二抗浓度和孵育时间
-
目的:确保一抗与目标抗原特异性结合,二抗与一抗有效结合,放大信号。
-
操作:一抗孵育条件是免疫组化反应中最关键的环节,包括孵育时间、温度和抗体浓度。一抗孵育温度有4℃、室温、37℃,其中4℃效果最佳。孵育时间与温度、抗体浓度有关,一般37℃孵育1-2小时,4℃过夜后37℃复温45分钟。二抗孵育条件一般为室温或37℃,30分钟-1小时,浓度一般有工作液。抗体稀释液一般使用PBS,专用抗体稀释液中还含有叠氮化钠防腐剂、BSA稳定剂等成分,有利于抗体的多次回收利用。
⑥ 切片清洗(浸洗、冲洗和漂洗)
-
目的:防止一抗、二抗等试剂残留引起非特异性染色。
-
操作:适当加强清洗(延长时间和增多次数)尤为重要。单独冲洗,防止交叉反应造成污染;温柔冲洗(浸洗方式),防止切片脱落;冲洗时间要足够,彻底洗去结合的物质。PBS的pH值建议在7.4-7.6,浓度为0.01M。中性及弱碱性条件(pH 7-8)有利于免疫复合物的形成,而酸性条件则有利于分解;低离子强度有利于免疫复合物的形成,而高离子强度则有利于分解。
⑦ DAB显色
-
目的:通过DAB显色反应,使目标抗原显色,便于观察。
-
操作:背景的深浅和特异性染色的深浅均取决于DAB孵育条件。DAB显色时间不是固定的,主要由显微镜下控制显色时间,到出现特异性染色较强而本底着色较浅时即可冲洗。DAB显色时间很短(如几秒或几十秒)就出现很深的棕褐色,可能说明抗体浓度过高或孵育时间过长,需下调抗体浓度或缩短孵育时间。若很短时间就出现背景很深,可能说明封闭非特异性蛋白不全,需延长封闭时间。DAB显色时间很长(如超过十几分钟)才出现阳性染色,可能说明抗体浓度过低或孵育时间过短,需增加抗体浓度或
1. 非特异性染色的原因及解决方法
① 抗体孵育时间过长、抗体浓度过高
-
原因:抗体孵育时间过长或抗体浓度过高,容易导致背景着色增加。
-
解决方法:通过缩短一抗或二抗的孵育时间、稀释抗体浓度来控制背景染色。
② 使用多克隆抗体
-
原因:使用多克隆抗体容易出现非特异性着色。
-
解决方法:建议尝试使用单克隆抗体,以减少非特异性结合。
③ 内源性过氧化物酶和生物素含量高
-
原因:肝脏、肾脏等组织(尤其是含血细胞多的组织)内源性过氧化物酶和生物素含量高,容易导致背景染色。
-
解决方法:通过延长灭活时间和增加灭活剂浓度来降低背景染色。
④ 非特异性组分与抗体结合
-
原因:非特异性组分与抗体结合,导致背景染色。
-
解决方法:延长二抗来源的动物免疫血清封闭时间,并适当增加封闭液浓度,以增强封闭效果。
⑤ DAB孵育时间过长或浓度过高
-
原因:DAB孵育时间过长或浓度过高,容易导致背景染色。
-
解决方法:严格控制DAB孵育时间和浓度,确保在显微镜下观察到特异性染色较强而背景着色较浅时停止反应。
⑥ PBS冲洗不充分
-
原因:PBS冲洗不充分,残留抗体导致着色增强。
-
解决方法:在一抗、二抗和SP孵育后,务必充分冲洗切片,确保残留抗体被彻底洗去。
⑦ 标本染色过程中干片
-
原因:标本染色过程中出现干片,容易增强非特异性着色。
-
解决方法:保持标本湿润,避免干片现象的发生。
2. 呈阴性结果的原因及解决方法
① 抗体浓度和质量问题
-
原因:抗体浓度过高或过低,抗体质量问题,以及抗体来源选择错误。
-
解决方法:抗体浓度过高或过低均可能导致阴性结果,需摸索最佳抗体浓度。同时,确保抗体质量可靠,选择合适的抗体来源。
② 抗原修复不全
-
原因:抗原修复不充分,特别是甲醛固定的组织,抗原表位未充分暴露,影响抗体结合。
-
解决方法:对于甲醛固定的组织,必须进行充分的抗原修复,以打开抗原表位,便于抗体结合。
③ 组织切片抗原含量低
-
原因:组织切片本身抗原含量低,导致检测不到阳性信号。
-
解决方法:确保组织切片质量,必要时增加切片厚度或使用其他检测方法。
④ 血清封闭时间过长
-
原因:血清封闭时间过长,可能影响抗体与抗原的结合。
-
解决方法:控制血清封闭时间,避免过长封闭。
⑤ 细胞通透不全
-
原因:细胞通透处理不充分,抗体未能充分进入细胞内参与反应。
-
解决方法:优化细胞通透处理步骤,确保抗体能够充分进入细胞内与抗原结合。
| 名称 | 货号 | 规格 |
| 胎牛血清(标准级) | abs974-500ml | 500ml |
| 胎牛血清(特级) | abs981-500ml | 500ml |
| 胎牛血清(优级) | abs972-500ml | 500ml |
| 成牛血清(标准级) | abs991-125ml | 125ml |








