WB实验蛋白质提取
Western Blot作为一种经典的蛋白质分析技术,其结果的准确性和可靠性在很大程度上依赖于蛋白样品的制备质量。蛋白提取是实验的第一步,也是至关重要的环节。高质量的蛋白提取能够确保Western Blot条带结果清晰、美观且可靠。然而,不同样本的蛋白提取方法存在显著差异,这要求研究者根据具体的实验需求和样本类型选择合适的提取策略。
一、蛋白提取的总体步骤
(一)样本选择与处理
样本的选择和处理是蛋白提取的第一步,直接关系到后续实验的成功与否。根据实验目的和样本类型,可选择不同的处理方法:
-
体液样本:血浆、消化液和分泌液等体液中的可溶性蛋白质可以直接离心收集,无需额外的抽提步骤。这些样本中的蛋白质通常以游离形式存在,易于分离和纯化。
-
细胞样本:
-
悬浮细胞或细菌菌液:可直接离心收集,用于后续的蛋白提取。
-
贴壁细胞:需先用PBS清洗,去除培养基和其他杂质后,再进行收集。
-
-
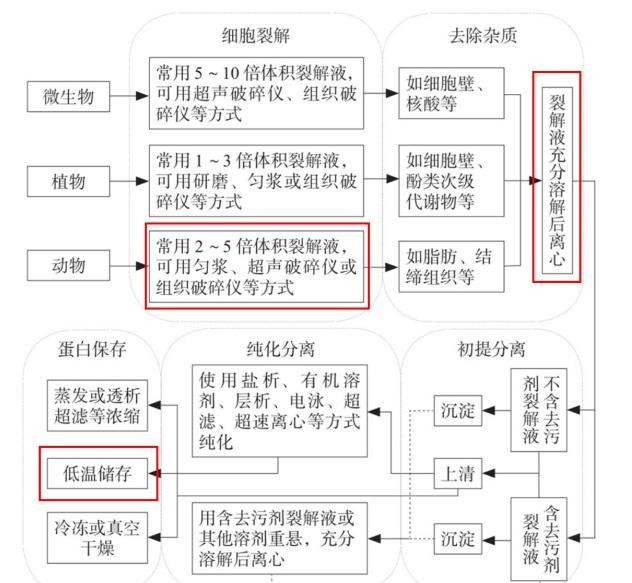
组织样本:动物组织或手术标本必须新鲜处理。首先,取得实验所需的脏器或组织,剔除结缔组织及脂肪组织后,用预冷的生理盐水或PBS洗去血液或其他体液。对于某些脏器(如心脏、大脑、肝脏等),可采用灌注法洗去内部血液。处理后的组织需用滤纸吸去多余水分后收集待用。若不能立即进行实验,应将组织冻存于-80℃。
(二)细胞/组织的破碎与裂解
除了分泌型细胞外蛋白可以直接离心使用外,大多数情况下需要先将细胞或组织破碎,使蛋白质充分释放到溶液中。不同生物体或同一生物体的不同组织,其细胞破坏的难易程度不同,因此需要选择合适的方法。以下是一些常用的破碎方法:
-
研磨或匀浆:
-
研钵研磨:适用于组织材料。将研钵置于冰上预冷,将组织及缓冲液放入后用力研磨成稠糊状。可加入氧化铝、石英砂及玻璃粉以进一步磨细,但需注意局部生热可能导致蛋白质变性或pH显著变化,且磨细剂的吸附可能导致蛋白质损失。研磨后离心取上清液。
-
手持式电动匀浆器:多数为硬质塑料材质,通过钻头与EP管内壁的摩擦将组织磨碎。由于两面间隔较小,对细胞的破碎程度较高,且机械切力对分子的破坏较小。
-
高通量组织破碎仪:加入适量的金属或玻璃等不同材质的珠子,通过机器高速敲击管壁震动使组织破碎。
-
-
超声波处理法:利用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂。此法多适用于微生物材料。超声的频率和功率根据实验目的不同而调整,通常分为多个周期进行(如超声几秒,停几秒,反复多次)。超声的优点在于耗时短,肽链提取片段长度更可控,回收率更高。然而,超声过程中容易产生气泡并大量产热,需将容器置于冰上以避免过热。过强的超声波可能导致多聚物降解和蛋白失活,若出现沉淀则说明超声功率过大。
-
反复冻融法:将样本在-20℃至-15℃下冻固后缓慢融化,反复操作使细胞及细胞内颗粒破坏。由于渗透压的变化,结合水冻结产生组织变性,冰晶碎片刺破细胞膜,使蛋白质可溶化。此方法成本低、操作简便,但过程缓慢,且不适用于对温度敏感的蛋白质。
-
酶法:使用分解细胞壁或细胞膜成分的酶类使细胞破裂。例如,溶菌酶能专一性地破坏细菌细胞壁,水解糖肽组分的β-1,4-糖苷键,使细胞内含物释放出来,特别适用于革兰氏阳性细菌。
-
有机溶剂法:将粉碎后的新鲜材料在0℃以下加入5 - 10倍量的丙酮,迅速搅拌均匀,可破坏细胞膜,使蛋白质与脂质分离。蛋白质一般不变性,脱脂和脱水后变为干燥粉末。用少量乙醚洗涤后,经滤纸干燥,如脱氢酶等可保存数月不失去活性。
-
表面活性剂法:这是实验中相对常用的方法。常用的表面活性剂包括十二烷基磺酸钠(SDS)、氯化十二烷基吡啶及去氧胆酸钠等,非离子型表面活性剂如吐温40(Tween 40)或Triton X-100等,这些溶剂能破坏细胞膜使细胞瓦解,使蛋白质更易溶解。除去表面活性剂后,蛋白质仍留在上清液中。
无论采用哪种方法破碎细胞,都会使细胞内的蛋白质或核酸水解酶释放到溶液中,导致大分子降解和天然物质量的减少。为避免这种情况,可加入二异丙基氟磷酸(DFP)抑制或减慢自溶作用;加入碘乙酸抑制活性中心需要巯基的蛋白水解酶的活性;加入苯甲磺酰氟化物(PMSF)清除蛋白水解酶活力。此外,还可通过调整pH、温度或离子强度等条件,优化目的蛋白质的提取。
(三)目的蛋白的提取
蛋白质提取的基本原理主要包括两个方面:一是利用混合物中各组分分配率的差异,将它们分配到可用机械方法分离的几个物相中,如盐析、有机溶剂提取、层析和结晶等;二是将混合物置于单一物相中,通过物理力场的作用使各组分分配于相同区域,从而达到分离目的,如电泳、超速离心、超滤等。
大部分蛋白质可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质则溶于乙醇、丙酮、丁醇等有机溶剂。因此,可采用不同溶剂提取分离和纯化蛋白质。
-
水溶液提取法:
-
提取条件优化:理想的提取条件应尽可能促进蛋白质在溶剂中的溶解,同时减弱蛋白水解酶的活力,以减少细胞的自溶过程。主要通过选择适当的pH、温度或溶剂,以及加入适当的蛋白水解酶抑制剂来实现。
-
稀盐缓冲系统:稀盐缓冲系统的水溶液对蛋白质稳定性好、溶解度大,是提取蛋白质最常用的溶剂。通常用量为原材料体积的1 - 5倍。提取时需均匀搅拌,以利于蛋白质的溶解。提取温度应根据有效成分的性质确定。多数蛋白质的溶解度随温度升高而增大,但温度过高可能导致蛋白质变性失活。因此,提取蛋白质时一般采用低温(4℃以下)操作。为避免蛋白质在提取过程中降解,可加入蛋白水解酶抑制剂(如二异丙基氟磷酸、碘乙酸等)。
-
pH选择:蛋白质是具有等电点的两性电解质,提取液的pH应选择在偏离等电点两侧的范围内。用稀酸或稀碱提取时,应防止过酸或过碱导致蛋白质可解离基团发生变化,从而引起蛋白质构象的不可逆变化。一般来说,碱性蛋白质用偏酸性的提取液提取,而酸性蛋白质用偏碱性的提取液。
-
盐浓度选择:稀盐浓度可促进蛋白质的溶解,称为盐溶作用。同时,稀盐溶液因盐离子与蛋白质部分结合,具有保护蛋白质不易变性的优点。因此,在提取液中加入少量NaCl等中性盐(一般以0.15mol/L浓度为宜)可提高蛋白质的溶解度。缓冲液常采用0.02 - 0.05mol/L的磷酸盐和碳酸盐等渗盐溶液。
-
-
有机溶剂提取法:
-
适用范围:一些与脂质结合牢固或分子中非极性侧链较多的蛋白质,不溶于水、稀盐溶液、稀酸或稀碱,可用乙醇、丙酮和丁醇等有机溶剂提取。这些溶剂具有一定的亲水性,同时具有较强的亲脂性,是理想的脂蛋白提取液,但必须在低温下操作。
-
丁醇提取法的优势:丁醇提取法对提取一些与脂质结合紧密的蛋白质特别优越。首先,丁醇亲脂性强,特别是溶解磷脂的能力强;其次,丁醇兼具亲水性,在溶解度范围内不会引起蛋白质的变性失活。此外,丁醇提取法的pH及温度选择范围较广,适用于动植物及微生物材料。
-
二、蛋白提取方法的优化策略
(一)蛋白提取方法的优化思路
在蛋白提取过程中,优化提取方法是确保蛋白质量的关键。不同的样本类型和实验目的需要不同的提取策略。以下是一些优化思路:
-
样本预处理的优化:
-
新鲜样本处理:对于动物组织或手术标本,必须在获取后立即处理,以防止蛋白质降解。新鲜组织应在低温条件下(如4℃)进行操作,以减少蛋白酶的活性。对于某些脏器(如心脏、大脑、肝脏等),可采用灌注法洗去内部血液,减少杂质的干扰。
-
样本保存:如果样本不能立即处理,应将其冻存于-80℃或液氮中。冻存前,样本应尽可能去除多余水分,以减少冰晶对细胞结构的破坏。
-
-
细胞/组织破碎方法的选择与优化:
-
机械破碎方法:如研磨、匀浆和超声波处理等,适用于大多数样本。但需注意破碎过程中产生的热量可能导致蛋白质变性。因此,破碎过程应在低温下进行,并尽量缩短操作时间。例如,超声波处理时,应将样本置于冰上,并控制超声功率和时间,以避免过度产热。
-
酶法破碎:适用于细胞壁较坚韧的样本,如植物细胞和细菌。选择合适的酶(如溶菌酶)和反应条件,可以有效破碎细胞壁,同时减少对蛋白质的损伤。酶法破碎通常在温和的条件下进行,有助于保持蛋白质的活性。
-
反复冻融法:适用于细胞壁较脆弱的样本,如某些微生物。该方法成本低、操作简便,但过程缓慢,且不适用于对温度敏感的蛋白质。在冻融过程中,应注意控制冻融次数和温度,以减少蛋白质的降解。
-
-
提取液的选择与优化:
-
缓冲液的选择:提取液的pH和离子强度对蛋白质的溶解度和稳定性有重要影响。一般来说,提取液的pH应选择在偏离蛋白质等电点两侧的范围内,以增加蛋白质的溶解度。同时,提取液中应加入适量的中性盐(如NaCl),以保护蛋白质不易变性。常用的缓冲液包括磷酸盐缓冲液(PBS)和碳酸盐缓冲液等。
-
蛋白酶抑制剂的添加:在提取过程中,细胞内的蛋白酶会释放出来,导致蛋白质降解。因此,应在提取液中加入适量的蛋白酶抑制剂,如苯甲磺酰氟化物(PMSF)、碘乙酸等,以抑制蛋白酶的活性。此外,还可通过调整提取液的pH、温度或离子强度等条件,进一步优化蛋白质的提取效果。
-
(二)蛋白提取方法的优化实例
以下是一些常见样本类型的蛋白提取方法优化实例:
-
细胞样本:
-
贴壁细胞:用PBS清洗后,加入适量的裂解液(如RIPA裂解液),并加入蛋白酶抑制剂。在冰上孵育10 - 15分钟,期间轻轻摇动培养瓶,使裂解液充分作用于细胞。然后用细胞刮刀刮下细胞,转移至离心管中,12000g,4℃离心5分钟,取上清液用于后续实验。
-
悬浮细胞:直接离心收集细胞,用PBS清洗后,加入裂解液和蛋白酶抑制剂,轻轻吹打混匀,冰上孵育10 - 15分钟,然后离心取上清液。
-
-
组织样本:
-
动物组织:将组织剪碎后,加入适量的提取液(如PBS或裂解液),用研钵研磨或匀浆器匀浆。研磨或匀浆过程中应置于冰上,以减少热量产生。研磨或匀浆完成后,12000g,4℃离心10分钟,取上清液。
-
植物组织:将植物组织在液氮中研磨成粉末,加入适量的提取液,轻轻搅拌混匀,置于冰上静置30分钟,然后12000g,4℃离心15分钟,取上清液。
-
-
体液样本:
-
血浆、尿液等体液:可直接离心收集,去除杂质后,加入适量的提取液(如PBS或裂解液),轻轻吹打混匀,冰上孵育10 - 15分钟,然后离心取上清液。
-
(三)蛋白提取方法的优化建议
在实际操作中,优化蛋白提取方法需要根据具体的样本类型和实验目的进行调整。以下是一些优化建议:
-
预实验的重要性:在正式实验前,建议进行预实验,以确定最佳的提取条件。预实验可以帮助确定合适的裂解液、蛋白酶抑制剂、提取时间和温度等参数,从而提高蛋白提取的效率和质量。
-
提取条件的优化:根据样本的特性和实验需求,优化提取条件。例如,对于需要保持蛋白质活性的实验,应选择温和的提取条件,如酶法破碎和低离子强度的提取液;对于需要大量提取蛋白质的实验,可选择高效的机械破碎方法和高浓度的裂解液。
-
提取过程的监控:在提取过程中,应注意监控样本的状态,如颜色、粘度等。如果发现样本出现异常现象,如沉淀、变色等,应及时调整提取条件或重新进行提取。
-
蛋白浓度和纯度的检测:提取完成后,应使用适当的方法检测蛋白浓度和纯度,如BCA法或Bradford法检测蛋白浓度,SDS-PAGE检测蛋白纯度。通过检测结果,可以评估提取方法的效果,并根据需要进行进一步的优化。
总之,蛋白提取是Western Blot实验的关键步骤,优化提取方法可以显著提高蛋白的质量和实验结果的可靠性。通过合理选择样本预处理方法、破碎方法和提取液,并根据实验需求进行优化调整,可以有效提高蛋白提取的效率和质量,为后续的实验研究提供可靠的保障。
| 名称 | 货号 | 规格 |
| 液体样本蛋白提取试剂盒 | abs50120-50T | 50T |
| 高尔基体蛋白提取试剂盒 | abs50121-50T | 50T |
| 脑组织蛋白提取试剂盒 | abs50114-50T | 50T |
| 全血蛋白提取试剂盒 | abs50115-50T | 50T |