EGFR-TKI
在全球范围内,非小细胞肺癌(NSCLC)占肺癌病例的80%以上,并且死亡率极高。靶向表皮生长因子受体(EGFR)突变(如del19和L858R)为NSCLC的治疗带来了范式转变。然而,罕见EGFR突变对EGFR靶向药物的敏感性存在显著差异,这种差异取决于具体的外显子18-21分子改变,其潜在的生物学机制尚不完全清楚。外显子18 G719X、外显子21 L861Q、外显子20 S768I以及外显子20插入突变是罕见突变中最常见的类型。
第四代EGFR酪氨酸激酶抑制剂(TKI)的开发受到越来越多的关注,因为这些药物能够抑制常见的第三代EGFR-TKI耐药突变(如C797S)。BDTX-1535是一种口服生物可利用、能穿透血脑屏障、突变选择性、不可逆的EGFR抑制剂,在NSCLC和胶质母细胞瘤中展现出显著的抗肿瘤活性(I/II期试验正在进行中)。作为一种第四代EGFR抑制剂,BDTX-1535在临床前模型中能够克服对奥希替尼的耐药性,并在携带C797S突变的NSCLC患者中显示出有希望的活性。实验模型表明,BDTX-1535能够抑制所有常见EGFR突变和50多种罕见突变,包括T790M、C797S、L718X、E709X、S784F、V834L和A289V,但对外显子20插入突变的抑制效果相对较弱。此外,BDTX-1535还能阻断EGFR受体细胞外结构域突变(如EGFRvII、III、IV)。
值得注意的是,在接受奥希替尼或其他EGFR-TKI治疗后进展的NSCLC患者中,高达50%的患者无法确定潜在的耐药机制,这表明非突变信号转导通路也可能在耐药中发挥作用。肿瘤内异质性是耐药的重要因素,包括以下三种主要机制:(I)耐药持久性(DTP)细胞,(II)染色体不稳定性,以及(III)染色体外DNA(ecDNA)(见于超过50%的NSCLCs)。这些发现提示,新型EGFR-TKI在充分靶向在靶耐药机制方面将面临诸多挑战。因此,在携带C797S突变及其他耐药机制的NSCLC患者中,迫切需要开发能够克服TKI耐药的新型药物。
背景
在全球范围内,非小细胞肺癌(NSCLC)占肺癌病例的80%以上,并且死亡率极高。在中国,NSCLC是最常见的癌症类型之一,也是癌症相关死亡的主要原因之一。靶向表皮生长因子受体(EGFR)改变为NSCLC的治疗带来了范式转变。在欧洲和美国,EGFR突变占所有NSCLC病例的10%-20%,而在亚洲则超过45%。外显子19缺失和外显子21 L858R突变是最常见的改变,约占NSCLC突变的90%;这些被称为“经典”(常见)突变,导致对酪氨酸激酶抑制剂(TKI)治疗高度敏感。
值得注意的是,在外显子19缺失和外显子21 L858R突变的NSCLC患者中,TKI治疗的无进展生存期(PFS)显著长于铂类化疗。其他EGFR突变被称为“罕见”突变,占所有EGFR突变的18%。
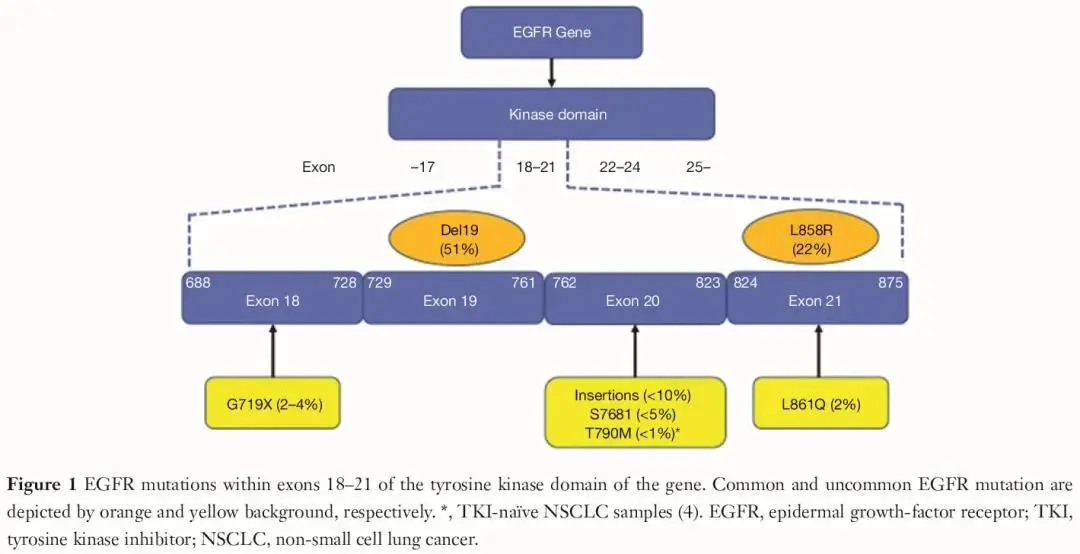
罕见 EGFR 突变
对 EGFR 靶向药物的敏感性存在显著差异,这种差异取决于特定的外显子 18-21 分子改变,目前尚未得到充分研究。外显子 18 G719X、外显子 21 L861Q、外显子 20 S768I 以及外显子 20 插入突变(如 S768_D770dup、A767_V769dup、N771_H773dup、P772_H773insV、p.A767delinsASVD)通常被认为是罕见突变中最常见的改变。
已知外显子 20 插入突变对先前获批的 EGFR 靶向药物耐药。目前,铂类化疗和免疫检查点抑制剂治疗是罕见 EGFR 突变 NSCLC 患者的标准治疗。Wu 等人首次表明,携带外显子 20 插入突变的 NSCLC 患者的无进展生存期(PFS)显著短于外显子 19 缺失和外显子 21 L858R 突变的患者(1.4 个月 vs 8.5 个月,P<0.001),这表明针对罕见突变的新药开发是一项高度未满足的医疗需求。
EGFR 突变在其他癌症中的作用
EGFR作为药物新靶点在成人癌症中已得到广泛研究,但在儿童中的研究相对较少。尽管在多种儿童肿瘤中发现了 EGFR 通路的改变(如 EGFR 扩增或过表达),但复发性疾病的治疗结局仍然较差。此外,探索靶向 EGFR 的 TKI 治疗儿童患者的研究显示,其疗效有限,这可能是由于与 EGFR 以外的其他因素相关的致癌信号通路(如 c-MET)被激活。
EGFR 在人类癌症中经常发生突变,并且在携带某些 EGFR 改变的 NSCLC 患者中是有效的治疗靶标。EGFR 突变主要发生在受体细胞内酪氨酸激酶结构域,从而直接促进其活性。
在过去的二十年中,一些研究表明,在儿童脑肿瘤(如胶质母细胞瘤)中发现了某些 EGFR 突变或扩增,但这些突变多位于细胞外,其作为驱动突变的作用尚不明确。这些突变包括外显子 20 小框内插入(胞内结构域)或错义突变(外显子 7 胞外配体结合结构域),可能不伴随基因扩增。在这些已报道的 EGFR 突变中,最常见的是 EGFRvIII。这种突变的特征是胞外结构域中缺失 267 个氨基酸,形成无法结合 EGF 配体且具有永久活性的突变受体。EGFRvIII 和其他细胞外变异被认为是晚期事件,主要发生在野生型 EGFR 扩增后。
第四代 EGFR TKI
BDTX-1535 是一种口服生物可利用、能穿透血脑屏障、突变选择性、不可逆的 EGFR 抑制剂,在 NSCLC 和胶质母细胞瘤中展现出显著的抗肿瘤活性。作为第四代 EGFR 抑制剂,BDTX-1535 在临床前模型中能够克服对奥希替尼的耐药性,并在携带 C797S 突变的 NSCLC 患者中显示出有希望的活性。值得注意的是,BDTX-1535 能够有效穿透血脑屏障,因此可能对治疗 NSCLC 中枢神经系统(CNS)转移具有显著益处。此外,BDTX-1535 在胞外结构域突变的胶质母细胞瘤中也表现出高活性。
实验模型显示,BDTX-1535能够抑制所有常见的EGFR突变和50多种罕见突变,包括T790M、C797S、L718X、E709X、S784F、V834L和A289V,但对外显子20插入突变的抑制效果相对较弱。此外,BDTX-1535还能阻断EGFR细胞外结构域突变(如EGFRvII、III、IV)。对于携带常见EGFR突变的NSCLC患者,随着一线治疗中可逆的第一代EGFR-TKI被新型第三代TKI(如奥希替尼)替代,获得性耐药突变中T790M突变的频率降低,而C797S突变的出现频率增加(占EGFR突变患者的5%-15%)。值得注意的是,许多携带L858R突变的NSCLC患者也携带罕见突变,这可能至少部分解释了为什么携带L858R突变的患者对奥希替尼的敏感性低于外显子19缺失患者。对于后者,罕见突变的共存较少,这些患者更常发生C797S突变作为获得性耐药机制。
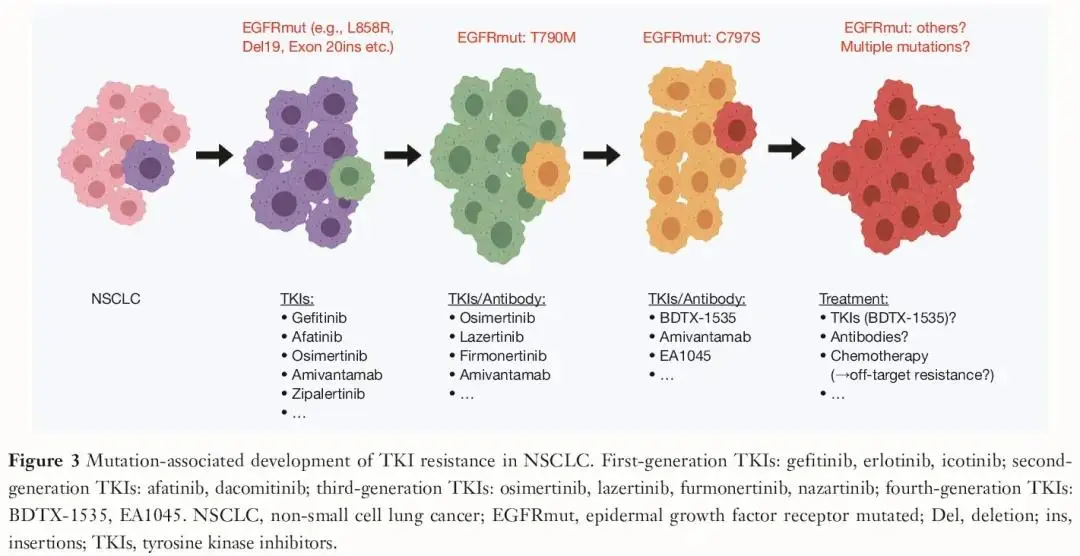
一项I/II期研究正在探索BDTX-1535,对NSCLC和胶质母细胞瘤分别进行剂量扩展和剂量递增试验(NCT05256290)。外显子20插入突变的患者不符合入组条件。27例NSCLC患者的初步结果显示,BDTX-1535(100mg,每日一次,口服)在几乎所有EGFR突变的NSCLC患者中都显示出活性,包括T790M、C797S、L747P、L718Q以及复合突变。即使在最高剂量水平(每日200mg)下,该药物也只有轻度或中度不良事件。在这些既往接受过多线治疗的患者(既往治疗线数:1-9)中,客观缓解率(ORR)为36%(22例可评估患者),大多数患者获得持久缓解。此外,6例患者在≥100mg,每日一次的剂量下,疾病稳定[疾病控制率(DCR)85%]。19/22例患者在入组前对奥希替尼耐药。在这19例患者中,ORR为42%,截至数据截止时,14例患者仍在接受治疗。最常见的不良事件是皮疹(70%,2例患者为3级,无4级)和腹泻(35%,未见≥3级)。
迄今为止,几种用于治疗NSCLC的抗EGFR TKI和单克隆抗体已获得批准(欧洲医学协会(EMA)、美国食品和药物管理局(FDA))或处于后期临床开发阶段(表1)。其中,只有两种药物在临床试验中能以较低的半数抑制浓度(IC50)值靶向C797S突变:tigozertinib(以前称为BLU-945)(IC50:2.9-4.4 nM)和BDTX-1535(IC50:<10 nM)(表2)。tigozertinib的开发于2024年1月停止,其姊妹化合物BLU-701的临床开发也因无效而停止(表2)。EAI-045是首个变构激酶抑制剂;该分子不与Cys797结合,因为其残基位于变构结合口袋之外,但该药物具有显著更高的IC50(0.33 μM),目前尚未进行临床评估。
 表1
表1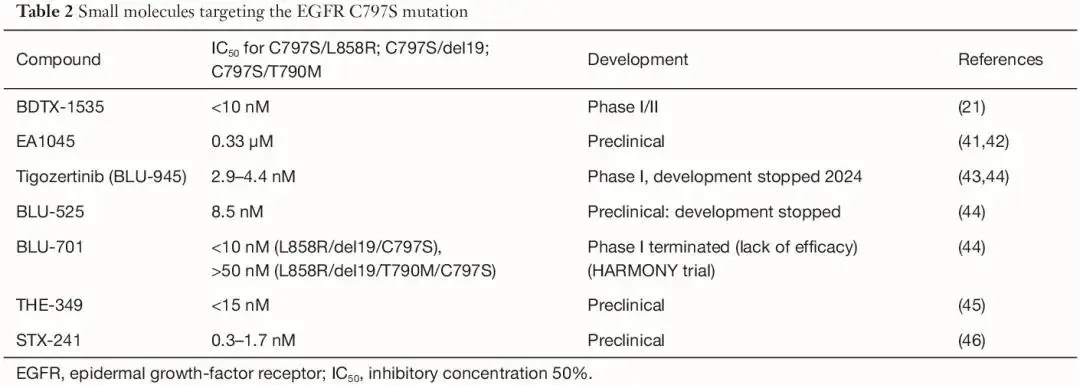
表二
相比之下,BDTX-1535是一种广谱EGFR突变TKI,能够靶向常见和罕见EGFR突变(包括C797S)以及细胞外变异和EGFR扩增。值得注意的是,BDTX-1535是首个处于临床开发阶段、能够靶向细胞外EGFR突变/变异和扩增的分子,这可能对其他肿瘤实体(如胶质母细胞瘤)具有潜在益处。然而,尽管BDTX-1535的激酶谱较广,但对外显子20插入突变的NSCLC患者显示出较弱的活性,因此这些患者未被纳入正在进行的临床试验。由于外显子20插入突变包含一组高度异质和多样化的EGFR改变(包括移码和非移码基因突变),可以推测这些患者中可能缺乏特异性BDTX-1535结合位点。
EGFR外显子20插入
目前,针对携带外显子20插入突变的NSCLC患者,仅有少数化合物处于临床开发阶段(表1)。其中,埃万妥单抗、伏美替尼、舒沃替尼和zipalertinib是进展最为领先的候选药物。埃万妥单抗是一种靶向EGFR和c-MET的双特异性单克隆抗体,已获EMA批准用于铂类治疗后的二线治疗,并被FDA批准与铂类和培美曲塞联合用于一线治疗,或用于既往铂类化疗后的二线治疗。结合后,抗体-受体复合体被蛋白酶体内化和降解(包括包含T790M、C797S和其他突变的胞内结构域)。
因此,在这种情况下,将靶向外显子20插入的特异性TKI与BDTX-1535联合用于未来临床试验,可能对某些NSCLC患者有益。
C797S突变再敏感方法
EGFR基因C797S突变是当前所有第三代TKI耐药的主要机制。已知C→S突变(如C481S)也会导致对伊布替尼的耐药性,提示C→S突变可能是一种关键的耐药突变,能够阻碍抑制剂与多种酪氨酸激酶的结合。长期使用这些新化合物后,可能再次出现耐药克隆。此外,是否会出现新的EGFR突变或一组不同的突变共同导致耐药,仍有待进一步观察。此外,C797S抑制剂可能会引发脱靶耐药机制,提示这些患者可能最终只能接受化疗。
最近的研究表明,EGFR T790M和C797S突变的等位基因关系对EGFR靶向TKI的反应至关重要。携带T790M/C797S反式突变(位于不同DNA链上)的NSCLC患者对第一代和第三代EGFR-TKI(如吉非替尼和奥希替尼)的联合疗法仍然敏感。然而,如果这些突变处于顺式等位基因关系(位于同一DNA链上),则没有TKI单药或联合疗法能够抑制耐药克隆。这表明C797S从反式到顺式的克隆进展可能是新的耐药机制。因此,克隆异质性可能在奥希替尼耐药肿瘤中起重要作用,而反式等位基因关系的识别可能为基于C797S的奥希替尼耐药NSCLC患者提供个体化治疗机会。
C797S以外的耐药机制
值得注意的是,在奥希替尼治疗后进展的所有NSCLC患者中,高达50%的患者无法确定潜在的耐药机制,这表明非突变信号通路也可能在耐药中发挥作用。Haratake等人首次证明,致癌蛋白MUC1-C(MUCIN)是NSCLC患者获得性奥希替尼耐药的重要驱动因素,支持奥希替尼耐药机制的多样性。MUC1-C与多种癌基因共同作用,驱动癌症干细胞、DNA损伤抵抗和免疫侵袭。Haratake等人使用奥希替尼耐药细胞系H1975-OR和MGH700-2D细胞(来源于奥希替尼耐药NSCLC患者),证明奥希替尼耐药与MUC1-C水平升高有关,并且使用GO-203抑制MUC1-C可在人源异种移植模型中恢复敏感性。类似地,Hu等人证明,奥希替尼耐药性与神经内分泌谱系转录因子achaete-scute同源物1(ASCL1)的上调有关。ASCL1对具有神经内分泌特征的肺癌的生存至关重要,其启动上皮-间充质基因表达程序,导致奥希替尼耐药的发生。
肿瘤异质性和EGFR TKI耐药
此外,肿瘤内异质性被认为对NSCLC患者EGFR TKI耐药有重要影响。在单个肿瘤中存在许多肿瘤亚克隆。对于NSCLC患者,耐药持久性(DTP)细胞克隆能够通过中性选择加速药物治疗耐药性的发生。
肿瘤内异质性定义为观察到的少数TKI耐药NSCLC细胞群克隆,这些克隆在大多数TKI敏感细胞对治疗有反应后重新开始增殖,导致NSCLC复发或进展。其主要机制包括:(I)DTP细胞,(II)染色体不稳定性,以及(III)染色体外DNA(ecDNA)。ecDNA被认为是肿瘤遗传异质性的主要促成因素,见于50%的NSCLC。EGFR突变以外的基因改变也可能导致DTP状态。
NSCLC细胞会经历各种变化以适应TKI治疗引起的新肿瘤微环境(TME)。DTP细胞被认为在此过程中起关键作用,并且可能是观察到的耐药机制的关键参与者。此外,推测在DTP状态期间会获得特定的获得性染色体改变(如T790M、C797S、c-MET扩增等)。DTP细胞的存活由H3K9甲基化和H3K27甲基化介导,强调了DTP对肿瘤耐药的重要性。此外,参与DNA损伤修复的多梳抑制复合体2(PRC2)可通过zeste同源物2增强子(EZH2;PRC2的酶亚基)使H3K27发生甲基化,提示抑制EZH2活性可以抑制肺癌DTP细胞克隆。
总结
第四代EGFR-TKI的开发受到极大关注,因为这些药物可能抑制第三代EGFR-TKI耐药NSCLC患者中常见的耐药突变(如C797S)。然而,尽管这些化合物显示出一定的临床活性,但在充分靶向在靶耐药机制方面仍面临一些障碍。主要障碍之一是TKI耐药的发生可能由脱靶突变或其他信号通路旁路激活引起。此外,将第四代EGFR-TKI与其他治疗方式(如免疫疗法或其他EGFR-TKI)联合使用的理想策略尚未确定,需要更多的临床前和临床研究,以更好地了解其管理肿瘤内异质性的能力。解决C797S突变以外的治疗耐药性将是一个主要目标,结合对DTP细胞和ecDNA对肿瘤内异质性影响的认识,可以为NSCLC患者带来更有效的治疗策略。全面基因组测序的使用已成为临床标准,通过精准医学和人工智能的进步,可以加速对耐药机制的更深入理解。更好地了解NSCLC耐药的分子因素可能为开发用于治疗NSCLC的新型、个性化、分子靶向药物铺平道路。迫切需要开发能够克服携带C797S突变及其他耐药机制的NSCLC患者TKI耐药的新型药物。如果这些结果可以在更大规模的随机试验中得到证实,将对未来NSCLC患者的治疗产生重大的临床意义。
| 名称 | 货号 | 规格 |
| Anti-EGFR Monoclonal Antibody(Cetuximab) | S0B0558-1mg | 1mg |
| EGFR (delE746-A750) Recombinant Rabbit mAb (S-451-168) | S0B0457-1ml | 1ml |
| EGFR Recombinant Rabbit mAb (SDT-R110) | S0B2145-10μl | 10μl |
| EGFR (L858R) Recombinant Rabbit mAb,PBS Only (SDT-421-202) | S0B2355P-1mg | 1mg |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)