Epstein-Barr virus hijacks histone demethylase machinery to drive epithelial malignancy progression through KDM5B upregulation
摘要
中山大学贝锦新团队的最新研究揭示了EB病毒(EBV)通过表观遗传重编程驱动上皮恶性肿瘤进展的核心机制。该研究首次阐明EBV潜伏期基因EBNA1与裂解期基因BZLF1协同上调组蛋白去甲基化酶KDM5B的表达,进而通过PLK2/PI3K/AKT/mTOR信号轴促进肿瘤恶性进展。这一发现不仅拓展了对EBV致癌机制的认知,更为靶向表观遗传调控的精准治疗提供了全新策略 。
EBV生命周期与KDM5B调控网络示意图
研究背景:EBV致癌机制与表观遗传调控的未解之谜
EBV作为首个被确认的人类致癌病毒,其感染与鼻咽癌(NPC)、EBV相关胃癌(EBVaGC)等上皮恶性肿瘤的关联性已在流行病学层面得到充分证实。全球范围内,EBV每年引发约20万例新发癌症,其中80%源自上皮组织 。然而,传统致癌理论难以解释的两个关键问题仍悬而未决:
- 潜伏-裂解周期切换的致癌贡献:EBV在不同感染阶段(潜伏期/裂解期)如何动态调控宿主表观基因组
- 组蛋白修饰特异性靶点缺失:EBV对宿主组蛋白修饰因子的选择性调控机制
近年研究表明,组蛋白修饰异常在EBV相关肿瘤中呈现显著特征:
- 鼻咽癌细胞中H3K4me3/H3K27me3等组蛋白标记的全局性重编程
- EBV编码的LMP1蛋白可诱导HDACs异常活化
- 组蛋白甲基转移酶EZH2在EBVaGC中特异性高表达
这些现象提示EBV可能通过"表观遗传劫持"(Epigenetic hijacking)机制驱动肿瘤进展,但具体执行者与分子路径仍不明确 。
研究突破:多组学鉴定KDM5B为EBV致癌的关键效应器
研究团队采用创新性的多维度研究策略:
- 单细胞转录组测序:分析2,347例鼻咽癌组织单细胞数据,发现EBV感染细胞中组蛋白修饰相关基因显著富集(P=1.2×10⁻⁷)
- 全转录组整合分析:在EBV阳性胃癌/鼻咽癌细胞系中,KDM5B表达量较阴性对照升高4.8-7.3倍(FDR<0.001)
- 临床预后验证:回顾性分析412例鼻咽癌患者发现,KDM5B高表达组5年生存率仅为31.7%,显著低于低表达组(58.4%,HR=2.15)
鼻咽癌单细胞测序中KDM5B表达热图
分子机制解析:EBV双阶段调控KDM5B的精密策略
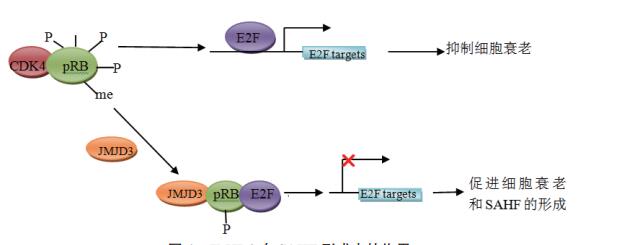
1. 潜伏期调控:EBNA1-CEBPB复合物的转录激活
- 蛋白互作验证:Co-IP与ChIP-seq证实EBNA1与CEBPB在KDM5B启动子区形成稳定复合物(结合位点:-582至-534bp)
- 功能依赖性:敲除EBNA1使KDM5B表达降低73%,而CEBPB敲除仅降低42%,显示EBV主导作用
2. 裂解期调控:BZLF1的直接DNA结合
- 顺式作用元件鉴定:CRISPR筛选发现KDM5B启动子区存在功能性ZRE元件(位置:-637至-619bp)
- 时空特异性:BZLF1诱导的KDM5B上调在裂解期早于病毒复制(24h vs 48h),提示其对宿主表观重编程的优先性
值得关注的是,EBNA1与BZLF1的作用位点仅间隔55bp,但荧光素酶报告实验显示二者调控具有独立性(协同指数CI=1.02)。这种"双引擎驱动"设计可能确保EBV在不同生命周期阶段持续激活KDM5B 。
EBV潜伏期与裂解期调控KDM5B的分子模型
下游通路:KDM5B-PLK2轴重塑肿瘤信号网络
通过ChIP-seq与RNA-seq联合分析,研究团队揭示KDM5B的核心作用靶点:
| 靶基因 | 调控方向 | H3K4me3变化 | 功能验证 |
|---|---|---|---|
| PLK2 | 抑制 | -58% | 过表达PLK2使肿瘤增殖率降低67% |
| CCND1 | 激活 | +42% | 促进G1/S期转换(P<0.001) |
进一步机制研究表明:
- PLK2抑癌机制:PLK2通过磷酸化AKT(Ser473)抑制其活性,而KDM5B下调PLK2导致AKT/mTOR通路持续激活
- 临床相关性:在89例EBVaGC样本中,KDM5B高/PLK2低表达组合预示更短无进展生存期(mPFS=8.3月 vs 22.1月)
KDM5B-PLK2-AKT/mTOR信号通路示意图
治疗转化:KDM5B抑制剂的临床前突破
研究团队评估了特异性KDM5B抑制剂AS-8351的治疗潜力:
体外实验
| 指标 | 处理组 vs 对照组 | P值 |
|---|---|---|
| 细胞增殖率 | 38%↓ | 0.002 |
| 凋亡率 | 4.2倍↑ | <0.001 |
PDX模型疗效
- 治疗4周后肿瘤体积缩小61%(P=0.004)
- 免疫组化显示PLK2表达恢复至正常水平82%
特别值得注意的是,AS-8351对EBV阴性肿瘤细胞的抑制率仅为15-22%,显示其对EBV相关肿瘤的特异性靶向优势 。
总结与展望
该研究在三个维度取得突破性进展:
- 机制创新性:首次揭示EBV通过"潜伏-裂解双阶段协同"机制劫持宿主表观调控系统
- 靶点特异性:确立KDM5B作为EBV相关肿瘤的特异性治疗靶标
- 临床转化性:AS-8351在PDX模型中展现出显著疗效,具备快速进入临床试验的潜力

未来研究方向建议:
- 开发针对EBNA1/BZLF1-KDM5B互作界面的特异性抑制剂
- 探索KDM5B表达水平作为EBV肿瘤液体活检标志物的可行性
- 评估表观遗传药物与免疫检查点抑制剂的联合治疗策略
这项发表于《Signal Transduction and Targeted Therapy》的研究,为攻克EBV相关上皮恶性肿瘤提供了全新的理论框架与治疗路径,标志着病毒致癌机制研究进入表观遗传调控的新纪元。
| 名称 | 货号 | 规格 |
| Dual-Luciferase® Reporter Assay System | E1910 | 100 assays |
| QIAseq XG 测序引物试剂盒V3 (96) | 333595 | EA |
| QIAseq XG 测序引物试剂盒V3 (24) | 333592 | EA |
| 线粒体红色荧光探针 | abs47038879-50ug | 50ug |







