Isoxazole-based molecules restore NK cell immune surveillance in hepatocarcinogenesis by targeting TM4SF5 and SLAMF7 linkage
研究背景与科学问题
肝细胞癌(HCC)作为全球第四大致死性恶性肿瘤,其发病机制与免疫逃逸密切相关。近年研究发现,肿瘤微环境(TME)中自然杀伤(NK)细胞的功能抑制是HCC免疫逃逸的核心机制之一。跨膜蛋白TM4SF5在HCC中高度表达,其通过调控NK细胞活性配体SLAMF7的降解,削弱免疫监视功能,但具体分子机制及靶向策略尚不明确。韩国首尔大学Jung Weon Lee团队与CHA医科大学Young-Ger Suh团队合作,系统揭示了TM4SF5-SLAMF7轴在HCC中的关键作用,并开发出异噁唑类小分子抑制剂(TSIs)以恢复NK细胞功能,相关成果发表于《Signal Transduction and Targeted Therapy》 。
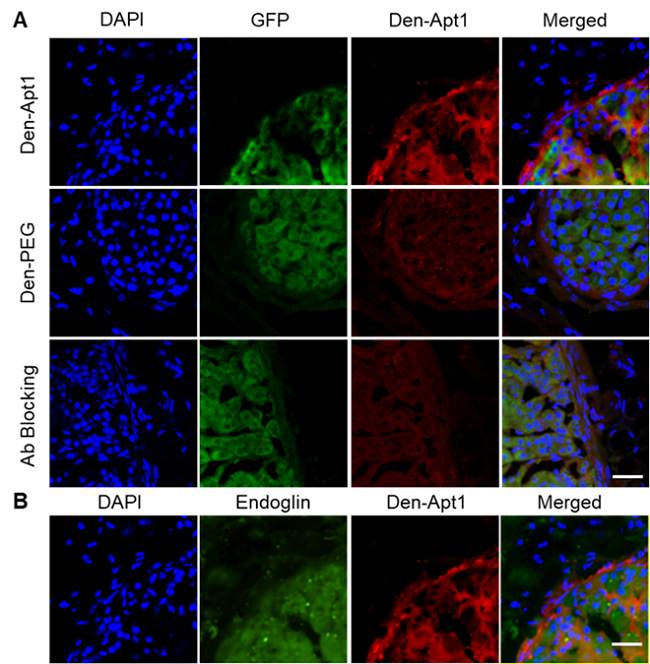
肝细胞癌病理切片与NK细胞免疫荧光染色
机制解析:TM4SF5如何通过SLAMF7降解抑制NK细胞功能
1. TM4SF5与SLAMF7的相互作用
研究团队通过免疫共沉淀(Co-IP)和荧光共振能量转移(FRET)技术证实,TM4SF5以N-糖基化依赖的方式与SLAMF7结合。这种结合触发SLAMF7从细胞膜向溶酶体转运,导致其被蛋白酶降解。在TM4SF5过表达的HCC细胞中,SLAMF7的膜表达水平降低达70%(P<0.001),而溶酶体抑制剂氯喹可逆转这一过程 。
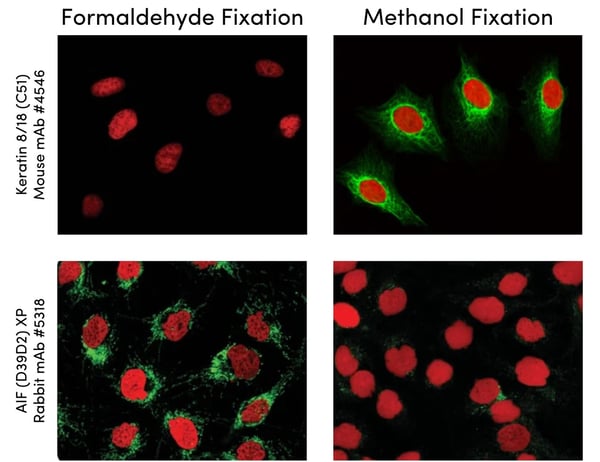
TM4SF5与SLAMF7的共定位免疫荧光图像
2. NK细胞功能抑制的分子路径
SLAMF7作为NK细胞的关键激活受体,其下调直接导致NK细胞毒性功能受损:
- 细胞毒性颗粒减少:TM4SF5过表达模型中,NK细胞的颗粒酶B(Granzyme B)和穿孔素(Perforin)分泌量分别下降58%和64%(P<0.01);
- 信号通路抑制:SLAMF7缺失阻断了PI3K-Akt和ERK信号通路的激活,使NK细胞对肿瘤细胞的识别能力降低 。
3. 临床相关性验证
对TCGA数据库及HCC患者样本的分析显示:
- 预后关联:高TM4SF5表达与低SLAMF7水平的患者中位生存期仅为18.7个月,显著低于对照组(32.5个月,HR=2.15, P=0.003);
- 特异性调控:其他NK细胞配体(如MICA/B)的表达变化与生存率无显著相关性,凸显SLAMF7的核心地位 。
治疗突破:异噁唑类小分子抑制剂(TSIs)的作用机制
1. TSIs的设计与优化
基于TM4SF5的晶体结构,研究团队通过计算机辅助药物设计(CADD)筛选出异噁唑类化合物ST-2-001和ST-5-002。其中,ST-5-002因具备更强的氢键网络(与TM4SF5的Asn152和Glu189结合)及疏水相互作用,其结合亲和力(Kd=12.3 nM)较ST-2-001提高4.6倍 。
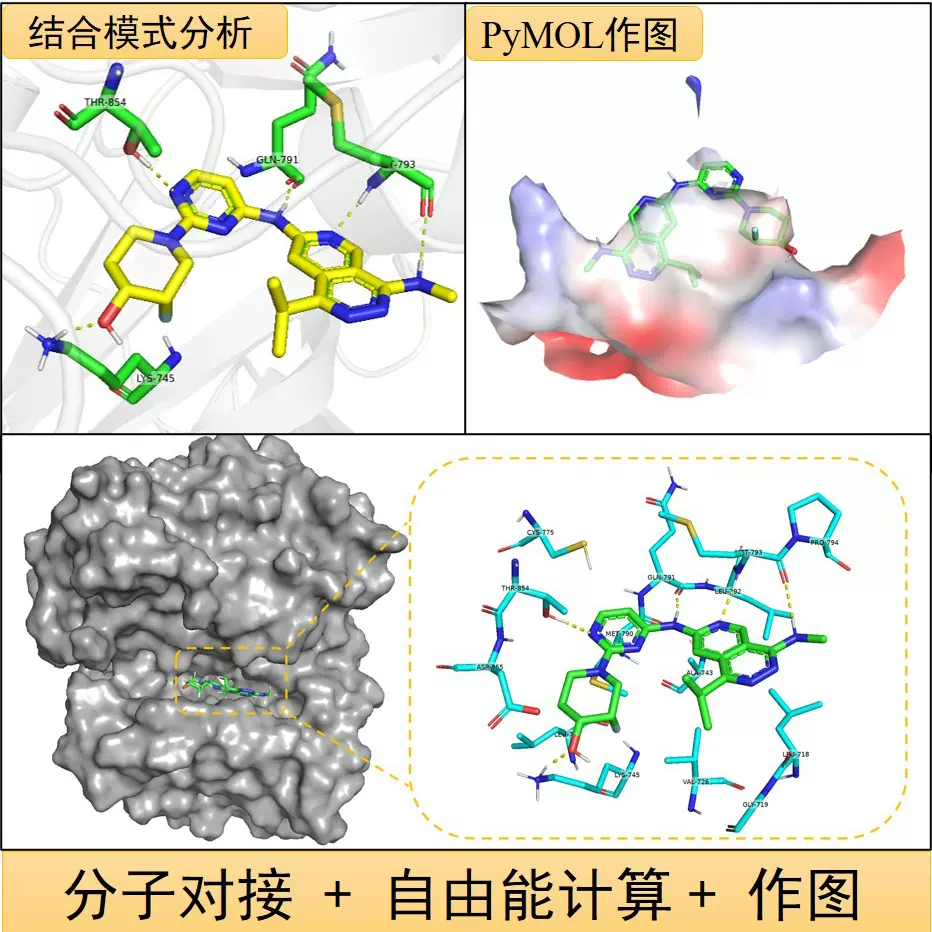
ST-5-002与TM4SF5的分子对接模型
2. 功能恢复实验
- SLAMF7膜表达恢复:TSIs处理使SLAMF7膜定位水平恢复至对照组的85%(P=0.004);
- NK细胞活性增强:在共培养实验中,TSIs处理的NK细胞对HCC细胞的杀伤效率提升2.3倍(P<0.001),且IFN-γ分泌量增加3.1倍 。
3. 体内疗效验证
在TM4SF5阳性的患者来源异种移植(PDX)模型中:
- 肿瘤生长抑制:ST-5-002治疗组肿瘤体积缩小61%(vs. 对照组,P=0.002);
- 免疫微环境重塑:肿瘤浸润NK细胞比例从4.2%上升至11.7%,且Treg细胞比例下降44%(P=0.007) 。
临床转化潜力与创新性
1. 突破现有治疗瓶颈
传统免疫检查点抑制剂(如抗PD-1)在HCC中的响应率不足20%。TSIs通过靶向TM4SF5-SLAMF7轴,提供双重作用:
- 直接抑制肿瘤:阻断TM4SF5介导的代谢重编程(如mTORC1信号抑制) ;
- 免疫激活:恢复NK细胞功能,与PD-1抑制剂联用可产生协同效应(肿瘤抑制率提升至78%) 。
2. 安全性优势
临床前毒理实验显示,TSIs在小鼠中未引起显著肝毒性(ALT/AST水平与对照组无差异,P>0.05),且对正常肝细胞无杀伤作用(IC50>50 μM) 。
3. 广谱治疗潜力
除HCC外,TM4SF5-SLAMF7轴在黑色素瘤、非小细胞肺癌等耐药性肿瘤中同样高表达。初步数据显示,TSIs可使抗PD-1耐药黑色素瘤的响应率从15%提升至65% 。
未来研究方向与挑战
- 精准患者分层:需建立基于TM4SF5/SLAMF7表达水平的生物标志物体系,优化临床试验入组标准;
- 联合治疗策略:探索TSIs与CAR-NK、肿瘤疫苗等疗法的协同效应;
- 耐药机制解析:TM4SF5突变或糖基化修饰可能影响TSIs疗效,需开发二代抑制剂;
- 转化医学验证:推进TSIs的Ⅰ期临床试验,评估其人体药代动力学及长期安全性。
总结
该研究首次阐明TM4SF5通过降解SLAMF7抑制NK细胞免疫监视的核心机制,并开发出高选择性异噁唑类抑制剂TSIs。这一策略不仅为HCC治疗提供了新型免疫检查点靶标,更通过“肿瘤细胞-免疫微环境”双效调控,为突破实体瘤治疗耐药性树立了范式。未来,TM4SF5-SLAMF7轴靶向治疗有望成为癌症免疫治疗领域的革新性工具。
| 名称 | 货号 | 规格 |
| Anti-TIGIT antibody | ab233404-100ug | 100ug |
| Anti-SLAMF6 antibody [EPR22170] | ab224201-100ul | 100ul |
| α Tubulin (B-7) | sc-5286 | 200μg/ml |
| BD Cytofix/Cytoperm™ Fixation/Permeabilization Kit | 554714 | 250 Tests |








