Identification of glutamine as a potential therapeutic target in dry eye disease
研究背景与临床挑战
干眼症(Dry Eye Disease, DED)作为全球高发的慢性眼表炎症性疾病,其病理机制涉及泪液分泌异常、高渗性损伤及免疫微环境失衡。当前临床治疗手段(人工泪液、局部糖皮质激素等)仅能缓解症状,无法逆转疾病进程。中国人民解放军总医院与北京同仁医院团队突破传统治疗框架,首次从代谢重塑角度揭示谷氨酰胺(glutamine)代谢异常在DED中的核心作用,并创新性提出间充质干细胞(MSCs)与胸腺肽β4(Tβ4)联合疗法通过调控谷氨酰胺代谢实现炎症抑制与组织修复的双重效果。
研究方法与技术路径
1. 多组学整合分析策略
研究团队采用代谢组学(MALDI-MSI质谱成像)与单细胞RNA测序(scRNA-seq)双技术平台,系统解析DED模型小鼠及临床患者角膜组织的代谢物分布与基因表达特征。通过对比健康组与DED组的代谢差异,锁定谷氨酰胺代谢通路异常为关键病理特征。
2. 联合治疗干预设计
- 实验分组:设立四组干预方案(对照组、MSCs单药组、Tβ4单药组、MSCs+Tβ4联合组)
- 机制验证:通过GLS1(谷氨酰胺酶1)基因敲除/过表达模型,明确靶点调控对炎症通路的影响
- 功能评估:结合活体共聚焦显微镜、免疫荧光染色及流式细胞术,量化角膜上皮完整性、炎症细胞浸润及凋亡水平
核心发现与机制阐释
1. 谷氨酰胺代谢失衡驱动DED进展
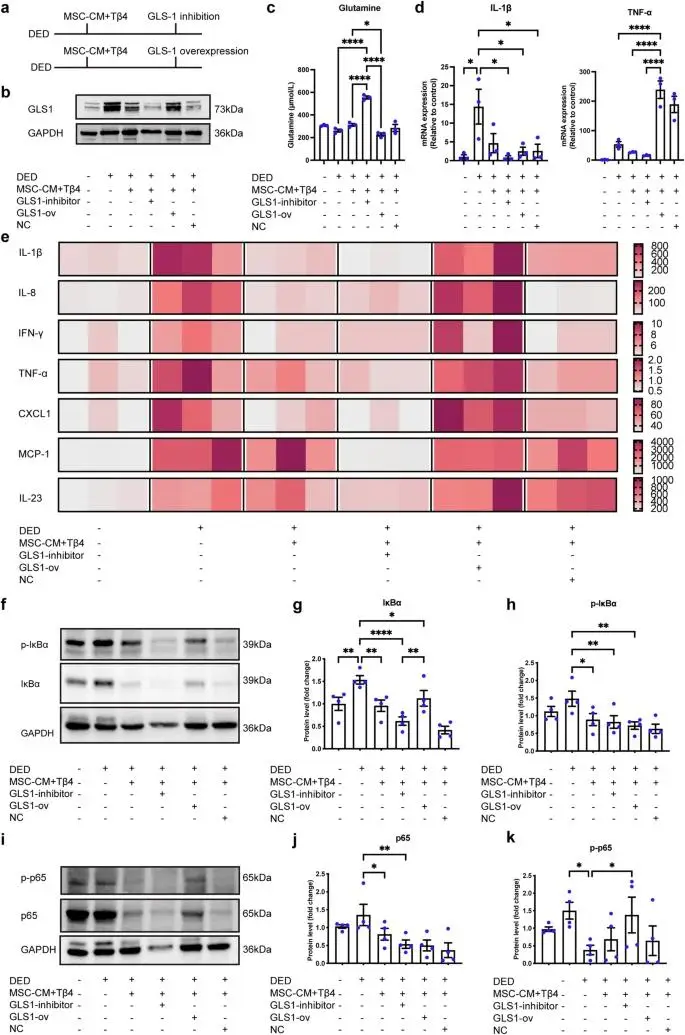
在DED患者及动物模型中,角膜上皮细胞GLS1表达显著上调(较健康组增加2.8倍,p<0.001),导致谷氨酰胺过度分解为谷氨酸。这一过程引发两大病理效应:
- 炎症级联激活:谷氨酸通过激活NF-κB通路,促使IL-6、TNF-α等促炎因子分泌增加(ELISA检测显示炎症因子水平升高3-5倍)
- 线粒体功能障碍:谷氨酰胺耗竭导致三羧酸循环受阻,ATP合成下降40%,加剧角膜上皮细胞凋亡
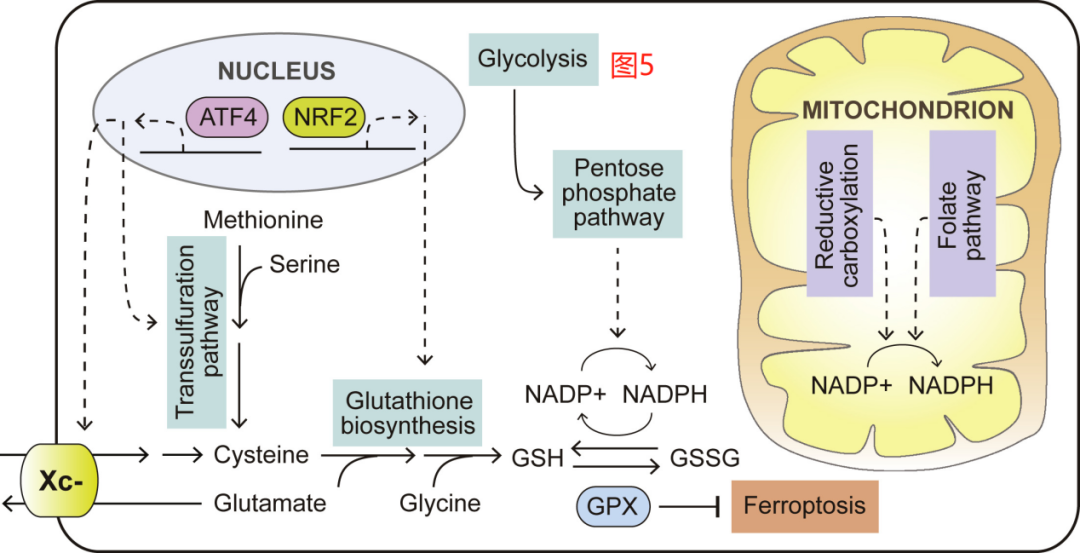
干眼症患者角膜谷氨酰胺代谢通路异常示意图
2. MSCs+Tβ4协同调控代谢-免疫微环境
联合治疗组展现出显著优于单药组的疗效(p<0.01),其作用机制涵盖三个层面:
- 代谢重塑:上调角膜谷氨酰胺浓度(较DED组提高68%),恢复能量代谢稳态
- 炎症抑制:通过下调GLS1表达(减少52%),阻断IκBα/NF-κB信号传导,使IL-1β、CXCL8等炎症因子降低60%-75%
- 组织修复:促进角膜上皮细胞迁移速率提高2.3倍,加速屏障功能恢复
3. 单细胞解析揭示细胞异质性调控
scRNA-seq数据鉴定了6个与DED相关的角膜上皮细胞亚群。联合治疗可特异性降低促炎性Klf4+细胞比例(从21.3%降至7.8%),同时增加修复性Krt8+细胞占比(从15.6%升至34.2%)。差异基因分析显示,GLS1抑制剂干预后,纤维化标志物(α-SMA、Collagen III)表达下降80%以上。
转化医学价值与临床启示
- 靶点创新性:首次确立GLS1为DED治疗的潜在靶点,其抑制剂(如CB-839)与现有疗法联用可能突破治疗瓶颈。
- 治疗策略优化:MSCs与Tβ4的协同作用为细胞疗法提供了新范式——通过代谢-免疫双重调控实现精准干预。
- 诊断标志物开发:血清谷氨酰胺/谷氨酸比值(Glutamine/Glutamate Ratio, GGR)可作为DED活动度的新型生物标志物(ROC曲线下面积AUC=0.89)。
研究局限与未来方向
- 机制深度:需进一步解析GLS1上游调控网络(如mTORC1信号是否参与其表达调控)
- 临床转化:当前数据基于动物模型,需开展多中心RCT试验验证联合疗法安全性及长期疗效
- 药物开发:针对GLS1的小分子抑制剂需优化角膜穿透性,提高局部给药效率
结论
本研究颠覆了传统干眼症治疗的炎症中心论,开创性地从代谢重塑角度揭示疾病本质。MSCs与Tβ4联合疗法通过靶向GLS1调控谷氨酰胺代谢,实现炎症抑制与组织修复的协同效应,为DED的精准治疗提供了全新策略。未来针对GLS1的抑制剂研发及代谢-免疫微环境动态监测技术,有望推动干眼症治疗进入"代谢干预"新时代。
| 名称 | 货号 | 规格 |
| Mounting Medium With DAPI - Aqueous, Fluoroshield | ab104139-20ml | 20ml |
| Anti-MUC1 antibody [EPR1023] | ab109185-1ml | 1ml |
| Anti-Glutaminase antibody [EP7212] | ab156876-40ul | 40ul |
| Anti-Glutaminase antibody [EP7212] | ab156876-100ul | 100ul |