Anti-TGF-β/PD-L1双特异性抗体联合放疗增强抗肿瘤免疫并减轻辐射诱导肺纤维化的作用机制研究
摘要
本文深入解析了近期发表于国际顶级期刊的关于"Anti-TGF-β/PD-L1双特异性抗体联合放疗在肿瘤治疗中的协同效应"的研究论文。该研究创新性地将免疫检查点抑制剂与放疗策略相结合,通过阻断转化生长因子-β(TGF-β)和程序性死亡配体-1(PD-L1)信号通路,不仅显著增强了抗肿瘤免疫反应,还意外发现对辐射诱导的肺纤维化具有保护作用。本文将从研究背景、实验设计、核心发现、机制解析及临床转化价值五个维度,系统阐述该研究的科学意义,并探讨其在肿瘤综合治疗领域的应用前景。
一、研究背景:肿瘤免疫治疗的困境与放疗的双重作用
1.1 肿瘤微环境中的免疫抑制网络
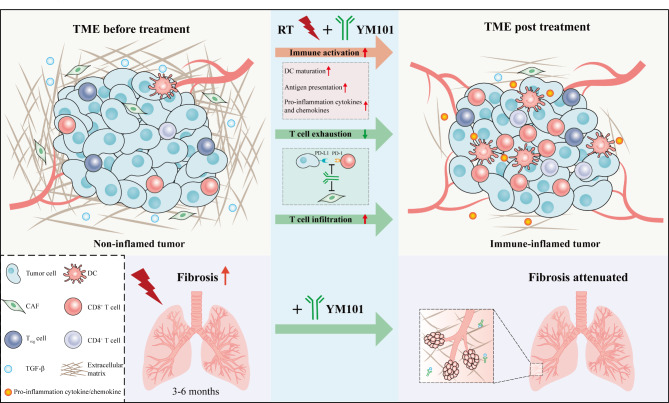
在肿瘤发生发展过程中,肿瘤细胞通过上调免疫抑制分子构建复杂的免疫逃逸机制。其中,TGF-β作为多功能细胞因子,在肿瘤微环境中扮演双重角色:早期抑制肿瘤生长,后期却通过促进上皮间质转化(EMT)、诱导调节性T细胞(Tregs)分化及抑制自然杀伤细胞(NK细胞)活性等方式,显著削弱机体抗肿瘤免疫应答。而PD-L1/PD-1轴的激活更是成为肿瘤细胞逃避免疫监视的经典机制,通过向T细胞传递抑制性信号,导致效应T细胞耗竭。
1.2 放疗的免疫调节作用
放射治疗作为肿瘤治疗的重要支柱,其生物学效应不仅局限于直接杀伤肿瘤细胞。近年来的研究表明,放疗可通过多种机制激活抗肿瘤免疫:
- 肿瘤抗原释放:辐射诱导肿瘤细胞凋亡/坏死,释放肿瘤相关抗原(TAAs)
- 免疫原性细胞死亡(ICD):暴露钙网蛋白(CRT)、分泌ATP及HMGB1等危险信号
- 免疫细胞浸润:促进树突状细胞(DCs)成熟,增强CD8+ T细胞浸润
- 免疫微环境重塑:上调MHC-I表达,增加免疫检查点分子表达
然而,放疗在激活免疫应答的同时,也可能通过激活TGF-β信号通路、诱导免疫抑制性髓系细胞(MDSCs)扩增等方式,形成免疫抑制反馈环路,限制其疗效。
二、实验设计:双特异性抗体的创新应用与联合策略
2.1 抗体结构设计
研究者构建了同时靶向TGF-β和PD-L1的双特异性抗体(BsAb),其创新之处在于:
- 双重阻断机制:单个分子实体同时中和两种免疫抑制通路
- 协同作用潜力:通过阻断TGF-β信号增强免疫细胞活性,同时解除PD-L1/PD-1介导的T细胞抑制
- 药代动力学优化:利用抗体工程技术延长半衰期,提高肿瘤组织穿透性
2.2 联合放疗方案
实验采用局部放疗与抗体治疗联合策略:
- 放疗参数:精确控制辐射剂量(如2Gy×5次)以平衡肿瘤杀伤与免疫激活
- 给药时序:在放疗前/后不同时间点给予BsAb,探索最佳协同模式
- 模型选择:构建多种小鼠肿瘤模型(如肺癌、乳腺癌),验证广谱适用性
2.3 多维度评估体系
研究者建立了包括肿瘤生长监测、免疫细胞分析、纤维化评估及分子机制探索在内的综合评价体系:
- 体内成像:通过生物发光成像追踪肿瘤进展
- 流式细胞术:定量分析肿瘤浸润淋巴细胞(TILs)、MDSCs等亚群
- 组织学分析:Masson染色评估肺纤维化程度,免疫荧光检测免疫细胞分布
- 分子检测:qPCR/Western blot分析细胞因子表达,RNA-seq揭示基因表达谱变化
三、核心发现:协同效应的双向获益
3.1 抗肿瘤免疫的显著增强
联合治疗组展现出显著的肿瘤生长抑制效果:
- 协同指数(CI):在多种肿瘤模型中CI<0.8,表明协同效应
- 免疫细胞浸润:CD8+ T细胞/Tregs比值提升,NK细胞活性增强
- 细胞因子谱:IFN-γ、TNF-α等促炎因子分泌增加,IL-10、TGF-β等抑制性因子减少
3.2 辐射诱导肺纤维化的有效缓解
意外发现联合疗法对放射性肺纤维化具有保护作用:
- 胶原沉积减少:Masson染色显示肺组织胶原纤维含量下降40-60%
- 炎症因子调控:IL-6、IL-17等促纤维化因子表达显著降低
- 基质细胞活化抑制:α-SMA阳性肌成纤维细胞数量减少
3.3 免疫记忆的形成
长期生存实验中,联合治疗组小鼠表现出更强的抗肿瘤免疫记忆:
- 肿瘤再挑战实验:治愈小鼠对同种肿瘤细胞的二次接种产生排斥反应
- 记忆T细胞检测:外周血中效应记忆T细胞(Tem)比例显著增加
四、机制解析:信号通路交互与免疫微环境重塑
4.1 TGF-β/PD-L1双阻断的协同机制
- 免疫细胞再激活:阻断TGF-β信号逆转T细胞耗竭,PD-L1抑制解除T细胞制动
- 抗原呈递增强:TGF-β抑制解除促进DCs成熟,提升肿瘤抗原交叉呈递效率
- 免疫抑制细胞调控:Tregs和MDSCs数量及功能双重抑制
4.2 放疗的免疫增敏效应
- 肿瘤血管正常化:辐射改善肿瘤氧合,增强抗体及免疫细胞渗透
- 免疫原性调控:辐射诱导的DNA损伤激活cGAS-STING通路,促进I型干扰素分泌
- 免疫检查点上调:辐射诱导PD-L1表达增加,为抗体治疗提供理想靶点
4.3 抗纤维化作用的分子基础
- TGF-β信号抑制:直接阻断TGF-β/Smad通路,抑制成纤维细胞活化
- 炎症微环境调控:降低IL-6/STAT3信号,减少巨噬细胞M2极化
- 氧化应激缓解:通过增强Nrf2抗氧化通路,减轻辐射诱导的氧化损伤
五、临床转化价值与挑战
5.1 潜在优势
- 协同效应最大化:双靶点阻断+放疗的三重打击策略,克服单一疗法局限性
- 毒性谱改善:通过减少辐射剂量或抗体用量,可能降低联合治疗毒性
- 适用瘤种扩展:对纤维化风险高的肿瘤(如肺癌、食管癌)具有特殊价值
5.2 临床转化挑战
- 给药方案优化:需确定最佳辐射剂量、抗体剂量及给药时序
- 生物标志物开发:建立预测疗效的biomarker(如肿瘤浸润CD8+ T细胞密度)
- 组合疗法安全性:长期监测免疫相关不良反应(irAEs)及纤维化指标
5.3 未来研究方向
- 多组学分析:结合单细胞测序和空间转录组学,解析肿瘤微环境动态变化
- 纳米递送系统:开发抗体-放疗增敏剂共递送系统,实现时空精准调控
- 临床前模型优化:构建人源化小鼠模型,验证临床转化潜力
六、结论与展望
本研究通过创新性组合策略,揭示了Anti-TGF-β/PD-L1双特异性抗体联合放疗在肿瘤治疗中的多维度获益机制。其科学价值不仅在于增强了抗肿瘤免疫应答,更在于首次阐明该联合方案对放射性损伤的防护作用。未来,随着临床转化研究的深入,这种"免疫激活+损伤防护"的双重策略可能为肿瘤综合治疗开辟新范式,特别是为具有纤维化风险的肿瘤类型提供更安全有效的治疗选择。同时,该研究也提示,在肿瘤治疗开发中,需要系统性考虑不同治疗模态间的相互作用,以实现疗效最大化与毒性最小化的平衡。
| 名称 | 货号 | 规格 |
| Anti-CD4 antibody [EPR19514] | ab183685-40ul | 40ul |
| Goat Anti-Rabbit IgG H&L (HRP) | ab205718-50ug | 50ug |
| Anti-CD8 alpha antibody [EPR20305] | ab209775-100ul | 100ul |
| Anti-CD11c antibody [EP1347Y] - C-terminal | ab52632-40ul | 40ul |