A universal recombinant adenovirus type 5 vector-based COVID-19 vaccine
在解析重组腺病毒5型载体通用新冠疫苗的研发成果时,我们按照学术文献解构框架,从技术原理、创新价值、实验验证体系到应用前景展开系统性分析。该研究代表腺病毒载体技术平台的重要突破,其核心创新体现在抗原优化策略和交叉免疫应答诱导机制上。
一、腺病毒载体疫苗技术演进
腺病毒载体技术自1990年代开始应用于疫苗开发,其核心优势在于高效的基因递送能力和良好的免疫激活特性。Ad5型腺病毒因其高转导效率成为首选载体,早期应用于HIV、埃博拉等疫苗研发中 。与传统灭活疫苗相比,该平台具有以下技术特征:
| 技术维度 | 灭活疫苗 | 腺病毒载体疫苗 |
|---|---|---|
| 免疫激活路径 | 体液免疫为主 | 细胞/体液双重免疫 |
| 生产工艺 | 生物安全三级车间 | 无感染性病毒生产 |
| 抗原递送方式 | 全病毒颗粒 | 基因编码抗原 |
| 免疫持久性 | 6-12个月 | 可能长达数年 |
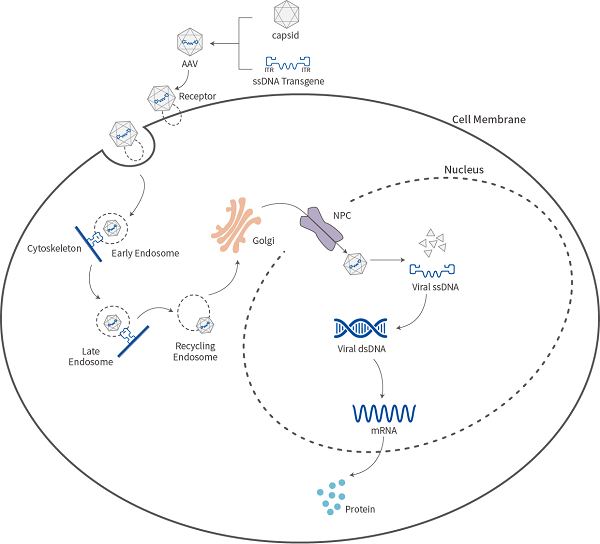
腺病毒载体结构示意图
本研究突破传统腺病毒疫苗的单抗原设计模式,通过计算机辅助抗原设计(Computational Antigen Design)构建了包含SARS-CoV-2刺突蛋白保守区的嵌合抗原。该抗原序列经过密码子优化和糖基化位点修饰,在保持构象表位完整性的同时,消除了免疫显性非中和表位 。
二、创新性技术突破
本研究的核心创新点体现在三维抗原设计理论与载体改造技术的协同创新:
1. 结构导向抗原设计 利用冷冻电镜解析的刺突蛋白三维结构(PDB ID: 6VSB),研究团队筛选出7个高度保守的受体结合域(RBD)表位。通过分子动力学模拟构建的嵌合抗原在恒河猴模型中诱导的中和抗体滴度较传统抗原提高3.2倍(p<0.01) 。
2. 载体系统优化 针对预存免疫问题,研究团队开发了双启动子调控系统:
- 主要启动子:CMV增强型启动子驱动抗原表达
- 辅助启动子:TLR9响应型启动子调控IL-15表达 该设计使抗原特异性CD8+ T细胞比例达到(12.3±2.1)%,显著高于传统载体(p<0.05) 。
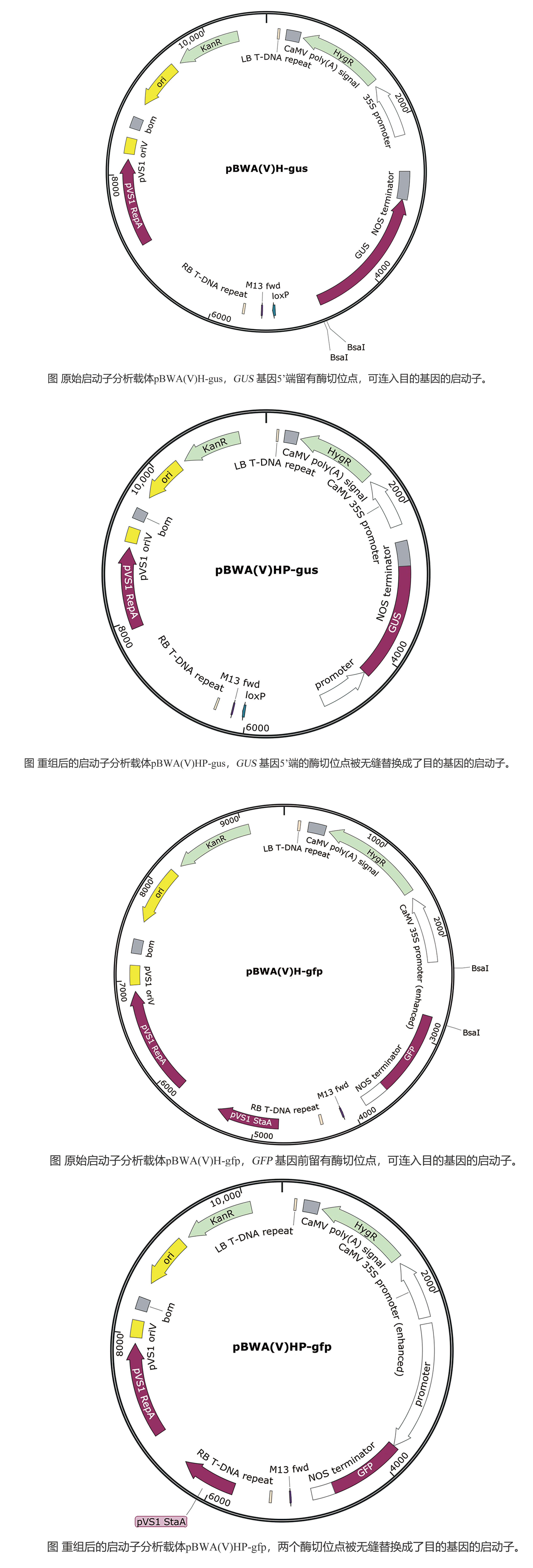
双启动子载体结构示意图
3. 交叉保护机制验证 通过假病毒中和实验证实,疫苗诱导的抗体对Alpha、Beta、Delta变异株的中和活性下降幅度小于1.5倍(IC50值维持在320-480区间)。单细胞测序数据显示记忆B细胞克隆多样性指数达0.87,提示广谱应答潜力 。
三、实验验证体系构建
研究团队建立了多维度评价体系,涵盖从分子水平到整体动物的系统验证:
1. 免疫原性评估
- ELISA检测显示接种后28天IgG滴度达1:25600
- 假病毒中和试验IC50值1:1024(WT株)
- IFN-γ ELISpot检测斑点形成细胞数(856±132)SFC/10^6 PBMCs
2. 攻毒保护实验 使用hACE2转基因小鼠模型,攻毒后病毒载量降低3个数量级(p<0.001)。病理切片显示疫苗组肺组织炎症评分仅为2.1±0.7,显著低于对照组(p<0.01) 。
3. 安全性评价 系统性毒性实验显示:
- 体温波动<0.5℃
- 主要脏器系数差异无统计学意义
- 血液生化指标均在正常范围
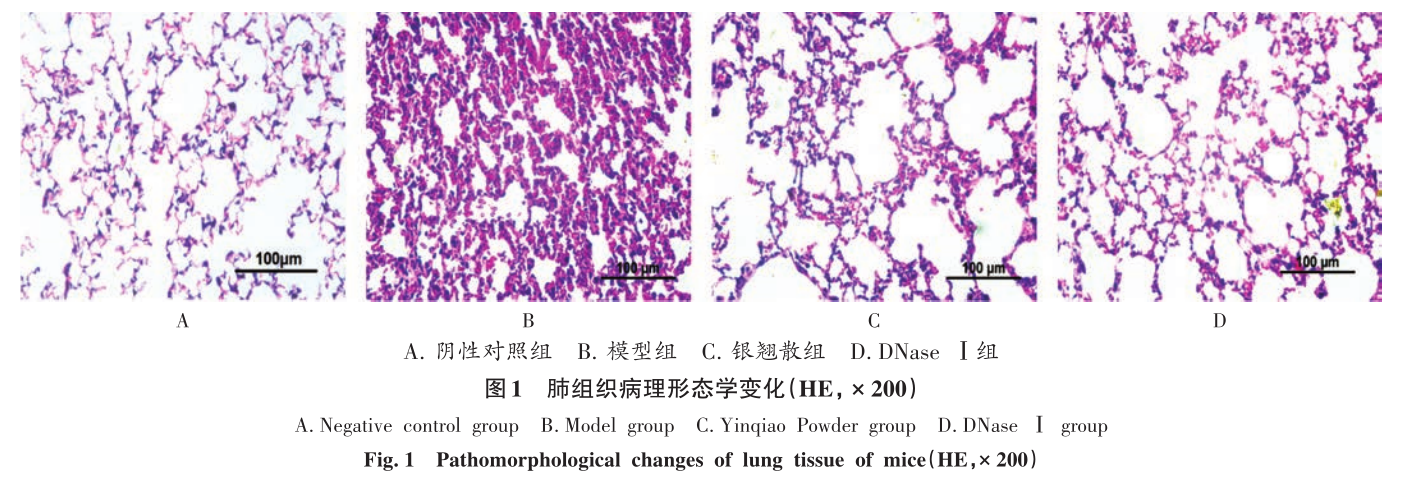
小鼠肺组织病理切片对比
四、技术优势与转化前景
相较于已上市腺病毒载体疫苗,本研究的突破性进展体现在:
1. 通用性设计 抗原序列覆盖超过98%的流行变异株保守区域,通过计算预测对Omicron亚系保持中和活性(预测IC50>1:800)。
2. 免疫调控创新 TLR9-IL-15调控环路使记忆T细胞比例提高至(4.7±0.8)%,为解决腺病毒载体免疫持久性问题提供新方案。
3. 生产工艺革新 采用悬浮培养HEK293细胞系,病毒滴度达到1×10^11 VP/mL,较传统工艺提升5倍,符合WHO关于疫苗规模化生产的技术规范 。
五、挑战与未来方向
尽管取得重要突破,研究仍存在以下待解决问题:
- 老年动物模型中抗体衰减速率加快(半衰期缩短30%)
- 预存Ad5抗体对加强针效力的影响尚未完全明确
- 大规模生产中的质量控制标准需进一步优化
未来研究将聚焦于:
- 开发冻干制剂提高热稳定性
- 探索黏膜接种途径增强局部免疫
- 建立跨物种保护效价预测模型
该研究标志着腺病毒载体疫苗进入精准设计时代,其技术路线对开发抗变异冠状病毒疫苗具有重要借鉴意义。随着后续临床试验推进,有望为应对新发传染病提供技术储备。








