小动物活体成像技术
小动物活体成像全流程详解
小动物活体成像技术体系涵盖光学成像、核磁共振成像(MRI)、放射性核素成像、超声成像及计算机断层扫描(CT)等多种模态。其中,光学成像作为主流技术手段,主要依托生物发光成像(Bioluminescence Imaging, BLI)与荧光成像(Fluorescence Imaging, FLI)两大技术路径实现活体层面生物学过程的可视化监测。
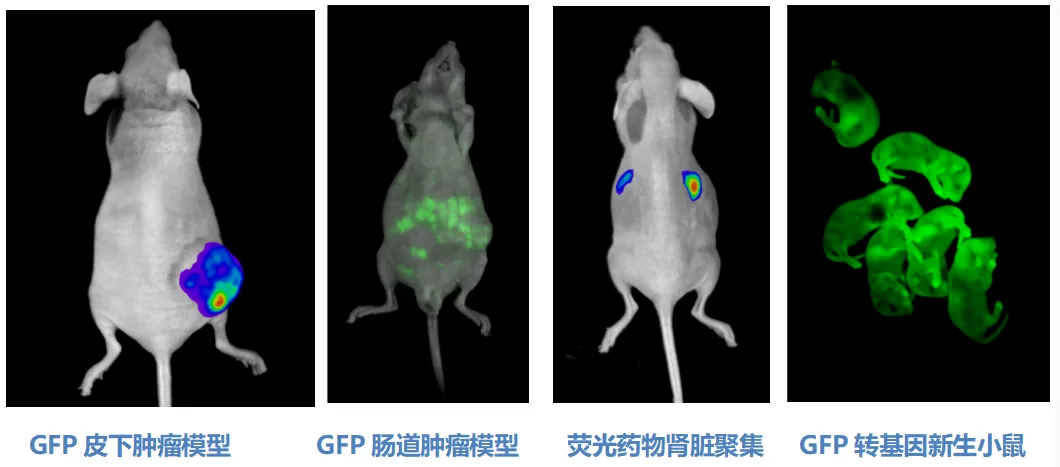
生物发光成像技术基于荧光素酶(Luciferase)催化底物氧化反应产生的光信号。通过慢病毒载体或CRISPR/Cas9基因编辑系统,可将荧光素酶报告基因(如萤火虫荧光素酶基因Luc或海肾荧光素酶基因Rluc)稳定整合至靶细胞基因组,构建持续表达荧光素酶的工程化细胞系。该体系具有背景信号低、检测灵敏度高(可达10²-10³细胞检测限)及定量准确性强的特点,其发光强度与活细胞数量呈严格正相关(R²>0.98),适用于肿瘤增殖、干细胞归巢及免疫细胞动态监测等研究领域。
荧光成像则通过外源性荧光染料或基因编码荧光蛋白(如GFP、RFP)对靶细胞或生物分子进行特异性标记,利用不同波长激发光/发射光组合实现多通道成像。尽管该技术具有操作简便、无创实时监测等优势,但其检测深度受限(通常<2 cm),且易受组织自发荧光及光子散射干扰。
近年来,生物发光成像技术因其独特的生物学相关性及定量优势,在小动物活体成像领域获得广泛应用。相较于荧光成像,BLI技术无需外源激发光即可自发产生光信号,显著降低光毒性及组织损伤风险,同时其信号半衰期(通常10-30分钟)与酶促反应动力学高度适配,可精准反映靶细胞或分子的实时生物学行为。
| 指标 | 生物发光 | 荧光发光 |
|---|---|---|
| 成像模式 | 生物发光 | 荧光发光 |
| 发光原理 | 酶与底物结合,自发光,不需要激发 | 发光基团受激发,产生荧光发光,需要激发 |
| 标记对象 | 细胞、病毒、细菌、转基因动物 | 细胞、病毒、细菌、转基因动物、药物分子 |
| 背景信号 | 弱,信噪比高 | 强,信噪比低 |
| 灵敏度 | 高 | 低于生物发光 |
| 定量 | 发光强度与检测目标有良好的线性关系,可进行准确定量 | 发光强度与检测目标线性关系不明确,常用于定性检查 |
| 操作方法 | 复杂,需要转基因操作 | 简单,可转基因或者直接标记细胞膜 |
| 实验周期 | 基于灵敏度高的特点,更适合长期的疾病追踪和深层脏器观察 | 更多灵活的标记探针可选,更适合瞬时观测实验 |
| 应用范围 | 如肿瘤的长期跟踪和药物药效评估,转移瘤分布,内源性分子靶标物监测,治疗性细胞的长期追踪和活性评估等 | 如药物、细胞在体内的分布、靶向和代谢,疾病标记物的靶向监测等 |
生物发光成像的技术优势
1. 无激发光依赖性背景干扰
生物发光成像基于荧光素酶催化底物氧化反应产生自发光信号,无需外源性激发光源,从而规避了荧光成像中因激发光穿透组织引发的非特异性散射信号及组织自发荧光干扰。该特性显著提升了检测信噪比(SNR),尤其适用于深部组织或高背景噪声环境下的信号解析。
2. 实验动物处理流程简化
相较于荧光成像需通过剃毛或禁食等预处理步骤以消除毛发及饲料中荧光物质的干扰,生物发光成像因无激发光需求,可完全省略此类操作。这不仅简化了实验流程,还减少了动物应激反应,符合动物实验伦理学中的“3R原则”(替代、减少、优化)。
3. 检测灵敏度优势
生物发光成像的检测下限可达数百个细胞级别,较传统荧光成像灵敏度提升1-2个数量级。其信号强度与活细胞数量呈严格线性相关(R²>0.98),支持对肿瘤微转移灶、干细胞归巢等低丰度生物学事件的精准捕获。
4. 深部组织穿透能力
得益于高信噪比及低光子散射特性,生物发光成像可实现3-4 cm检测深度,适用于小鼠等小动物模型的全身成像及深部脏器(如肝脏、肺部)病变监测。该优势在肿瘤转移研究及药物动力学分析中具有重要应用价值。
5. 定量分析能力
生物发光信号强度与靶细胞数量之间存在明确的剂量效应关系,通过标准曲线法可实现绝对定量分析。而荧光成像信号易受探针浓度、组织光吸收及仪器参数波动等多因素影响,通常仅适用于半定量或相对定量研究。

生物发光活体成像实验流程
1. 荧光素酶类型选择
常用荧光素酶包括萤火虫荧光素酶(Firefly luciferase, Fluc)、海肾荧光素酶(Renilla luciferase, Rluc)及Gaussia荧光素酶。三类酶均通过催化特异性底物(如D-荧光素、腔肠素)发生氧化脱羧反应产生生物发光信号,且该过程无需外源性激发光源。其中,Fluc因具有高量子产率(0.88)、低背景干扰及成熟的商业化底物体系,成为活体成像领域应用最广泛的报告基因。本研究以Fluc为例,系统阐述其在活体成像实验中的操作规范与技术要点。
2. 稳定表达荧光素酶的细胞株构建
活体成像实验的核心需求是实现对靶细胞(如肿瘤细胞)在体内的动态追踪,这要求构建稳定表达荧光素酶的工程化细胞系。具体步骤包括:
- 载体设计与转染:将携带Fluc基因及强启动子(如CMV启动子)的表达载体,通过脂质体转染、电穿孔法或病毒载体系统(如慢病毒)导入目标细胞。
- 抗性筛选与克隆筛选:载体需携带筛选标记基因(如新霉素抗性基因Neo),通过G418等抗生素压力筛选获得阳性克隆池。进一步采用有限稀释法进行单克隆化培养,以获取遗传背景均一的稳转细胞株。
- 表达验证与优化:通过荧光素酶活性检测及Western blot验证蛋白表达水平,必要时可通过基因扩增策略(如使用DHFR基因扩增系统)提升荧光素酶表达量,以满足活体成像的信号强度需求。
3. 稳转细胞株的体外功能验证
为确保荧光素酶稳转细胞株的生物学功能,需通过体外实验验证其发光效能。具体操作如下:
3.1 细胞梯度稀释与接种
将处于对数生长期的Fluc稳转细胞株进行酶解消化,利用完全培养基制备梯度浓度系列(如1×10⁵、1×10⁴、1×10³细胞/mL),按100 μL/孔接种于96孔板,每个浓度设置3个技术重复。
3.2 生物发光信号检测
检测方法可选用以下两种方案:
3.2.1 直接底物孵育法
- 底物配制:以无钙镁离子DPBS(或PBS)为溶剂,制备15 mg/mL D-荧光素钾盐(D-Luciferin, potassium salt)储存液,经0.22 μm无菌滤膜过滤除菌后分装保存。
- 信号采集:吸除孔内培养基,加入含150 μg/mL D-荧光素钾盐的反应液,于37℃避光孵育3-5分钟以完成酶促反应平衡。随后使用小动物活体成像系统(如IVIS Spectrum)进行信号采集,设置曝光时间1-5分钟,记录各孔的辐射度(photons/sec/cm²/sr)。
3.2.2 裂解液检测法
采用商业化荧光素酶报告基因检测试剂盒,通过细胞裂解液释放胞内荧光素酶,与底物充分反应后测定化学发光值。该方法因消除细胞膜屏障效应,信号强度通常较活细胞直接检测法提升10-100倍,但无法反映活细胞动态代谢过程。
关键注意事项
- 底物选择:优先选用D-荧光素钾盐进行活体成像实验,其水溶性优异(>50 mg/mL),且文献报道案例丰富,便于实验结果比对。
- 离子环境控制:钙镁离子(Ca²⁺/Mg²⁺)可通过螯合作用抑制荧光素酶活性,故底物配制需严格使用无钙镁离子缓冲液。若仅能获取含钙镁离子的DPBS/PBS,建议通过Chelex-100树脂进行螯合处理后再行使用。
4. 稳转细胞株的体内移植模型构建
成功构建荧光素酶稳转细胞株后,需通过体内移植模型实现活体层面的生物学过程追踪。以下以小鼠为模式动物,系统阐述实验操作规范与技术要点:
4.1 实验动物准备与细胞悬液制备
- 细胞悬液配制:收集处于对数生长期的Fluc稳转细胞株,经无菌PBS洗涤后,用预冷基础培养基或PBS重悬至目标浓度(如1×10⁷ cells/mL)。细胞悬液需置于冰浴或4℃环境保存,并于1小时内完成注射操作,以维持细胞活性。
- 动物麻醉(可选):根据注射方式选择是否实施麻醉。常用麻醉方案包括腹腔注射戊巴比妥钠(50 mg/kg)、氯胺酮(100 mg/kg)+赛拉嗪(10 mg/kg)混合液,或异氟烷气体吸入麻醉。麻醉前需精确称量动物体重,并依据体重计算给药剂量,避免过量导致呼吸抑制。
4.2 细胞移植与注射技术
- 注射操作:使用1 mL胰岛素注射器吸取细胞悬液,按预设方案实施移植。常见注射途径包括:
- 皮下注射:于实验动物背侧或腹股沟区域进针,回抽无回血后注入细胞。
- 尾静脉注射:将动物固定于尾静脉注射装置,用45-50℃温水浸泡尾部1-2分钟以扩张静脉,于距尾尖1/3处侧静脉进针,确认回血后缓慢推注。
构建动物模型的关键技术要点
• 细胞状态控制
需严格选用对数生长期细胞进行移植,此阶段细胞代谢活跃、增殖能力强,可显著提升移植成功率。鉴于不同细胞系的成瘤潜能存在显著差异(如高转移性细胞系4T1与低免疫原性细胞系B16-F10),需通过文献调研确定最佳接种量(通常范围为1×10⁵至1×10⁷ cells/动物)。对于皮下移植模型,建议于细胞悬液中添加基质胶(Matrigel,终浓度10-30%),其三维网状结构可模拟细胞外基质,促进血管生成与肿瘤块形成。
• 实验动物品系筛选
- 同种移植模型:需采用与肿瘤细胞遗传背景完全一致的近交系小鼠(如C57BL/6来源的LLC细胞移植至C57BL/6小鼠),以避免同种异体移植排斥反应。
- 异种移植模型:必须选用重度免疫缺陷小鼠(如NOD/SCIDγ或NSG品系),其缺乏T细胞、B细胞及NK细胞功能,可耐受人源肿瘤细胞的异种移植。
- 动物周龄与体重管理:推荐选用6-8周龄(体重18-22 g)动物,此阶段小鼠免疫系统发育成熟且耐受性良好。若异种移植成瘤困难,可尝试降低至4-6周龄,但需注意幼龄动物对麻醉及手术操作的耐受性下降。
• 麻醉期生理指标监控
麻醉前必须精确称量动物体重,并依据药代动力学参数计算麻醉剂量(如戊巴比妥钠腹腔注射剂量为50 mg/kg)。过量给药可能导致呼吸抑制甚至死亡,而剂量不足则引发术中觉醒。麻醉期间需持续监测生命体征,包括呼吸频率(80-120次/分)、心率(300-500次/分)及肛温(维持36.5-37.5℃)。可通过恒温加热垫或红外保温灯预防低体温症,避免低温导致的麻醉苏醒延迟及代谢紊乱。
• 注射技术规范化操作
- 皮下注射:于背侧或腹股沟区域进行,需垂直皮肤进针至皮下疏松结缔组织层,回抽无回血后缓慢推注。
- 尾静脉注射:采用45-50℃温水浸泡尾部1-2分钟以扩张静脉,使用专用尾静脉注射装置固定动物。进针点选择距尾尖1/3处侧静脉,与尾部呈15-20°角进针,确认回血后以0.1 mL/min速度推注。
- 腹腔注射:于下腹部中线旁开1 cm处进针,避开膀胱及肠道,回抽无肠液或尿液后注入药液。
以上操作需严格遵循无菌原则,注射后需观察动物行为学变化及注射部位反应,及时处理可能出现的并发症(如血肿、感染或药液外渗)。
5. 荧光素酶底物注射规范
移植细胞经2-3周增殖后可形成可检测的肿瘤块(具体周期取决于细胞系倍增时间、接种量及宿主微环境)。实验干预(如药物给药)需根据研究目的在此阶段实施。成像前需严格遵循以下底物给药方案:
- 剂量学优化:推荐采用150 mg/kg D-荧光素钾盐(D-Luciferin potassium salt)进行腹腔注射(i.p.)。以20 g小鼠为例,需注射200 μL 15 mg/mL储存液(即10 μL/g体重)。该剂量可确保肿瘤组织内底物浓度达到酶促反应饱和状态(>50 μM),同时避免过量导致的非特异性背景信号。
- 注射方式选择:除腹腔注射外,可根据研究需求选用尾静脉注射(实现快速全身分布)或皮下注射(适用于浅表肿瘤模型)。
- 信号采集时相控制:腹腔注射后需经10-15分钟等待期,此阶段底物通过门静脉系统吸收并分布至肿瘤组织,荧光素酶催化反应达到动态平衡(Vmax阶段),此时信号强度与细胞数量呈最佳线性相关(R²>0.95)。
6. 活体生物发光成像技术要点
活体成像需在配备专业麻醉系统的封闭式小动物光学成像系统(如IVIS Spectrum CT、PhotonImager)内完成,该类设备具有以下技术优势:
- 多模态成像能力:集成生物发光、荧光及X射线断层扫描模块,可实现肿瘤定位与解剖结构的三维融合成像。
- 高灵敏度检测:配备背照式制冷CCD相机,可在5分钟内检测低至100个肿瘤细胞发出的光子信号。
- 光谱分离技术:通过滤光片组(500-650 nm)区分不同荧光素酶信号,避免光谱串扰。
成像操作需严格遵循以下规范:
- 麻醉深度控制:采用异氟烷气体麻醉(1.5-2.0%挥发浓度),通过鼻锥持续供氧以维持手术麻醉平面(Ⅲ期)。需避免使用注射麻醉剂,因其可能抑制呼吸中枢并干扰药代动力学研究。
- 体位固定与保温:使用专用动物托盘配合胶带固定动物,通过恒温控制板维持肛温37℃。需确保肿瘤部位与成像镜头保持15 cm最佳工作距离。
- 信号采集参数设置:根据荧光素酶光谱特性选择560 nm发射滤光片,设置曝光时间1-5分钟(自动增益模式),binning值设为4以平衡信噪比与空间分辨率。
成像过程中需持续监测动物生命体征,若出现呼吸频率异常(>120次/分或<60次/分)或体动反射,需立即终止实验并实施复苏操作。

| 名称 | 货号 | 规格 |
| D-荧光素钾盐 | abs42075819-1g | 1g |
| D-荧光素钾盐 | abs42075819-25mg | 25mg |
| D-Luciferin | abs816138-50mg | 50mg |
| DiR 碘化物 | abs45153692-25mg | 25mg |







