电泳技术
一、电泳基本原理
电泳(Electrophoresis, EP)是一种基于带电颗粒在电场作用下定向迁移的分析技术。当带电粒子置于电场中时,会受到电场力的作用,进而向着与其电性相反的电极移动。这种移动现象的发生源于粒子所带电荷与电场之间的相互作用。粒子的电泳迁移速率受多种因素影响,包括粒子自身的电荷性质、大小和形状,以及电场强度、介质的黏度和离子强度等。通常,粒子的电荷量越大、半径越小,在电场中的迁移速度就越快;而电场强度的增加也会相应提高粒子的电泳速度。介质的黏度和离子强度则与电泳迁移速率呈反比关系,介质黏度越大、离子强度越高,对粒子迁移的阻力就越大,导致迁移速度降低。
二、电泳技术的发展与应用
电泳技术自 20 世纪 30 年代诞生以来,经过几十年的发展,现已成为生物化学、分子生物学、临床检验等众多学科领域中不可或缺的分析工具。尤其是核酸电泳技术的广泛应用,为核酸研究开辟了新的途径。核酸电泳是核酸研究中的关键技术手段之一,在核酸探针、核酸扩增以及序列分析等技术流程中扮演着不可或缺的角色。其主要作用体现在对核酸样品的分离、纯化以及分析方面,能够为后续的实验操作提供准确、可靠的核酸片段信息。
三、核酸电泳的凝胶介质
核酸电泳通常在琼脂糖凝胶或聚丙烯酰胺凝胶中进行,这两种凝胶介质凭借其独特的物理和化学性质,为核酸片段的分离提供了理想的介质环境。琼脂糖凝胶具有操作简便、成本低、分辨率较高等优点,适用于分离较大分子量范围的核酸片段。不同浓度的琼脂糖凝胶能够形成不同大小的分子筛网孔。一般而言,琼脂糖浓度较低时,网孔较大,适合分离较大分子量的核酸片段;而随着琼脂糖浓度的增加,网孔逐渐缩小,对较小分子量核酸片段的分离效果更佳。聚丙烯酰胺凝胶则具有更高的分辨率,能够分离分子量极为接近的核酸片段,常用于对小分子量核酸片段的精确分析,如 DNA 测序等。通过调整聚丙烯酰胺的浓度以及交联度,可以精确控制凝胶的孔径大小,以满足不同实验需求。总之,核酸电泳借助琼脂糖凝胶或聚丙烯酰胺凝胶的分子筛作用,实现了对不同分子量核酸片段的有效分离,为核酸研究提供了有力的技术支持。
电泳原理:DNA 分离的奥秘
电泳技术在生物分子分离领域占据着举足轻重的地位,而 DNA 分子在琼脂糖凝胶中的泳动行为则是理解核酸电泳的关键。整个过程主要受两种效应的支配,即电荷效应和分子筛效应。
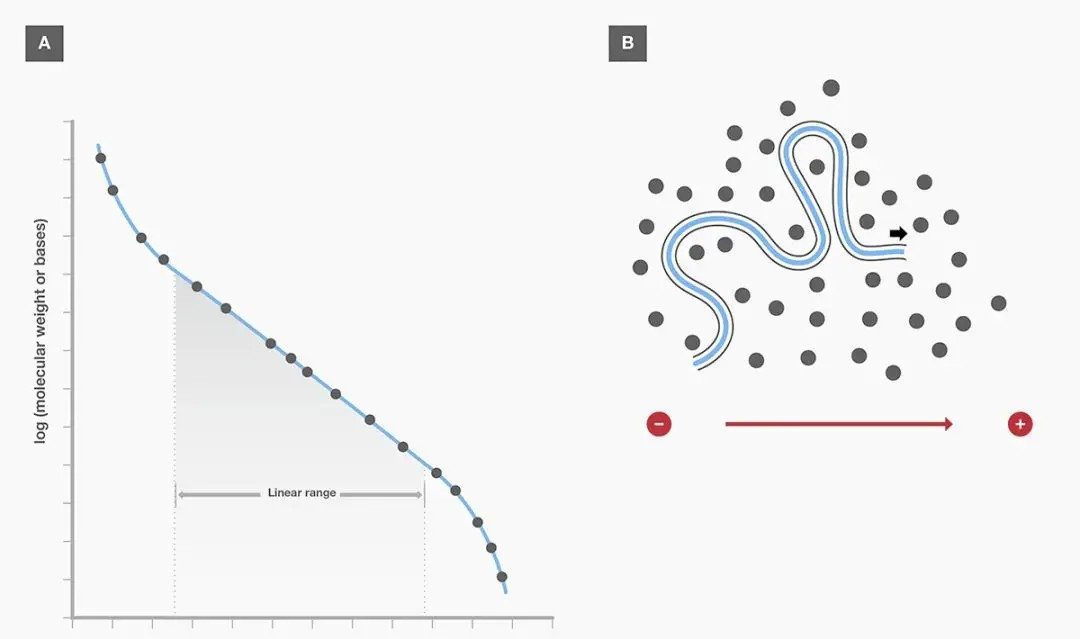
DNA 分子蕴含着丰富的负电荷,其源自于磷酸基团。在高于 DNA 等电点的 pH 环境下,DNA 分子的氨基被转化为离子化状态,使得 DNA 分子整体带有负电荷。在电场的驱动下,这些带负电荷的 DNA 分子犹如受到磁石的吸引,向着正极的方向进发。有趣的是,双链 DNA 分子的糖 - 磷酸骨架呈现出一种规律的重复模式,这就导致相同数量的双链 DNA 分子几乎携带等量的净电荷。因此,在相同的电场条件下,这些 DNA 分子能够以近乎相同的速度向正极移动,展现出一种高度有序的迁移行为。
然而,DNA 分子的迁移并非一帆风顺,它们需要在琼脂糖凝胶构建的复杂网络结构中穿行。琼脂糖凝胶是由琼脂糖分子相互连接形成的三维网状结构,分子量较大的物质在通过时,会受到较大的阻力。这就使得在凝胶电泳过程中,带电颗粒的分离不仅取决于净电荷的性质和数量,还受到分子大小的显著影响。具体来说,较小的分子能够更加轻松地穿梭于凝胶的孔隙之中,因此迁移速度相对较快;而较大的分子则因受到较大的阻力,迁移速度较为缓慢。基于这一原理,琼脂糖凝胶电泳成为分离不同分子量核酸片段的强大工具。
电泳技术在生物分子研究领域有着不可替代的作用。它不仅能够将复杂的生物样品中的不同成分分离开来,还能为后续的分子生物学研究提供关键的技术支持。例如,通过琼脂糖凝胶电泳,我们可以对 DNA 片段进行分离、纯化和鉴定,进而开展基因克隆、基因表达调控等研究。此外,电泳技术还在生物制药、法医学等领域有着广泛的应用,为生物医学的发展做出了重要贡献。
降维叙述
在阐述核酸电泳过程中不同分子量核酸片段的分离机制时,我们可以进行降维思考,将复杂的现象简化为生活中的类比,以便更直观地理解。
在琼脂糖凝胶电泳中,不同分子量的核酸片段可以类比为体型各异的人。这些“人”都带有相同的净电荷,这就如同他们在起跑线上都具备相同的初始动力,在没有障碍的理想状态下,他们会以相同的速度冲向终点,即正极。
然而,现实情况是这些“人”需要穿越琼脂糖凝胶构成的复杂网络结构,这就好比是一片充满障碍物的跑道。在这种情况下,体型较小(对应分子量较小)的“人”,也就是小片段核酸,由于其体积的先天优势,能够更轻松地在障碍物之间穿梭,就像瘦子在狭窄的缝隙中也能灵活穿行。相比之下,体型较大(对应分子量较大)的“人”,也就是大片段核酸,在穿越障碍物时会受到较大的阻力,就像胖子在同样的缝隙中会行动迟缓,甚至被卡住,导致其前进速度明显减慢。
于是,在电场的驱动下,不同体型的“人”开始以不同的速度向正极迁移,最终按照体型从小到大的顺序依次到达终点,形成有序的分离。
为了将这种分离现象应用于实际的分子量估算,我们可以安排一场特殊的“障碍跑步比赛”。参赛者是预先称好体重(对应已知分子量)的人,他们在同样的琼脂糖凝胶“跑道”上奔跑。通过记录每个人到达终点的时间,我们可以建立一个迁移率与体重(分子量)之间的关系模型。这个模型就像一把标尺,能够帮助我们对未知分子量的核酸片段进行估算。
当我们在电泳实验中观察到未知核酸片段的迁移位置时,可以将其与已知分子量标准品(即“称好体重的人”)的迁移位置进行对比。根据它们相对迁移率的差异,利用之前建立的模型,就能推算出未知核酸片段的大致分子量范围。这个过程就像是在“人群区域”中,通过已知个体的体重分布,来估算其他个体的体重。
这种类比虽然做了降维处理,却生动地揭示了核酸电泳的分离原理。在实际的电泳实验中,DNA 分子的糖 - 磷酸骨架具有规律的重复结构,使得相同数量的双链 DNA 几乎带有等量的净电荷。因此,在琼脂糖凝胶的分子筛效应下,DNA 分子的迁移速率主要取决于其分子量的大小,从而实现了不同分子量核酸片段的有效分离。这种特性使得琼脂糖凝胶电泳成为分子生物学研究中分析 DNA 片段大小、纯度和完整性等性质的常规而强大的工具。
核酸电泳流程步骤详解
一、选择和制备凝胶
在核酸电泳分析中,选择合适的凝胶基质是关键的起始步骤。琼脂糖和聚丙烯酰胺是两种广泛应用于核酸分离的凝胶材料。二者均为三维网状结构的基质,其孔径大小适宜核酸分子通过,并且化学性质稳定,与样品组分之间无特异性反应,从而保证了电泳过程的稳定性和结果的可靠性。
琼脂糖凝胶的孔径大小主要取决于琼脂糖的浓度。低浓度的琼脂糖凝胶具有较大的孔径,适合分离高分子量的核酸片段;而高浓度的琼脂糖凝胶孔径较小,对低分子量核酸片段的分离效果更佳。聚丙烯酰胺凝胶则通过调整丙烯酰胺和双丙烯酰胺的比例来控制孔径大小,其分离范围通常小于琼脂糖凝胶,但具有更高的分辨率,能够有效区分分子量极为接近的核酸片段。制备凝胶时,需根据核酸片段的大小和实验目的精确调整凝胶浓度,以确保最佳分离效果。
二、准备标准品和样品
(一)核酸标准品选择
核酸标准品是含有已知大小核酸片段的参照样品,在电泳过程中与待测样品同步运行。其主要作用是为待测样品的分子量提供一个参考标准,通过对比标准品和样品的迁移位置,可以估算出样品中核酸片段的大致分子量。标准品的选择应基于实验目的和样品的预期分子量范围。常见的核酸标准品包括 DNA 分子量标准和 RNA 分子量标准,这些标准品通常由多个已知大小的核酸片段组成,覆盖了广泛的分子量范围,能够满足不同实验的需求。
(二)样品和标准品准备
在准备样品和标准品时,精确计算上样到凝胶中的 DNA 或 RNA 量至关重要。合适的样品浓度能够确保目的条带在电泳后得到良好分离,并便于后续的可视化和检测。一般来说,荧光染料能够检测到的 DNA 量范围为 1 - 100 ng/条带,但具体检测灵敏度会因所用染料的种类和浓度而有所不同。若样品或标准品的加载量过大,会导致条带过于浓集,出现拖尾现象,甚至使相邻条带相互重叠,难以分辨,尤其在片段大小相近时,这种问题更为突出。因此,在样品和标准品的制备过程中,需通过核酸浓度测定仪器准确测量核酸浓度,并根据凝胶的尺寸和孔径大小合理调整上样量,以保证电泳结果的准确性和可重复性。
(三)上样染料和缓冲液选择
在凝胶电泳实验中,上样染料和缓冲液的选择对实验结果具有重要影响。样品中通常需要添加凝胶上样缓冲液,常见的上样缓冲液为 6X 或 10X 的原液。上样缓冲液的主要功能包括:一是为样品提供一定的密度和颜色,便于样品在加样孔中的定位和观察;二是维持样品的化学稳定性,防止核酸在电泳前降解;三是为电泳过程提供稳定的离子环境,确保电场的均匀分布。缓冲液则在电泳过程中起到维持 pH 值稳定和提供离子导电性的作用,常见的电泳缓冲液包括 TAE(Tris - 醋酸盐 - EDTA)缓冲液和 TBE(Tris - 硼酸盐 - EDTA)缓冲液等,不同缓冲液适用于不同类型的凝胶和核酸样品。
三、运行电泳
在完成凝胶、标准品和样品的制备后,即可开始运行电泳。首先,确保凝胶完全凝固,这是电泳成功的关键一步。若凝胶未充分凝固,在后续操作中可能会出现胶孔变形或样品渗漏等问题,影响电泳结果的准确性。在拆卸梳子时,应平稳地向上提起,避免对凝胶造成撕裂或胶孔扭曲,以免影响样品的加载和迁移。移除梳子后,需仔细检查并清除胶孔中的气泡,因为气泡的存在会阻碍样品的正常迁移,导致电泳条带出现异常。对于聚丙烯酰胺凝胶,还需使用缓冲液彻底冲洗胶孔,以清除残留的未聚合的丙烯酰胺单体,防止其对电泳过程产生干扰。
在将凝胶放入电泳槽时,需注意凝胶的方向。对于水平凝胶,通常将样品孔置于负极一侧,以便在电场作用下,带负电荷的核酸分子向正极方向迁移。这个方向可以简单地记为“跑向红色”,因为正电极通常标记为红色,便于操作人员识别。在垂直凝胶系统中,胶孔一般设计在顶部,样品在电场作用下向下迁移。电泳运行过程中,需根据核酸片段的大小和凝胶的类型合理设置电场强度和电泳时间。一般来说,对于较大的核酸片段或孔径较小的凝胶,应采用较低的电场强度和较长的电泳时间,以确保核酸分子能够充分分离。
四、在凝胶中可视化样品
电泳完成后,为了观察和分析核酸片段的分离情况,需要对凝胶中的样品进行可视化处理。由于在普通照明环境下,核酸分子是不可见的,因此必须采用特定的可视化检测方法。常用的核酸可视化方法包括荧光染色法、银染法和放射性同位素标记法等。其中,荧光染色法是最为广泛应用的技术,如使用溴化乙锭(EB)或 GelRed 等荧光染料。这些染料能够与核酸分子结合,在紫外光的照射下发出荧光,从而使得核酸条带清晰可见。银染法则具有更高的灵敏度,能够检测到较低浓度的核酸,但操作相对复杂且具有一定的毒性。放射性同位素标记法适用于特定的实验场景,如 Northern Blot 或 Southern Blot 分析,通过放射性信号的检测来定位和定量核酸片段。
五、记录凝胶
在完成凝胶可视化后,为了便于后续的数据分析、结果记录和实验重复性验证,通常需要对核酸凝胶进行记录存档。可以采用凝胶成像系统对凝胶进行拍照,记录下电泳条带的形态、位置和强度等信息。这些图像资料不仅是实验结果的直观呈现,还可以用于定量分析,如通过图像分析软件对条带的灰度值进行测量,从而实现核酸片段的定量检测。同时,详细的实验记录应包括凝胶的类型、浓度、电泳条件、样品信息、标准品信息以及可视化方法等,以便在需要时能够追溯实验过程,评估实验结果的可靠性和准确性。
总之,核酸电泳是一项复杂而精细的技术,其操作流程涵盖了从凝胶选择与制备、样品和标准品的准备、电泳运行、样品可视化到凝胶记录等多个关键步骤。每个步骤都需要严格遵循实验规范和操作细节,以确保电泳结果的准确性和可重复性,为核酸研究提供可靠的分析手段。
| 名称 | 货号 | 规格 |
| Extraction-free One-Step RT-qPCR Kit(SYBR Green) | UA079018-100T | 100T |
| Extraction-free One-Step RT-qPCR Kit(SYBR Green) | UA079018-1000T | 1000T |
| Extraction-free One-Step RT-qPCR Kit(Probe) | UA079019-100T | 100T |
| Extraction-free One-Step RT-qPCR Kit(Probe) | UA079019-1000T | 1000T |







