分子杂交
摘要
核酸分子杂交技术作为一种关键的分子生物学工具,在遗传信息的研究、疾病诊断以及生物技术应用中占据着举足轻重的地位。本文深入探讨了核酸杂交的基本原理,涵盖了 DNA 的变性与复性机制以及影响杂交效率的关键因素。同时,详尽阐述了核酸探针的类型、标记方法以及常用核酸杂交技术的操作流程和应用场景,特别强调了其在基因诊断中的实践价值。通过对这些内容的系统梳理和分析,旨在为生命科学研究人员提供一个全面且深入的核酸杂交技术参考,助力该技术在基因组分析、基因表达调控研究以及遗传病诊断等领域的进一步应用与发展。
前言
遗传信息的传递与表达是生命活动的核心,核酸作为遗传信息的载体,其结构与功能的研究对于揭示生命奥秘具有不可替代的作用。核酸分子杂交技术应运而生,它基于核酸分子间的互补配对原则,使得科学家能够在分子水平上对特定的核酸序列进行定位、检测与分析。这一技术自 20 世纪中期被提出以来,经过数十年的发展与完善,已经成为生命科学研究中不可或缺的工具,在基因克隆、基因表达分析、遗传作图、疾病诊断等诸多领域发挥着关键作用,为推动现代生命科学的飞速发展做出了巨大贡献。
一、核酸杂交的基本原理
(一)DNA 的变性和复性
DNA 的双螺旋结构为其稳定性和遗传信息的传递提供了基础,但在核酸杂交过程中,首先需要将双链 DNA 解开为单链,这一过程称为 DNA 的变性。变性可通过多种方式实现,如加热、改变溶液的离子强度或引入有机溶剂等。当温度升高至一定程度或溶液中的盐浓度降低、有机溶剂存在时,DNA 双链间的氢键和碱基堆积力被破坏,双链随之分离形成单链 DNA。
DNA 的复性则是变性后的单链 DNA 在适宜条件下重新形成双链的过程。复性的效率与多种因素相关,如温度、溶液的离子强度、核酸的浓度以及单链 DNA 的长度和复杂性等。通常,复性反应在低于 DNA 熔解温度(Tm)的条件下进行,以便单链 DNA 能够充分退火形成稳定的双链结构。
(二)Tm 值及其影响因素
Tm 值,即 DNA 的熔化温度,是衡量 DNA 热稳定性的重要参数,它代表了一半 DNA 双链解离为单链时的温度。Tm 值主要受 DNA 的碱基组成影响,尤其是 GC 碱基对的含量。由于 GC 碱基对之间存在三个氢键,相较于 AT 碱基对的两个氢键,GC 碱基对的结合更为稳定,因此 GC 含量越高,DNA 的 Tm 值也相应越高,表明其热稳定性越强。
除了碱基组成,Tm 值还受溶液环境的影响。例如,溶液中的离子强度对 Tm 值有着显著影响。随着钠离子等金属离子浓度的增加,DNA 分子的静电斥力得到屏蔽,双链间的稳定性增强,从而使得 Tm 值升高。而有机溶剂如甲酰胺的加入则会降低 DNA 的稳定性,每增加 1% 的甲酰胺,DNA/DNA 或 DNA/RNA 双链的 Tm 值将减少约 0.72℃。这些影响因素使得科研人员能够在不同的实验条件下对核酸杂交过程进行精准调控,以满足特定的研究需求。
(三)核酸杂交的关键要素与过程
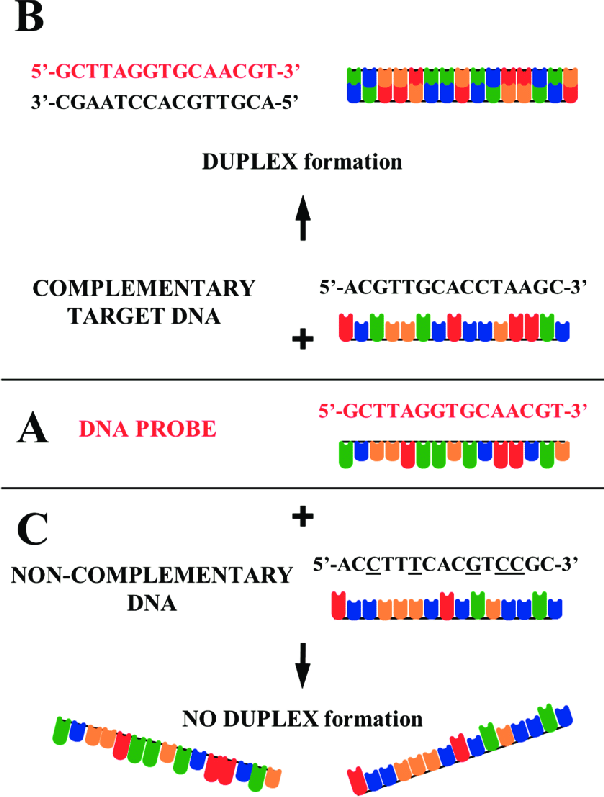
核酸杂交的核心在于两条具有同源性序列的单链核酸分子之间的互补配对。在实际操作中,首先需要将待检测的核酸样品进行变性处理,使其成为单链状态,以便与探针进行杂交。随后,在适当的温度、pH 和离子强度等条件下,将标记的核酸探针与变性后的核酸样品进行孵育。在此过程中,探针与样品中的互补序列通过碱基配对形成稳定的双链杂交分子。为了确保杂交结果的准确性,通常需要通过洗涤步骤去除未结合的探针,最后采用相应的检测方法对杂交产物进行分析。这一过程对实验条件的精确控制有着极为严格的要求,任何一个环节的疏忽都可能导致杂交结果的偏差,影响后续的实验结论。
二、核酸探针的选择与标记
核酸探针是核酸杂交技术中的关键工具,其性能直接决定了杂交实验的成功与否。探针的选择与标记需要综合考虑目标核酸的特性、实验目的以及检测方法等因素。
(一)核酸探针的类型
-
克隆的 DNA 片段探针 这类探针通常是从克隆的 DNA 文库中获取的较大片段,经过酶切和纯化后用于杂交实验。cDNA 探针是其中一种常用的形式,它是通过逆转录 mRNA 获得的互补 DNA 片段,能够代表特定基因的编码序列。由于 cDNA 探针具有与 mRNA 高度互补的特点,它在基因表达研究、基因定位以及基因功能分析等方面具有广泛的应用价值。例如,在研究基因在不同组织或发育阶段的表达模式时,cDNA 探针可以与 Northern 印迹中的 RNA 样品进行杂交,从而快速确定目标基因的表达情况。
-
RNA 探针(Riboprobe) RNA 探针是通过体外转录技术合成的 RNA 分子,以其高特异性和杂交效率著称。在 Northern 杂交和原位杂交等实验中,RNA 探针能够与目标 RNA 进行高效的互补配对,从而提高检测的灵敏度。然而,RNA 探针的稳定性较差,容易受到 RNase 的降解,且其制备过程相对复杂,需要特殊的体外转录体系和 RNA 标记技术,这在一定程度上限制了其广泛应用。尽管如此,随着核酸技术的不断进步,RNA 探针的制备和保存方法也在不断优化,使其在特定的核酸研究领域仍然具有不可替代的优势。
-
寡核苷酸探针 寡核苷酸探针是由化学方法人工合成的短链核酸片段,其制备过程相对简便快捷,可以根据目标序列设计出特异性的探针序列。寡核苷酸探针在基因突变检测、单核苷酸多态性(SNP)分析以及微生物鉴定等领域具有重要应用。由于其长度较短,杂交速度快,能够快速与目标序列结合并产生信号。然而,由于其序列较短,特异性相对较弱,容易出现非特异性杂交现象,导致假阳性结果的出现。因此,在使用寡核苷酸探针时,需要对探针的序列进行精心设计和优化,以提高其特异性和灵敏度。
-
聚合酶链反应扩增产物探针 利用 PCR 技术扩增特定的 DNA 片段作为探针来源,具有制备简便、产量高和特异性强等优点。PCR 技术能够在短时间内将微量的目标 DNA 片段扩增到足够的数量,以满足探针标记和杂交实验的需求。此外,通过在 PCR 反应中引入标记的核苷酸或在扩增后对产物进行标记,可以方便地制备出带有不同标记物的探针,适用于多种检测方法。因此,PCR 扩增产物探针在基因检测、病原体诊断以及基因定位等研究中得到了广泛应用,为核酸杂交技术的发展提供了有力的支持。
(二)核酸标记的类型
-
放射性同位素标记 放射性同位素标记是核酸探针标记的经典方法之一,具有极高的灵敏度,能够检测低丰度的核酸靶序列。常用的放射性同位素包括 32P、35S 和 33P 等。
-
32P :32P 是一种常用的高比活放射性同位素,其放射性强度大,自显影时间短,能够快速获得检测结果。但由于其半衰期较短(14.3 天),在实验过程中需要频繁更换探针,并且产生的 β 射线散射较强,这可能会影响杂交信号的分辨率,从而在一定程度上限制了其在高分辨率核酸分析中的应用。
-
35S :35S 的放射性相对较低,但具有较长的半衰期(87.1 天),这使得探针的保存和使用更加方便。同时,35S 的 β 射线散射较弱,在核酸序列分析和原位杂交等实验中能够提供较高的分辨率,特别适合于检测空间分辨率要求较高的核酸靶序列。
-
33P :33P 兼具了较高的灵敏度和较好的分辨率,其半衰期为 25.4 天,适中的半衰期使其在实际应用中具有较好的综合性能。尽管其价格相对较高,但在一些对检测灵敏度和分辨率要求较高的研究中,33P 标记探针仍然是一个理想的选择。
-
-
非同位素标记 随着生物技术的发展,非同位素标记方法因其操作安全、无放射性污染以及标记物稳定性高等优点逐渐受到青睐。其中,地高辛和生物素标记系统是两种常用的非同位素标记方法。
-
地高辛标记 :地高辛是一种植物糖苷,能够与地高辛特异性抗体结合,通过免疫学方法进行检测。地高辛标记的核酸探针具有良好的稳定性和特异性,适用于多种核酸杂交技术,如 Southern 印迹、Northern 印迹和原位杂交等。其检测灵敏度虽然稍低于放射性同位素标记,但通过优化检测方法和信号放大系统,可以显著提高检测信号的强度,满足大多数实验需求。
-
生物素标记 :生物素标记利用生物素与亲和素(或链霉亲和素)之间极强的亲和力进行检测。生物素标记的核酸探针具有较高的灵敏度和特异性,且标记过程相对简便。生物素标记系统具有良好的兼容性,可以与其他检测技术(如酶联免疫吸附试验、化学发光检测等)相结合,实现信号的放大和定量检测。在临床诊断和生物医学研究中,生物素标记的核酸探针被广泛应用于病原体检测、基因诊断和基因表达分析等领域。
-
(三)核酸探针的标记方法
-
随机引物法 随机引物法是一种常用的核酸探针标记方法,其基本原理是利用一组具有随机序列的六核苷酸片段作为引物,与待标记的核酸模板结合。在 DNA 聚合酶(如大肠杆菌 DNA 聚合酶 I 的大片段 Klenow 酶)的作用下,以标记的核苷酸为底物进行DNA合成,从而将标记物掺入到核酸探针中。该方法能够获得较高比活性的探针,适用于大多数核酸杂交实验,尤其是在需要对较大片段的 DNA 进行标记时具有明显优势。但需要注意的是,在标记过程中,反应条件(如温度、酶浓度、引物浓度等)对标记效率和探针质量有着重要影响,需要进行优化以确保标记效果。
-
缺刻平移法 缺刻平移法基于 DNA 的修复合成机制,利用大肠杆菌 DNase I 在温和条件下对双链 DNA 进行有限切割,产生少量的单链缺刻。然后,在 DNA 聚合酶 I 的作用下,以标记的核苷酸为底物,沿着 DNA 模板从缺刻处开始进行合成,同时将 5' 端的磷酸团和脱氧核糖切除,使新合成的 DNA 链逐渐取代原有的链,从而实现对 DNA 的标记。这种方法制备的探针较短,适合用于原位杂交等需要较高空间分辨率的实验。缺刻平移法标记的探针通常具有较高的标记效率和良好的杂交性能,但对 DNA 模板的质量和纯度要求较高,以避免影响标记反应的进行。
-
RNA 探针的制备和标记 RNA 探针主要通过体外转录技术进行制备和标记。首先,构建含有目标基因序列的 DNA 模板,通常是在目的基因的上游引入合适的 RNA 聚合酶启动子序列(如 T7、T3 或 SP6 启动子)。然后,以该 DNA 模板为模版,在体外转录反应体系中加入 RNA 聚合酶、标记的核糖核苷三磷酸(NTPs)以及其他必要的辅助因子,启动子序列启动转录过程,合成带有标记物的 RNA 探针。体外转录法制备的 RNA 探针具有合成效率高、产物均一、比活性高等优点,适合于对 RNA 靶序列进行高灵敏度检测。然而,RNA 探针的不稳定性需要在制备、保存和使用过程中采取特殊的保护措施,如避免 RNase 污染、使用 RNase 抑制剂等,以确保探针的完整性和活性。
-
聚合酶链反应标记 DNA 探针 PCR 技术结合标记的 dNTPs 和 DNA 聚合酶(如 Taq DNA 聚合酶),可以从少量的起始 DNA 模板高效合成高比活性的双链或单链 DNA 探针。在 PCR 反应体系中,加入标记的 dNTPs(如地高辛 - 11 - dUTP 或生物素 - 16 - dUTP),在 DNA 聚合酶的催化下,标记的 dNTPs 被掺入到新合成的 DNA 链中,从而实现对 DNA 探针的标记。PCR 标记方法具有操作简便、快速高效、灵敏度高等特点,能够根据需要快速制备大量的探针,并且可以通过调整引物序列和 PCR 条件来优化探针的特异性和产量。此外,利用巢式 PCR、多重 PCR 等改进的 PCR 技术,可以进一步提高探针制备的效率和特异性,满足不同实验对探针的要求。
-
寡核苷酸探针的标记
-
5’ - 端标记 :T4 多核苷酸激酶标记法是一种常用的 5’ - 端标记方法。该方法利用 T4 多核苷酸激酶催化 ATP 的 γ - 磷酸基团转移至寡核苷酸的 5’ - 端羟基上,从而实现标记。此方法适用于对短寡核苷酸进行 5’ - 端标记,常用于 DNA 序列分析中的引物标记。但需要注意的是,反应体系中的杂质(如未反应的 ATP 或其他离子)可能会影响标记效率和标记物的结合,因此需要对反应后的探针进行纯化处理,以获得高质量的标记探针。
-
3’ - 端标记 :末端转移酶法可用于 3’ - 端标记,通过末端转移酶将标记的 dNTP 或 ddNTP 添加到寡核苷酸的 3’ - 末端。该方法操作相对简便,能够对多种寡核苷酸进行 3’ - 端标记。然而,末端转移酶的活性受多种因素影响(如反应温度、缓冲液成分、底物浓度等),在标记过程中需要严格控制反应条件,确保标记反应的顺利进行。同时,3’ - 端标记后的探针在杂交反应中可能会对 DNA 聚合酶的延伸反应产生一定的影响,因此在涉及后续酶促反应的应用中需要谨慎使用。
-
非同位素核酸探针标记 :对于非同位素标记的寡核苷酸探针,其标记方法与同位素标记略有不同。由于不能直接使用多核苷酸激酶对标记物进行 5’ - 端标记,通常需要采用间接标记或其他标记策略。例如,可以通过化学偶联的方法将地高辛或生物素等标记物连接到寡核苷酸的 5’ - 端或内部特定位置。这些标记物在寡核苷酸合成过程中即可引入,或者在合成后通过化学反应进行修饰添加。非同位素标记的寡核苷酸探针在免疫检测、荧光检测等实验中具有广泛的应用,其标记过程和检测方法的不断优化使其在核酸杂交技术中发挥着越来越重要的作用。
-
三、常用核酸杂交技术
(一)斑点 / 狭缝印迹(Dot/slot blot)杂交
斑点 / 狭缝印迹杂交是一种快速、简便的核酸杂交方法。其操作流程主要包括以下几个步骤:首先,将待检测的 DNA 或 RNA 样品进行变性处理,破坏其二级结构,使其成为单链状态,以确保与探针的充分杂交。接着,将变性后的样品直接点样于尼龙膜上,样品中的核酸分子通过静电作用吸附在膜上。随后,进行预杂交处理,以封闭膜上非特异性结合位点,减少探针的非特异性吸附。然后,将标记的核酸探针与膜上的核酸样品进行杂交,在适宜的温度和缓冲液条件下,探针与样品中的互补序列结合形成杂交双链。杂交完成后,通过严格的洗涤步骤去除未结合的探针,最后采用相应的检测方法(如放射自显影、化学发光或酶联免疫吸附测定等)对杂交信号进行检测和分析。
斑点 / 狭缝印迹杂交的优势在于能够同时对多个样品进行快速检测,尤其适用于对大量样品进行初步筛选。然而,其特异性相对较差,容易出现假阳性结果,这是由于在样品点样过程中,核酸分子没有经过电泳分离,不同大小的核酸片段混合在一起,可能导致探针与非目标序列发生非特异性杂交。此外,由于缺乏核酸片段的大小信息,无法通过该方法对核酸分子的大小进行准确判断,这在一定程度上限制了其在核酸结构分析等需要精确确定核酸片段大小的应用领域中的使用。
(二)Southern 印迹
Southern 印迹是核酸杂交技术中用于检测 DNA 片段的经典方法。其基本步骤如下:首先,利用限制性内切酶对大分子 DNA 样品进行酶切,将 DNA 分解为不同大小的片段。然后,将酶切后的 DNA 片段通过琼脂糖凝胶电泳进行分离,根据 DNA 片段的分子量大小进行排序。在电泳过程中,DNA 片段在凝胶中的迁移速率与其分子量呈负相关,较小的片段迁移速度较快,较大的片段迁移速度较慢,从而实现不同大小 DNA 片段的分离。接下来,将凝胶中的 DNA 片段进行变性处理,使其从双链状态转变为单链状态,以便与单链 DNA 探针进行杂交。变性后的 DNA 片段通过毛细管作用从凝胶转移到固相支持物(如尼龙膜或硝酸纤维素膜)上,并与支持物紧密结合。随后,进行预杂交以封闭非特异性结合位点,再将标记的 DNA 探针与膜上的 DNA 片段进行杂交。在杂交过程中,探针与膜上的互补 DNA 序列结合,形成稳定的杂交双链。最后,通过洗膜去除未结合的探针,并采用合适的检测方法对杂交信号进行显色或放射自显影成像等检测,从而确定目标 DNA 片段在样品中的存在情况以及其大小和数量等信息。
Southern 印迹杂交在基因组结构分析、基因组 DNA 的定性和定量分析以及基因突变检测等方面具有重要应用价值。例如,在研究基因的组织特异性表达、基因拷贝数变异以及基因缺失或插入突变等方面,Southern 印迹能够提供准确可靠的检测结果。通过对不同个体或样本的基因组 DNA 进行 Southern 印迹分析,可以揭示基因的遗传多态性以及基因结构的改变,为遗传病的诊断、基因定位和基因功能研究等提供重要的分子依据。
(三)Northern 印迹
Northern 印迹是用于检测 RNA 分子特别是 mRNA 的核酸杂交技术。其基本操作流程如下:首先,提取 RNA 样品,并进行变性处理以消除 RNA 分子的二级结构,使其成为单链状态。然后,将变性后的 RNA 样品通过变性聚丙烯酰胺凝胶电泳或甲醛变性琼脂糖凝胶电泳进行分离。由于 RNA 分子的大小和所带电荷不同,在电场作用下,RNA 分子按照大小进行迁移,小分子 RNA 迁移速度快,大分子 RNA 迁移速度慢。电泳分离后的 RNA 分子通过毛细管转移或电转移的方式从凝胶转移到固相支持物(如尼龙膜)上,并与支持物结合稳定。接下来,进行预杂交处理以封闭膜上的非特异性结合位点,然后将标记的核酸探针(通常是与目标 mRNA 序列互补的 DNA 探针或 RNA 探针)与膜上的 RNA 分子进行杂交。在适当的杂交条件下,探针与互补的 RNA 序列结合形成杂交双链。杂交完成后,通过洗涤步骤去除未结合的探针,并采用相应的检测方法对杂交信号进行检测,从而确定目标 RNA 的存在情况、大小以及表达水平等信息。
Northern 印迹作为基因表达研究分析的标准方法之一,在研究基因转录水平的表达调控、mRNA 的稳定性以及可变剪接等 mRNA 加工事件中发挥着关键作用。通过对不同组织、细胞或生理状态下 RNA 样品的 Northern 印迹分析,可以深入了解基因在特定时空条件下的表达模式,揭示基因表达调控的机制,为基因功能研究、疾病发生机制的探讨以及药物靶点的发现等提供重要线索。然而,与 Southern 印迹相比,Northern 印迹的实验过程更加繁琐,对实验条件的要求更为严格,尤其是在 RNA 提取和电泳过程中需要严格避免 RNase 的污染,否则可能导致 RNA 样品的降解,影响实验结果的准确性和可靠性。
(四)原位杂交
原位杂交是一种在细胞或组织切片中原位检测核酸序列的技术,能够在细胞的自然环境或组织结构中对特定的核酸分子进行定位和定量分析。其基本原理是将标记的核酸探针与固定在玻片上的细胞或组织切片中的核酸靶分子进行杂交,通过检测探针标记物产生的信号,确定目标核酸序列在细胞或组织中的位置和含量。
原位杂交技术具有以下特点:首先,它能够在细胞或组织的原位进行检测,保持了细胞和组织的形态结构,使得研究人员可以在细胞和组织的背景下观察基因的表达情况,这对于研究基因在组织发育、细胞分化以及疾病发生过程中的作用具有重要意义。其次,原位杂交技术具有较高的灵敏度和特异性,能够检测低丰度的核酸靶序列,并且通过使用不同标记物和检测方法,可以实现多重检测,同时检测多个基因的表达情况。此外,原位杂交技术适用于多种类型的细胞和组织样本,包括石蜡包埋组织切片、冰冻切片、细胞涂片、细胞培养玻片等,具有广泛的应用范围。
原位杂交技术在生物学和医学研究中有着广泛的应用。在基础研究方面,它被用于研究基因在细胞核和细胞质中的定位、染色体结构和功能、基因表达的时空模式以及细胞间和细胞内核酸分子的相互作用等。在临床诊断领域,原位杂交技术可用于检测病原体核酸(如病毒、细菌和寄生虫等),辅助传染病的诊断;检测癌基因和抑癌基因的表达情况,用于肿瘤的早期诊断、预后评估和治疗监测;分析细胞遗传学异常,如染色体易位、缺失和扩增等,为遗传病的诊断和研究提供依据。随着原位杂交技术的不断发展和改进,其在生物医学研究中的应用前景将更加广阔。
(五)核酸杂交在基因诊断中的应用
核酸杂交技术在基因诊断领域展现出了巨大的应用潜力,为遗传病、传染病和肿瘤等疾病的诊断提供了重要的分子工具。以下是核酸杂交在基因诊断中的几种主要应用方法:
-
限制性片段长度多态性(RFLP)分析 RFLP 是一种基于 DNA 变异导致限制性核酸内切酶识别位点改变的分析方法。在基因组 DNA 中,由于单核苷酸多态性(SNP)或其他 DNA 序列变异,可能会产生新的限制性酶切位点或消除原有的酶切位点。通过使用特定的限制性内切酶对 DNA 进行酶切,然后利用Southern blotting 或 PCR 方法对酶切片段进行检测,可以分析 RFLP 图谱。例如,在遗传病基因诊断中,RFLP 分析可用于鉴定与疾病相关的基因突变。以囊性纤维化为例,该疾病是由 CFTR 基因的突变引起的,通过 RFLP 分析可以检测 CFTR 基因是否存在特定的突变位点,从而为疾病的诊断和遗传咨询提供依据。此外,RFLP 分析还可用于 DNA 指纹图谱(DNA fingerprinting)的制作,通过分析人类染色体 VNTR(可变数目串联重复序列)区域的 RFLP 图谱,可以用于个体识别、亲子鉴定以及法医学中的身份认定等,具有重要的法医学和遗传学应用价值。
-
等位基因特异性寡核苷酸(ASO)探针杂交 ASO 探针杂交是一种检测点突变的高特异性方法。等位基因特异性寡核苷酸探针是针对正常和突变等位基因的特异性序列设计的寡核苷酸片段。由于碱基错配会显著影响杂交分子的稳定性,因此在杂交过程中,只有与目标等位基因完全互补的探针才能形成稳定的杂交双链,从而实现对目标点突变的检测。ASO 探针杂交技术具有操作简便、快速和高特异性等特点,尤其适用于检测已知的单核苷酸突变位点。例如,在镰状细胞贫血的诊断中,ASO 探针可以特异性地识别 β - 球蛋白基因上的突变位点(如 A→T 突变),为疾病的早期诊断和携带者筛查提供有力支持。此外,该技术还可应用于植物遗传育种中的基因型鉴定、微生物耐药基因的检测等领域,为生命科学研究和实际应用提供了重要的技术手段。
-
基因表达分析 基因表达分析是研究基因功能和疾病发生机制的重要手段,常用 Northern blotting 和原位杂交技术进行检测。Northern blotting 类似于 Southern blotting,但主要用于检测 RNA 分子。通过对 RNA 样品进行提取、变性、电泳分离和转移后,利用标记的核酸探针与 RNA 杂交,可以分析目标 mRNA 的表达水平和分子大小。这有助于了解基因在不同组织、细胞或生理条件下的转录活性,以及 mRNA 的稳定性等信息。原位杂交技术则可以在细胞和组织水平上直接观察基因的表达情况,为研究基因表达的时空特异性提供了直观的证据。例如,在肿瘤研究中,通过原位杂交可以检测肿瘤组织中特定基因的表达情况,分析基因表达与肿瘤发生、发展、转移之间的关系,有助于发现肿瘤标志基因和潜在的治疗靶点。同时,基因表达分析还可用于研究细胞分化、胚胎发育、免疫应答等生物过程中的基因调控机制,为深入理解生命活动的分子基础提供了关键信息。
四、核酸杂交技术的未来展望
核酸杂交技术自问世以来,已经取得了长足的发展,并在生命科学的各个领域发挥着重要作用。然而,随着生命科学研究的不断深入,对核酸杂交技术的要求也越来越高。未来,核酸杂交技术有望在以下几个方面取得进一步的突破和发展:
-
高通量和自动化核酸杂交技术 随着基因组学、转录组学和蛋白质组学等高通量研究领域的快速发展,传统的核酸杂交技术在样本处理量和实验效率方面面临着巨大的挑战。因此,开发高通量和自动化的核酸杂交技术成为必然趋势。例如,微流控芯片技术与核酸杂交的结合,可以在微小的芯片上实现对大量核酸样品的平行检测和分析,极大地提高了实验效率和通量。同时,自动化核酸杂交设备的开发将减少人为操作误差,提高实验结果的重复性和可靠性,为大规模的基因表达谱分析、基因组多态性研究以及临床诊断等提供有力支持。
-
单细胞水平核酸杂交技术 单细胞生物学的兴起使得对单个细胞内核酸分子的检测和分析变得尤为重要。传统的核酸杂交技术通常是对大量细胞样品进行检测,难以揭示细胞间的异质性和基因表达的个体差异。因此,发展单细胞水平的核酸杂交技术具有重要的科学意义。通过结合微纳加工技术、单细胞分离技术和高灵敏度检测方法,单细胞核酸杂交技术能够在单细胞水平上对特定的核酸序列进行精确定位和定量分析,深入研究细胞间的差异性、干细胞的命运决定、肿瘤细胞的异质性以及微生物群落中单个微生物的基因功能等,为生命科学的前沿研究提供新的技术手段和研究思路。
-
多组学融合的核酸杂交技术 在后基因组时代,多组学研究方法的融合成为生命科学研究的热点。核酸杂交技术与其他组学技术(如基因组学、转录组学、蛋白质组学和代谢组学等)的深度整合,将有助于从系统水平上理解生命活动的复杂调控网络。例如,通过将核酸杂交技术与蛋白质芯片技术相结合,可以同时检测核酸和蛋白质之间的相互作用,揭示基因表达调控的分子机制;将核酸杂交技术与代谢组学分析相结合,可以研究基因表达变化与代谢途径改变之间的关联,为疾病的发病机制研究提供更全面的视角。这种多组学融合的核酸杂交技术将推动系统生物学的发展,为精准医学和个性化医疗提供更有力的技术支持。
-
新型标记技术和检测方法 标记技术和检测方法的创新是核酸杂交技术发展的关键驱动力之一。传统的放射性同位素标记和非同位素标记方法在灵敏度、特异性和安全性等方面仍存在一定局限性。未来,新型标记物(如量子点、荧光蛋白、纳米材料标记等)和检测方法(如表面等离子共振成像、光镊技术、原子力显微镜等)的应用将为核酸杂交技术带来新的突破。这些新技术具有更高的灵敏度、更好的稳定性、更低的背景信号和更高的时空分辨率等优点,能够实现对核酸分子的实时、动态和高分辨率检测,为核酸杂交技术在生物医学研究和临床诊断中的应用提供更先进的工具。
结论
核酸分子杂交技术作为一种基于核酸分子互补配对原则的分子生物学技术,在基因组分析、基因表达研究、基因诊断以及生物技术应用等领域展现出了强大的功能和广泛的应用前景。从核酸杂交的基本原理到核酸探针的选择与标记,再到常用核酸杂交技术的操作流程和实际应用,每一个环节都蕴含着丰富的科学内涵和技术细节。通过深入理解和优化这些技术要素,我们能够更好地利用核酸杂交技术揭示遗传信息的奥秘,推动生命科学的发展。在未来的生命科学研究中,随着技术的不断创新和改进,核酸杂交技术将与其他前沿技术相互融合、相互促进,为探索生命现象的复杂性和多样性提供更加精准、高效的工具和方法,为人类健康事业做出更大的贡献。
| 名称 | 货号 | 规格 |
| 地高辛标记试剂盒(PCR法) | abs60362-10T | 10T |
| 地高辛标记试剂盒(PCR法) | abs60362-20T | 20T |
| 地高辛标记原位杂交检测试剂盒 | abs60363-250T | 250T |
| 地高辛标记原位杂交检测试剂盒 | abs60363-500T | 500T |