SARS-CoV-2 mRNA vaccination induces an intranasal mucosal response characterized by neutralizing antibodies
一、引言
新型冠状病毒(SARS-CoV-2)引发了全球性的新冠疫情,对公共卫生构成了重大挑战。随着病毒的不断变异,研发能够有效预防感染并增强免疫反应的疫苗成为当务之急。mRNA 疫苗作为一种新型疫苗技术,在应对 SARS-CoV-2 感染中展现出了巨大潜力。传统的疫苗研究多关注系统性免疫反应,然而,鼻腔作为许多呼吸道病原体的主要感染部位和防御前线,其黏膜免疫反应在抵抗病毒感染中也起着至关重要的作用。本文将深入解析一篇关于 SARS-CoV-2 mRNA 疫苗诱导鼻腔黏膜免疫反应,特别是中和抗体产生的研究文献,探讨其研究背景、方法、结果及意义。
二、研究背景
鼻腔在人体呼吸系统中扮演着重要角色,它不仅是空气进入呼吸道的入口,也是抵御外来病原体的关键屏障。鼻腔黏膜通过物理阻挡、黏液纤毛清除以及免疫细胞的监视和信号传递等功能,为机体提供保护。已有研究表明,病毒特异性抗体(如 IgG 和分泌型 IgA)可在鼻腔内产生,这些抗体在抵御病毒感染中发挥重要作用。
mRNA 疫苗通过将编码特定抗原的 mRNA 封装在脂质纳米颗粒中,利用人体细胞的蛋白质合成机制产生目标抗原,从而激发免疫反应。与传统减毒疫苗不同,mRNA 疫苗无需直接引入目标抗原,其研发和生产具有快速、灵活的优势。在新冠疫情爆发后,mRNA 疫苗技术迅速应用于 SARS-CoV-2 疫苗的开发,并在短时间内取得了显著进展。然而,关于 mRNA 疫苗是否能在鼻腔黏膜诱导抗体产生以及这些抗体是否具有中和病毒的能力,此前的研究报道较少,存在知识空白。
随着病毒的持续进化,出现多种具有更强免疫逃逸能力和传播力的 SARS-CoV-2 变异株,这促使研究人员不断探索新的疫苗策略,以提高疫苗的保护效果。黏膜免疫,尤其是鼻腔黏膜免疫,因其在预防呼吸道病毒感染中的潜在优势而受到关注。因此,深入研究 SARS-CoV-2 mRNA 疫苗对鼻腔黏膜免疫的影响具有重要意义。
三、研究方法
研究对象为 29 名健康的志愿者,他们接受了 SARS-CoV-2 mRNA 疫苗(包括 Spikevax 和 Comirnaty 两种品牌)接种。研究通过采集志愿者的血液和鼻腔上皮衬液(NELF)样本,来评估疫苗接种前后病毒特异性抗体水平的变化。
(一)样本收集
-
血液样本 :通过静脉穿刺采集血液,经离心分离得到血清,储存于 -80℃环境中待测。
-
NELF 样本 :采用先前报道的方法收集 NELF,样本储存于 -20℃环境中。
(二)样本分析
-
总 IgA 和 IgG 浓度检测 :使用单 Plex 电化学发光间接夹心 ELISA 试剂盒(Invitrogen 公司)分别针对人 IgA 和 IgG 进行检测。根据样本类型(血清或 NELF)进行不同比例的稀释,以确保检测结果的准确性。
-
SARS-CoV-2 特异性 IgA 和 IgG 浓度检测 :运用多 Plex 电化学发光间接夹心 ELISA 试剂盒(Meso Scale Discovery 公司)对样本进行分析,以检测针对 SARS-CoV-2 刺突蛋白(Spike 蛋白)不同表位(如受体结合域 RBD、N 端域 NTD 以及刺突蛋白 2 S2)的特异性 IgA 和 IgG 抗体。同样根据样本类型进行适当的稀释。
-
S1 亚基结合特异性计算 :通过计算公式(公式 1 和公式 2)分别得出血清和 NELF 样本中 IgA 和 IgG 针对 S1 亚基的结合特异性百分比。
-
SARS-CoV-2 S1 RBD 中和活性检测 :采用多 Plex 中和 ELISA 试剂盒(Meso Scale Discovery 公司)测量血清和 NELF 样本中抗体对 SARS-CoV-2 刺突 S1 RBD 抗原的中和活性,通过计算公式(公式 3 和公式 4)得到抑制百分比以及以任意单位(AU)表示的抑制百分比与抗体浓度的比值。
(三)数据分析
使用 GraphPad Prism 9.2.0 软件进行数据分析和绘图。通过 Shapiro-Wilk 正态性检验后,采用非配对 t 检验和 Mann-Whitney 检验比较不同疫苗接种状态、疫苗品牌以及性别之间的血清和 NELF 样本中 IgA 和 IgG 浓度差异,以及接种后中和活性的差异。以 P 值小于 0.05 作为判断差异具有统计学意义的标准。同时,运用主成分分析(PCA)评估年龄、BMI 和抗体浓度对血清及 NELF 样本中抗 SARS-CoV-2 抗体浓度差异的贡献,并在 R-4.2.0 软件中使用 FactoMineR 和 Factoextra 包完成相关分析。
四、研究结果
(一)人口统计学特征
研究共纳入 29 名志愿者,其中 19 名参与了疫苗接种前的访视(preimmunity 组),24 名参与了接种后至少两周的访视(postimmunity 组)。在 postimmunity 组中,14 名接种了 Comirnaty 疫苗,10 名接种了 Spikevax 疫苗。各组间年龄和 BMI 无显著差异。在性别分布方面,整体男性与女性比为 13:16,但在不同子组间存在一定差异。
(二)疫苗接种前后的抗体浓度变化
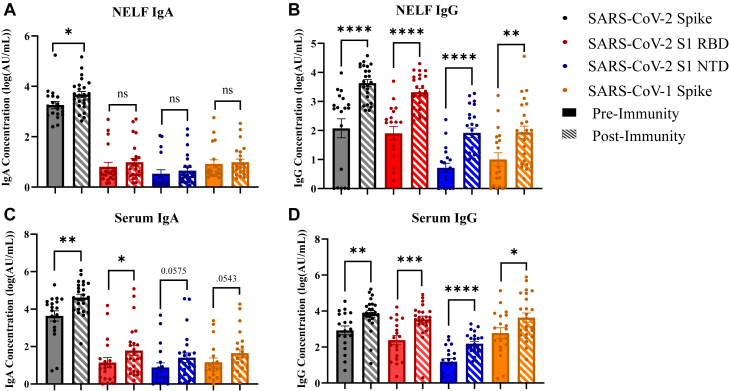
与 preimmunity 组相比,postimmunity 组志愿者的 NELF 和血清样本中针对 SARS-CoV-2 刺突蛋白的 IgA 和 IgG 浓度均显著升高。具体而言,鼻腔黏膜 IgA 和 IgG 抗体浓度(分别为 14,116 ± 30,586 AU 和 54,434 ± 8,195 AU)比血清中的浓度(分别为 154,245 ± 265,080 AU 和 15,546 ± 31,600 AU)低一个数量级。针对 S1 RBD 蛋白的 IgG 浓度在接种后无论是 NELF 还是血清样本中均显著高于接种前。而对于 S1 RBD 特异性 IgA,仅血清样本中接种后的浓度显著高于接种前,表明鼻腔内针对该抗原的 IgA 免疫反应较弱。此外,针对 S1 NTD 蛋白的 IgG 浓度在接种后也显著升高,但针对该蛋白的 IgA 浓度在血清和 NELF 样本中均未观察到显著差异,提示全身及鼻腔内针对此抗原的 IgA 免疫反应同样较弱。值得注意的是,与 SARS-CoV-2 核衣壳蛋白相关的 IgA 和 IgG 浓度在 preimmunity 组和 postimmunity 组之间的血清和 NELF 样本比较中未发现差异,这可能与疫苗成分无关,因为所研究的两种 mRNA 疫苗均不编码核衣壳蛋白。然而,SARS-CoV-1 刺突蛋白特异性 IgG 浓度在 postimmunity 组的血清和 NELF 样本中均显著高于 preimmunity 组,但针对该蛋白的 IgA 浓度在血清和 NELF 样本中未发现显著差异。
(三)S1 亚基结合特异性
在 postimmunity 组中,计算了 RBD 和 NTD 与 SARS-CoV-2 刺突蛋白特异性抗体浓度的比例,以评估 NELF 和血清样本中针对 S1 亚基的结合特异性。结果显示,IgG 针对 S1 亚基的结合占总结合的 54.63%(NELF 样本,其中 RBD 占 50.91%,NTD 占 3.72%)和 48.97%(血清样本,其中 RBD 占 47.57%,NTD 占 1.40%)。而 IgA 针对 S1 亚基的结合仅占 0.52%(NELF 样本,其中 RBD 占 0.39%,NTD 占 0.13%)和 6.96%(血清样本,其中 RBD 占 4.98%,NTD 占 1.98%)。这表明 IgA 抗体可能对 S2 亚基具有更高的亲和力,但本研究未直接测量 S2 亚基的结合情况。
(四)不同 mRNA 疫苗品牌的抗体反应比较
研究对比了接种 Spikevax 和 Comirnaty 疫苗的个体在血清和 NELF 样本中的 SARS-CoV-2 特异性 IgA 和 IgG 浓度。结果显示,接种 Spikevax 的个体在 postimmunity 访视中,血清和 NELF 样本中的刺突蛋白特异性 IgA 和 IgG 浓度均显著高于接种 Comirnaty 的个体。针对 S1 RBD 和 S1 NTD 蛋白的 IgA 和 IgG 浓度在接种 Spikevax 的个体中同样显著高于接种 Comirnaty 的个体。此外,Spikevax 接种组的血清中核衣壳蛋白特异性 IgG 浓度也高于 Comirnaty 组,但在 NELF 样本中,核衣壳蛋白特异性 IgA 浓度则在 Comirnaty 组中更高。由于两种疫苗均不编码核衣壳蛋白,这种差异可能源于未报告的 SARS-CoV-2 感染或抗体交叉反应。
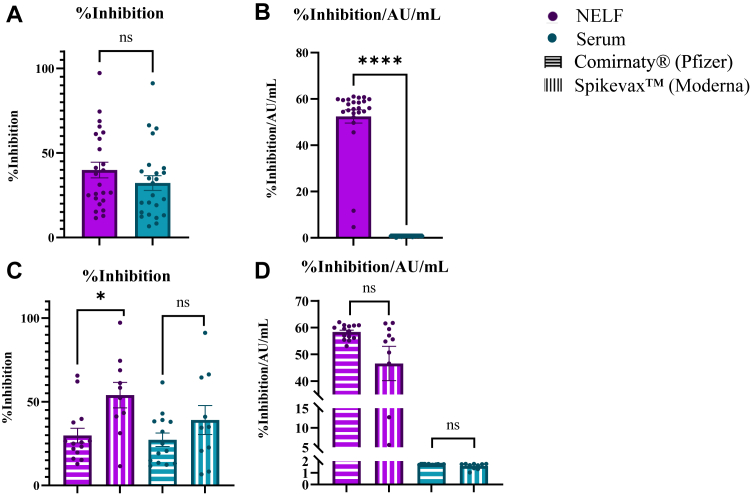
(五)SARS-CoV-2 S1 RBD 中和活性
比较血清和 NELF 样本的中和活性时发现,两种样本类型的信号水平均在标准曲线范围内,表明所选用的稀释浓度合适。在控制病毒特异性抗体浓度后,鼻腔抗体显示出比血清抗体更强的中和活性。在 NELF 样本中,接种 Spikevax 的个体的抑制百分比高于接种 Comirnaty 的个体。然而,当控制病毒特异性抗体浓度后,两种疫苗接种组之间的血清和 NELF 样本的抑制百分比差异不再显著。
五、研究讨论
本研究通过采集鼻腔上皮衬液和血清样本,评估了 SARS-CoV-2 mRNA 疫苗接种后鼻腔黏膜和全身的免疫反应。结果显示,肌肉注射的 mRNA 疫苗能够诱导鼻腔黏膜和全身产生针对 SARS-CoV-2 刺突蛋白的抗体,并且这些抗体具有中和病毒的能力。
(一)鼻腔黏膜免疫反应的诱导
研究证实,mRNA 疫苗接种后,鼻腔黏膜中 IgG 和 IgG 抗体浓度显著增加,表明 mRNA 疫苗不仅能激发全身免疫反应,还能诱导鼻腔黏膜的局部免疫反应。这为通过疫苗接种在病毒感染的主要部位建立免疫防线提供了科学依据。鼻腔黏膜免疫的建立可能有助于阻止病毒在上呼吸道的定植和复制,从而减少病毒传播和感染的风险。
(二)抗体的结合特异性
IgG 抗体对 S1 亚基(尤其是 RBD 和 NTD)显示出较高的结合特异性,而 IgA 抗体的结合特异性相对较低,且可能主要针对 S2 亚基。这提示不同免疫球蛋白类型在免疫反应中可能发挥不同的作用。IgG 抗体通过与病毒表面的抗原结合,阻断病毒与宿主细胞受体的相互作用,从而实现中和作用;而 IgA 抗体在黏膜表面可能通过不同的机制发挥作用,如阻止病毒穿透黏液层或干扰病毒在黏膜内的传播。针对 S2 亚基的 IgA 抗体的具体功能和作用机制有待进一步研究。
(三)不同 mRNA 疫苗品牌的免疫原性差异
Spikevax 疫苗在诱导全身和鼻腔黏膜抗体产生方面表现出比 Comirnaty 疫苗更强的能力。这种差异可能与疫苗的成分、剂量、佐剂等因素有关。Spikevax 疫苗(mRNA-1273)和 Comirnaty 疫苗(BNT162b2)虽然都属于 mRNA 疫苗,但在 mRNA 序列设计、脂质纳米颗粒组成等方面存在差异,这些差异可能导致免疫系统激活程度的不同。较高的抗体浓度可能意味着更强的免疫保护效果,但需要进一步的研究来确定具体的保护阈值以及这种差异在实际预防感染中的临床意义。
(四)中和活性的意义
鼻腔抗体较血清抗体展现出更高的中和活性,这强调了黏膜免疫在抵御呼吸道病毒感染中的重要性。鼻腔作为病毒首先接触的部位,局部产生的中和抗体能够迅速发挥作用,阻止病毒入侵宿主细胞,减少病毒在体内的扩散。相比之下,血清中的抗体需要一定时间才能到达感染部位发挥作用。因此,通过疫苗接种诱导黏膜免疫反应,提高鼻腔等呼吸道黏膜部位的中和抗体水平,对于预防 SARS-CoV-2 感染具有潜在的临床价值。这也为开发新型疫苗策略,如鼻喷式疫苗或黏膜免疫增强剂提供了理论支持。
(五)研究局限性
尽管本研究提供了一些关于 SARS-CoV-2 mRNA 疫苗诱导黏膜免疫反应的有价值的信息,但也存在一些局限性。首先,研究样本量较小,且为便利抽样,可能无法完全代表所有接种人群的情况。其次,部分受试者未能在接种前进行采样,导致无法进行完全匹配的分析。此外,研究主要集中在年轻、健康的白人成年人群体,对于其他年龄、种族、健康状况的人群的适用性尚需进一步验证。最后,研究未直接测量 S2 亚基特异性抗体,限制了对 IgA 抗体结合特异性的全面评估。
六、结论与展望
本研究表明,SARS-CoV-2 mRNA 疫苗能够诱导鼻腔黏膜和全身产生具有中和能力的抗体,其中鼻腔黏膜免疫反应的激活为预防病毒感染提供了额外的保护机制。Spikevax 疫苗相较于 Comirnaty 疫苗在诱导抗体产生方面表现出更强的能力,这可能对疫苗的选择和优化具有一定的指导意义。然而,要充分发挥黏膜免疫在疫情防控中的作用,仍需克服诸多挑战,如确定诱导保护性黏膜免疫所需的抗体浓度、优化疫苗接种策略以增强黏膜免疫反应等。
未来的研究应扩大样本量,涵盖更广泛的人群,进一步验证和细化本研究的发现。同时,深入探索黏膜免疫反应的细胞机制、抗体功能以及与其他免疫成分的协同作用,将有助于开发更有效的疫苗和免疫干预措施。此外,随着病毒的不断变异,针对新出现的变异株评估疫苗诱导的黏膜免疫反应的交叉保护能力也至关重要。通过这些努力,我们有望为控制新冠疫情以及应对其他呼吸道传染病提供更有力的武器,构建更加完善的免疫防御体系。
表格 1 :研究人口统计学特征
| 特征 | N = 29 | n₁ = 19(preimmunity 访视) | n₂ = 24(postimmunity 访视) | n₃ = 14(Comirnaty postimmunity 访视) | n₄ = 10(Spikevax postimmunity 访视) |
|---|---|---|---|---|---|
| 年龄(岁),平均值 ± 标准差 | 25.80 ± 7.23 | 24.29 ± 5.71 | 26.64 ± 7.60 | 27.5 ± 8.54 | 25.43 ± 6.28 |
| 男女性别比 | 13:16 | 11:8 | 14:10 | 5:9 | 5:5 |
| BMI(kg/m²),平均值 ± 标准差 | 25.20 ± 6.09 | 25.89 ± 6.67 | 25.05 ± 6.32 | 24.1 ± 4.49 | 26.37 ± 8.34 |
| 种族 | |||||
| 黑人 | 3 | 2 | 2 | 2 | 0 |
| 亚洲人 | 2 | 2 | 2 | 2 | 0 |
| 白人 | 22 | 13 | 19 | 10 | 9 |
| 黑人 / 亚洲人 | 1 | 1 | 1 | 0 | 1 |
| 亚洲人 / 白人 | 1 | 1 | 0 | 0 | 0 |
* 表中数据来源于原文,展示了各组志愿者的基本人口统计学信息,包括年龄、性别比例、BMI 以及种族分布情况,为研究结果的分析提供了基础背景信息。
* 公式 1:归一化抗体浓度计算公式
归一化抗体浓度 =(病毒特异性抗体浓度 / 总抗体浓度)× 100
* 公式 2:S1 结合特异性计算公式
S1 结合特异性 = [(平均 RBD 抗体浓度 + 平均 NTD 抗体浓度) / 平均刺突蛋白抗体浓度 ] × 100
* 公式 3:抑制百分比计算公式
抑制百分比 = [1 -(样本 ECL 信号 / 最低 % 中和标准 ECL 信号)] × 100
* 公式 4:AU/mL 抑制百分比计算公式
AU/mL 抑制百分比 = 抑制百分比 / 归一化抗体浓度
| 名称 | 货号 | 规格 |
| V-PLEX Proinflammatory Panel1 (human) Kit (1 Plate) | K15049D-1 | 1Plate |
| V-PLEX Proinflammatory Panel1 (human) Kit (5 Plate) | K15049D-2 | 5Plate |
| V-PLEX Proinflammatory Panel1 (human) Kit (25 Plate) | K15049D-4 | 25Plate |
| RNeasy Mini Kit (250) | 74106 | 250Test |