Immunogenicity and In Vivo Protective Effects of Recombinant Nucleocapsid-Based SARS-CoV-2 Vaccine Convacell®
一、引言
新型冠状病毒(SARS-CoV-2)引发的新冠疫情对全球公共卫生构成重大挑战。尽管目前已有多款疫苗获批或处于研发阶段,但大多数疫苗主要针对病毒的刺突(S)蛋白及其受体结合域(RBD)。然而,S 蛋白在不同变种间存在较大的序列变异,这促使研究人员探索更保守的病毒蛋白作为疫苗靶点,例如核衣壳(N)蛋白。N 蛋白具有高度保守性、免疫原性强以及在感染后能诱导长期免疫记忆等特点,使其成为疫苗研发的新焦点。本文将深入解析一篇关于重组核衣壳基 SARS-CoV-2 疫苗 Convacell® 的研究文献,探讨其免疫原性、体内保护效果以及研发意义。
二、研究背景
现有 COVID-19 疫苗多集中于 S 蛋白,但 S 蛋白的序列变异可能导致免疫逃逸。相比之下,N 蛋白在不同冠状病毒株中高度保守,能诱导长期免疫记忆,且在感染细胞表面的表达使其可能成为抗体依赖性细胞毒性(ADCC)和细胞毒性 T 细胞的靶点。此外,前期研究显示,基于 N 蛋白的疫苗可增强抗 SARS-CoV-2 免疫力,具有成为广谱抗 Sarbecovirus 疫苗的潜力。因此,开发针对 N 蛋白的疫苗对于应对病毒变种具有重要意义。
三、研究方法
(一)疫苗生产与配方
研究者将野生型 SARS-CoV-2 N 蛋白的核苷酸序列优化后克隆入 pET-28b (+) 载体,在大肠杆菌中表达并纯化得到重组 N 蛋白。将重组 N 蛋白与角鲨烷基乳液混合制备成 Convacell® 疫苗,每 0.5 mL 剂量含 50 μg 蛋白 N。角鲨烷基乳液由角鲨烷、(D,L)-α - 生育酚和聚山梨酯 80 组成,可增强疫苗的稳定性与免疫原性。
(二)疫苗稳定性评估
将三批疫苗样本分别储存于 2 - 8℃环境下 0、1、2、3、6、9、12 和 15 个月,定期取样免疫 Balb/c 小鼠,通过 ELISA 法检测小鼠血浆中的 N 特异性抗体,评估疫苗稳定性。
(三)动物实验与伦理
实验涉及多种动物模型,包括 Balb/c 小鼠、NOD SCID gamma(NSG)小鼠、新西兰白兔、普通狨猴和叙利亚仓鼠。所有实验方案均经相关伦理委员会批准。动物随机分组,实验人员在实验过程中对动物进行盲法操作,以确保实验结果的客观性。
(四)免疫原性评估
通过 ELISA 法检测 Convacell® 疫苗免疫小鼠、仓鼠和兔子血清中的 N 特异性 IgG 抗体。使用细胞内因子稀释法(CFSE)和细胞因子滴度分析评估疫苗诱导的细胞免疫反应。
(五)体内保护效果评估
以叙利亚仓鼠为模型,评估 Convacell® 疫苗对 SARS-CoV-2 感染的保护效果。仓鼠接种疫苗后感染 SARS-CoV-2,监测其体重变化、病毒 RNA 浓度、肺组织病理变化等指标。
(六)统计分析
使用 Shapiro - Wilk W 检验评估数据正态分布,根据数据分布情况计算均值和标准差或中位数和四分位数范围。采用双尾非配对 Student’s T 检验或 Mann – Whitney U 检验进行组间比较,以 p < 0.05 为差异具有统计学意义。
四、研究结果
(一)疫苗生产与特性
Convacell® 疫苗中的重组 N 蛋白在 SDS - PAGE 电泳中显示出与预测分子量(45.6 kDa)一致的迁移率,Western blotting 证实其能被 N 特异性抗体识别。MALDI - MS 分析确认重组 N 蛋白的分子量和序列覆盖率达到 96.7%,且未发现氧化修饰和脱酰胺现象。DSC 数据显示重组 N 蛋白在 93℃时寡聚体解离。动态光散射和原生 PAGE 结果表明,重组 N 蛋白在生理条件下以约 13 nm 直径的四聚体形式存在,疫苗乳液中的蛋白颗粒平均直径约为 150 nm。
(二)免疫原性评估
Convacell® 疫苗在小鼠、兔子和叙利亚仓鼠中均能诱导强烈的 N 特异性 IgG 抗体反应,免疫后 14 天即可检测到抗体,且抗体滴度在首次免疫后 21 - 28 天达到峰值,并能持续至实验后期(386 天),显示出良好的可持续性。
(三)细胞免疫反应
在普通狨猴中,Convacell® 疫苗可诱导 N 特异性 CD3 +、CD4 + 和 CD8 + T 细胞反应。免疫后 14 天和 28 天,N 特异性 T 细胞在刺激下增殖,而安慰剂组未检测到 T 细胞增殖。此外,疫苗免疫的 Balb/c 小鼠和 NSG 小鼠显示出混合的 Th1/Th2 细胞因子分泌特征,表现为 IFNγ、IL - 4(小鼠)、IP - 10、IL - 4 和 IL - 5(NSG 小鼠)水平升高。
(四)体内保护效果
在叙利亚仓鼠模型中,与未免疫的感染仓鼠相比,接种 Convacell® 疫苗的仓鼠在感染后体重恢复更快,肺组织中病毒 RNA 浓度降低约一个数量级,肺组织病理变化减轻,肺重量系数未见显著增加,表明疫苗对 SARS-CoV-2 感染具有保护效果。
五、研究讨论
(一)N 蛋白作为疫苗靶点的优势
N 蛋白的高度保守性使其能够对多种冠状病毒变种产生交叉保护作用。与 S 蛋白疫苗相比,N 蛋白疫苗可能减少非应答者数量,并且前期研究表明,联合使用 N 蛋白与其他抗原(如 S 蛋白或 RBD)可增强抗 SARS-CoV-2 免疫力。
(二)Convacell® 疫苗的作用机制
免疫后产生的 IgG 抗体可能通过 ADCC 机制清除感染细胞;诱导的细胞毒性 CD8 + T 细胞有助于消灭表达 N 蛋白的病毒感染细胞;N 特异性抗体可能进入感染细胞,干扰病毒复制。
(三)疫苗的安全性与稳定性
Convacell® 疫苗在小鼠和兔子中的重复剂量毒性研究显示,其安全且耐受性良好,未对器官系统、血液或实验室参数产生影响,仅在注射部位出现局部刺激,这可能与角鲨烷基油佐剂有关。疫苗在 2 - 8℃下至少可稳定储存 1 年。
六、结论
Convacell® 疫苗基于保守的 N 蛋白研发,具有良好的稳定性、强免疫原性和体内保护效果。它诱导了强烈的 N 特异性抗体反应和混合的 Th1/Th2 细胞免疫反应,并在叙利亚仓鼠模型中有效减轻了 SARS-CoV-2 感染引起的疾病症状。尽管其作用机制尚未完全明确,但整体免疫效果和体内保护效果表明 Convacell® 有望成为抗击新冠疫情的新型疫苗,尤其在应对新出现的病毒变种方面具有潜在优势。目前,Convacell® 的临床试验已经启动,以进一步评估其在人体中的安全性和有效性。
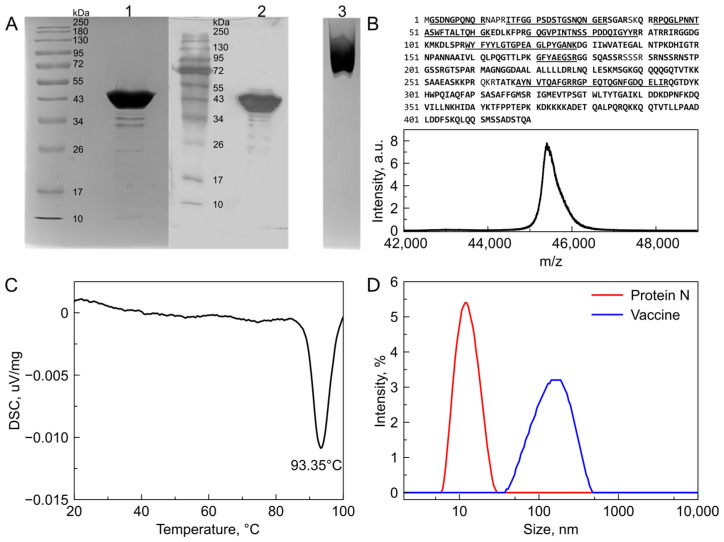
图 1:重组 SARS-CoV-2 N 蛋白的生化表征
(A)SDS - PAGE 和 Western blotting 确认重组 N 蛋白的分子量及被 N 特异性抗体识别的能力。原生 PAGE 显示重组 N 蛋白均匀分布为单一物种。泳道 1 为重组 N 蛋白溶液的 SDS - PAGE;泳道 2 为重组 N 蛋白溶液的 Western blotting;泳道 3 为重组 N 蛋白溶液的原生 PAGE。
(B)MALDI - MS 确认单体重组核衣壳蛋白的预测分子量,达到 96.7% 的序列覆盖率。确认的序列以粗体标记,经 MS/MS 分析的肽段已下划线标出。
(C)差示扫描量热法热图显示 0.2 mg/mL N - 蛋白样品在 93℃处出现明显的放热峰,对应于寡聚体颗粒的熔解。
(D)核衣壳蛋白形成约 13 nm 直径的寡聚体结构,对应的分子量约为 200 kDa,表明四聚体的形成。由角鲨烷、(D,L)-α - 生育酚和聚山梨酯 80 形成的乳液将蛋白暴露在油包水滴上,油包水滴的直径约为 150 nm。
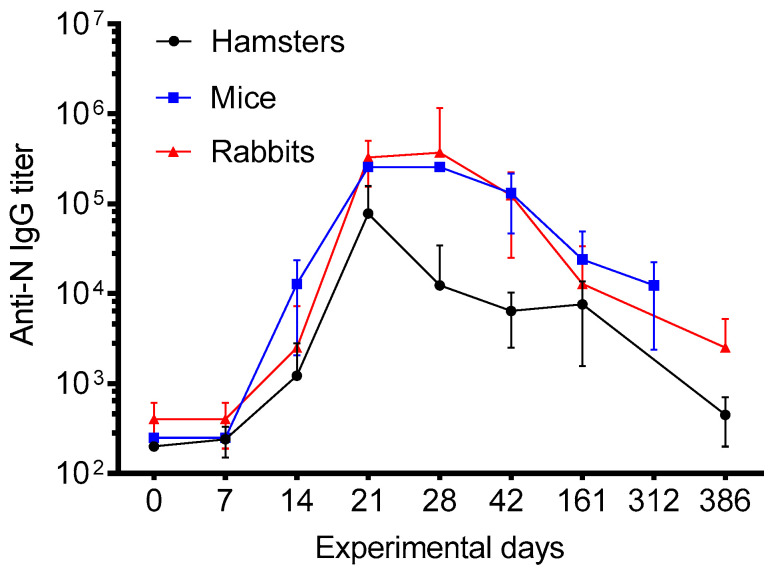
图 2:免疫小鼠、仓鼠和兔子的 N 特异性 IgG 滴度
小鼠、仓鼠和兔子分别在实验第 0 天和第 14 天接受疫苗免疫,通过 ELISA 法在不同时间点检测其血清中的 N 特异性 IgG 抗体滴度。结果显示,Convacell® 疫苗在三种动物模型中均能诱导强烈的 N 特异性 IgG 抗体反应,且抗体滴度在首次免疫后 21 - 28 天达到峰值,并在实验后期(386 天)仍保持较高水平。
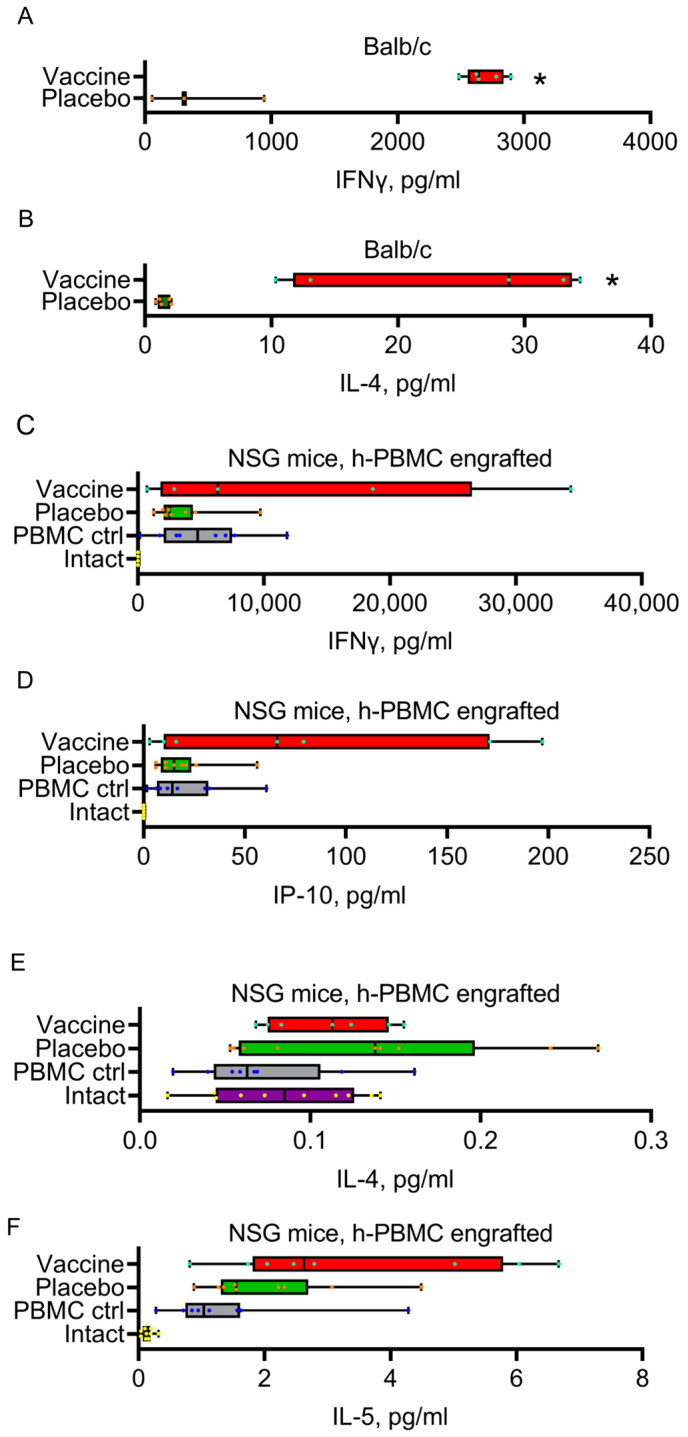
图 3: Convacell® 疫苗免疫小鼠和 NSG 小鼠的细胞因子水平
(A)和(B)分别为 Convacell® 疫苗免疫小鼠的 IFNγ 和 IL - 4 水平;(C) - (F)分别为 Convacell® 疫苗免疫 NSG 小鼠的 IFNγ、IP - 10、IL - 4 和 IL - 5 水平。结果显示,Convacell® 疫苗诱导了混合的 Th1/Th2 细胞因子分泌特征,表明其能激活多种免疫机制。
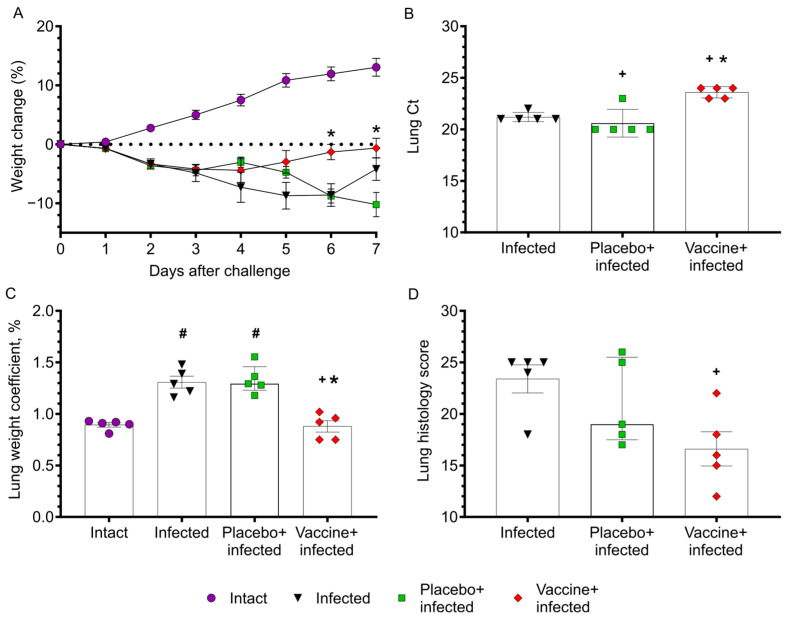
图 4:Convacell® 疫苗在叙利亚仓鼠模型中的保护效果
(A)仓鼠在 SARS-CoV-2 挑战后的体重变化;(B)通过 RT - PCR 测定的病毒 RNA 量;(C)肺重量系数;(D)肺组织病理学评分总和。与未免疫的感染仓鼠相比,接种 Convacell® 疫苗的仓鼠体重恢复更快,肺组织中病毒 RNA 浓度显著降低,肺组织病理变化减轻。
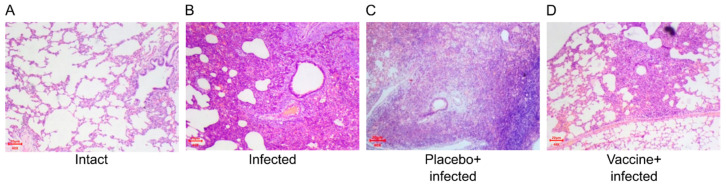
图 5:叙利亚仓鼠肺组织的代表性显微病变图。
(A)为完整动物组;(B)为未免疫感染组;(C)为安慰剂治疗感染组;(D)为疫苗免疫感染组。图中可见,接种 Convacell® 疫苗的仓鼠肺组织炎症、水肿和浸润等病理变化程度较低。
表格 1 :免疫狨猴不同时间点 N 特异性增殖的 CD3 +、CD4 + 和 CD8 + T 细胞百分比
| 动物编号、性别 | 细胞表型 | 免疫后天数 | |||
|---|---|---|---|---|---|
| 0 | 14 | 28 | 35 | ||
| 1,F | CD3 + | - | 0.82 | - | - |
| CD3 + CD4 + CD8 - | - | 0.63 | - | - | |
| CD3 + CD4 - CD8 + | - | 0.54 | 0.55 | - | |
| 2,M | CD3 + | - | - | 0.57 | - |
| CD3 + CD4 + CD8 - | - | - | - | - | |
| CD3 + CD4 - CD8 + | - | - | - | - | |
| 3,M | CD3 + | - | 0.76 | 0.90 | - |
| CD3 + CD4 + CD8 - | - | 1.07 | 0.81 | - | |
| CD3 + CD4 - CD8 + | - | - | 0.52 | - | |
| 4,F | CD3 + | - | 0.71 | - | - |
| CD3 + CD4 - CD8 + | - | 1.09 | - | - |
注:值 < 0.5% 视为低于截止值。表格展示了 Convacell® 疫苗免疫狨猴后不同时间点外周血单个核细胞中增殖的 N 特异性 T 细胞亚群百分比,表明疫苗能诱导 N 特异性 CD3 +、CD4 + 和 CD8 + T 细胞反应。
| 名称 | 货号 | 规格 |
| V-PLEX Proinflammatory Panel1 (human) Kit (1 Plate) | K15049D-1 | 1Plate |
| V-PLEX Proinflammatory Panel1 (human) Kit (5 Plate) | K15049D-2 | 5Plate |
| V-PLEX Proinflammatory Panel1 (human) Kit (25 Plate) | K15049D-4 | 25Plate |
| RNeasy Mini Kit (250) | 74106 | 250Test |








