Coxsackievirus infection induces direct pancreatic β-cell killing but poor anti-viral CD8+ T-cell responses
一、引言
1型糖尿病(T1D)是一种自身免疫性疾病,其特征是胰岛β细胞被自身免疫系统破坏,导致胰岛素分泌不足。环境因素在T1D的发病机制中起着重要作用,其中柯萨奇病毒B型(CVB)感染被认为可能是触发因素之一。CVB感染与T1D之间的关联已经得到了一些流行病学研究的支持,但具体的分子机制尚不清楚。本文将深入解析一篇关于CVB感染对胰岛β细胞影响以及抗CVB特异性CD8+ T细胞应答的研究文献,探讨其在T1D发病中的作用和意义。
二、研究背景
CVB感染与T1D的发病存在时间上的相关性,且在一些T1D患者的胰腺组织中检测到了CVB的分子标记。此外,CVB感染在婴幼儿中较为常见,这与T1D的发病年龄相符。然而,CVB感染如何引发β细胞自身免疫以及抗病毒T细胞应答在其中扮演的角色仍然不明确。本研究旨在通过体外和体内实验,揭示CVB感染对β细胞的影响以及机体对CVB的免疫应答特点。
三、研究方法
(一)细胞培养与病毒感染
研究中使用了人源ECN90 β细胞系进行CVB感染实验。细胞在含有特定营养成分的培养基中培养,并在感染前用纤维连接蛋白和细胞外基质进行包被。CVB1和CVB3病毒株在HeLa细胞中扩增,经过冻融和超速离心后制备病毒 stocks,并用于感染ECN90 β细胞。感染后,细胞经过一系列处理,包括流式细胞术检测感染效率和细胞死亡情况,以及收集细胞用于后续的免疫肽组学分析。
(二)免疫肽组学分析
从CVB感染的β细胞中提取HLA-I复合物,并通过质谱分析鉴定与HLA-I结合的病毒肽。使用PEAKS 8.1软件对质谱数据进行分析,筛选出长度为8至12个氨基酸的病毒肽,并通过在线数据库和自建数据库进行序列比对,以确定这些肽段是否与CVB或其他β细胞抗原具有同源性。
(三)T细胞表型分析
利用多重HLA-I单体(MMr)技术,检测CVB感染后外周血单个核细胞(PBMCs)中特异性识别CVB肽的CD8+ T细胞。通过流式细胞术分析这些T细胞的频率、表型(包括效应/记忆表型和耗竭标记PD-1的表达)以及T细胞受体(TCR)的克隆重测序。
(四)细胞毒性实验
通过实时成像技术,观察CVB感染β细胞的死亡过程以及CVB特异性CD8+ T细胞对感染β细胞的杀伤作用。实验中使用了不同感染复数(MOI)和T细胞与β细胞比例,以评估CVB直接杀伤与T细胞介导杀伤的相对贡献。
四、研究结果
(一)CVB感染β细胞导致HLA-I表达下调和有限病毒肽呈递
CVB感染ECN90 β细胞后,细胞表面HLA-I表达显著下调,这一现象在感染后6小时即可观察到。通过免疫肽组学分析,在CVB感染的β细胞中鉴定出16个独特的CVB肽段,这些肽段占总鉴定肽段的2.9%,且大部分来源于CVB的非结构蛋白P2区域。此外,这些肽段在不同CVB血清型之间具有较高的保守性,并且在CVB1和CVB3感染的细胞中呈现出较高的重叠度。
(二)CVB特异性CD8+ T细胞应答有限
在CVB血清阳性健康成年人的PBMCs中,通过MMr技术检测到针对CVB肽的CD8+ T细胞应答,但其频率较低。大多数CVB特异性CD8+ T细胞表现出较低的效应/记忆表型,且在多数供体中,这些T细胞的频率低于10^{-5}。此外,CVB特异性CD8+ T细胞显示出较高的PD-1表达,表明其可能存在功能耗竭现象。在儿童供体中也观察到了类似的CD8+ T细胞应答模式,表明这种有限的免疫应答并非由于成人的长期免疫记忆衰退所致。
(三)CVB特异性CD8+ T细胞在组织中的分布和表型特征
在胰腺组织、脾脏和胰腺淋巴结(PLN)中均检测到了CVB特异性CD8+ T细胞,其中在PLN中这些T细胞的效应/记忆比例高于外周血。此外,CVB特异性CD8+ T细胞在T1D供体的PLN中显示出更高的PD-1+CD25−表型,这可能反映了这些细胞在慢性病毒感染中的耗竭状态。
(四)CVB感染β细胞的死亡机制
实时成像实验显示,CVB感染导致β细胞死亡的主要机制是病毒直接引起的细胞裂解,而非CVB特异性CD8+ T细胞的杀伤作用。CVB感染的β细胞通过形成丝状突起(filopodia)传播感染,这一过程可能有助于病毒在细胞间的扩散并逃避免疫监视。尽管CVB特异性CD8+ T细胞能够识别并杀死感染的β细胞,但在实验条件下,其杀伤作用仅在较高的T细胞与β细胞比例下才变得显著,且在低MOI感染条件下,CVB直接引起的细胞死亡仍然占主导地位。
五、研究讨论
(一)CVB感染对β细胞的影响
CVB感染β细胞后,不仅直接导致细胞死亡,还通过下调HLA-I表达减少了病毒肽的呈递,从而逃避免疫监视。此外,CVB通过形成丝状突起在细胞间传播,这可能进一步促进了病毒在胰腺组织中的扩散。这些机制共同作用,使得CVB能够在β细胞中持续存在并引发病理变化。
(二)抗病毒CD8+ T细胞应答的特点及意义
研究发现,CVB特异性CD8+ T细胞应答相对较弱,且存在功能耗竭现象。这种有限的抗病毒免疫应答可能不足以有效清除CVB感染,从而增加了病毒在β细胞中的持续存在和传播风险。CVB特异性CD8+ T细胞在胰腺相关淋巴组织中的富集表明,这些细胞可能在局部发挥一定的免疫监视作用,但其整体效应仍受到限制。
(三)对T1D发病机制的启示
CVB感染可能通过直接杀伤β细胞以及引发自身免疫反应共同促进T1D的发生。由于CVB特异性CD8+ T细胞应答较弱,无法有效清除感染的β细胞,持续的病毒感染可能导致β细胞反复受损,进而释放自身抗原,引发自身免疫反应。此外,CVB肽与β细胞自身抗原GAD之间存在交叉反应性,这可能进一步加剧自身免疫过程。
六、结论
本研究通过深入分析CVB感染β细胞后的免疫应答和细胞死亡机制,揭示了CVB在T1D发病中的潜在作用。研究发现CVB感染能够直接导致β细胞死亡,并且机体对CVB的CD8+ T细胞应答相对有限,这可能为T1D的免疫干预提供了新的视角。尽管CVB特异性CD8+ T细胞能够识别并杀死感染的β细胞,但其效果有限,且主要由病毒直接引起的细胞死亡占主导地位。这些发现为未来开发针对CVB的疫苗或抗病毒疗法以预防T1D提供了重要的科学依据。
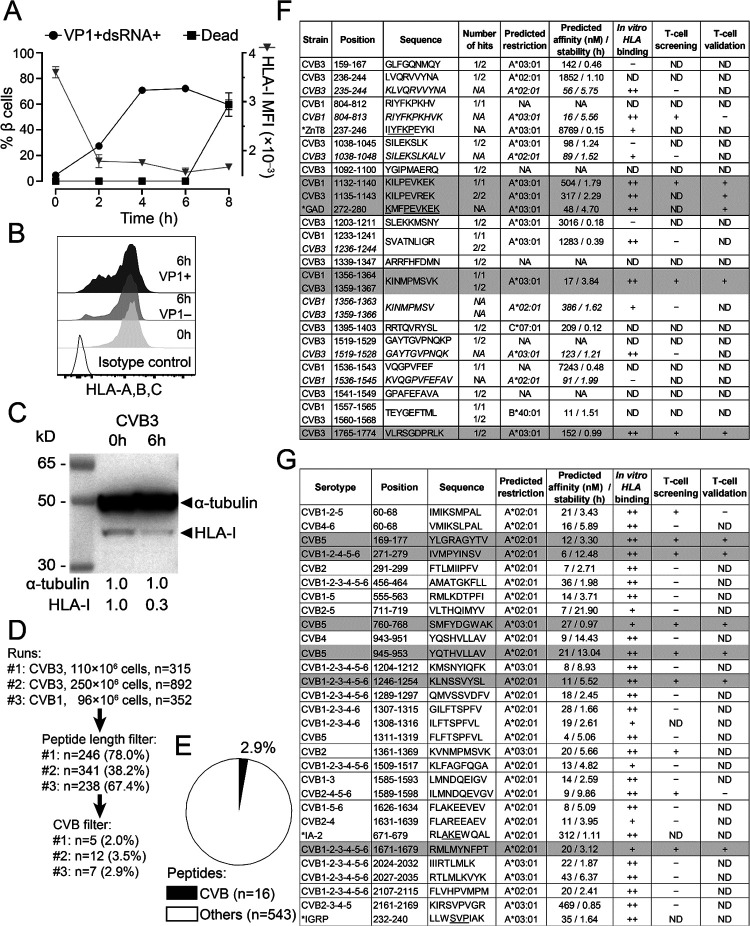
图1:CVB感染β细胞后HLA-I表达下调及病毒肽呈递情况
(A)流式细胞术检测CVB3感染ECN90 β细胞后VP1/dsRNA表达、细胞死亡情况及HLA-I中位荧光强度变化。
(B和C)流式细胞术检测CVB感染6小时后β细胞HLA-I表达情况,包括HLA-I阳性细胞百分比和中位荧光强度。
(D)免疫肽组学实验流程图,展示从CVB感染的β细胞中提取HLA-I复合物、肽段洗脱、质谱分析及数据处理的步骤。
(E)CVB感染β细胞中鉴定出的CVB肽段占总鉴定8至12氨基酸肽段的百分比。
(F)CVB感染β细胞中鉴定出的病毒肽序列及其在CVB多蛋白中的映射位置,其中标记了与β细胞自身抗原GAD具有同源性的肽段。
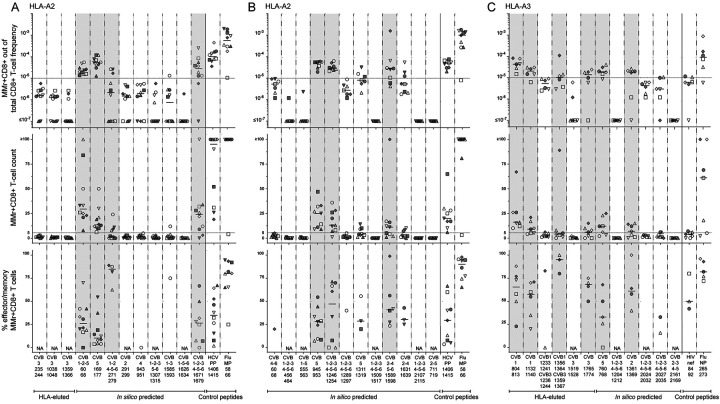
图2:CVB特异性CD8+ T细胞应答的筛选结果
(A至C)HLA-A2限制性(A和B)和HLA-A3限制性(C)候选肽段的MMr检测结果。每个符号代表一名供体,横线表示中位值。上图显示MMr+CD8+ T细胞占总CD8+ T细胞的频率,中间图显示MMr+CD8+ T细胞计数,下图显示效应/记忆表型CD8+ T细胞占MMr+CD8+ T细胞的比例。验证阶段保留的肽段以灰色突出显示。
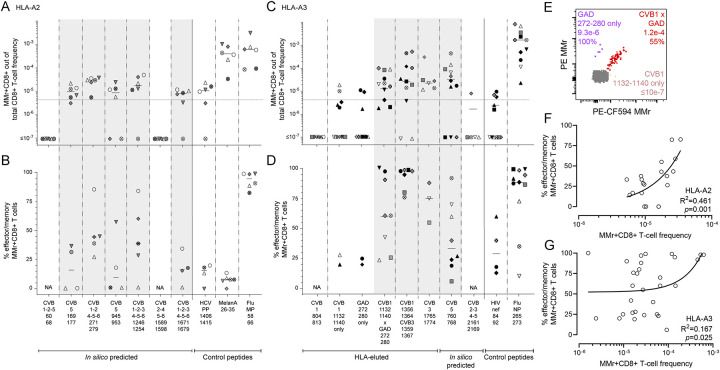
图3:CVB特异性CD8+ T细胞应答的验证结果
(A至D)HLA-A2限制性(A和B)和HLA-A3限制性(C和D)肽段的验证结果。每个符号代表一名供体,横线表示中位值。上图显示MMr+CD8+ T细胞占总CD8+ T细胞的频率,下图显示效应/记忆表型CD8+ T细胞占MMr+CD8+ T细胞的比例。验证阶段保留的肽段以灰色突出显示。
(E)CVB11132–1140与GAD272–280交叉反应性T细胞的检测结果,显示大多数T细胞同时识别这两种肽段。
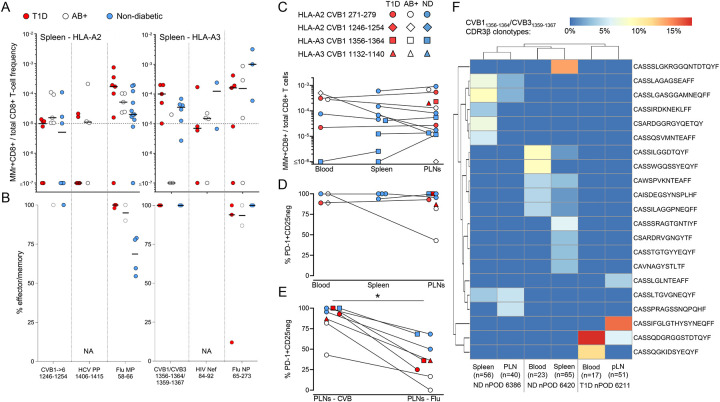
图4:CVB特异性CD8+ T细胞在不同组织中的分布和表型特征
(A和B)nPOD器官供体脾脏中CVB特异性CD8+ T细胞的频率(A)和效应/记忆表型比例(B)。
(C)nPOD器官供体不同组织中CVB特异性CD8+ T细胞的频率。
(D)nPOD器官供体不同组织中PD-1+CD25−表型CVB特异性CD8+ T细胞的比例。
(E)CVB特异性CD8+ T细胞与流感病毒特异性CD8+ T细胞在PLN中PD-1+CD25−表型的比较。
(F)CVB特异性CD8+ T细胞在不同组织中的TCR CDR3β克隆重测序结果,显示扩增的克隆重在不同组织中存在重叠。
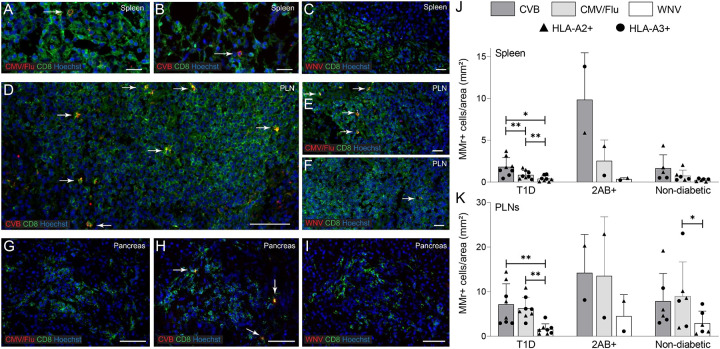
图5:CVB感染β细胞的死亡机制
(A和B)实时成像显示CVB3-eGFP感染ECN90 β细胞后的细胞死亡模式,(A)为病毒直接引起的单个细胞死亡,(B)为CVB特异性CD8+ T细胞介导的细胞团死亡。
(C)不同MOI和T细胞与β细胞比例下CVB引起的死亡(上)和T细胞引起的死亡(下)的百分比。
(D)在最后24小时内CVB引起的死亡与T细胞引起的死亡之间的相关性。
(E)低MOI感染协议,展示ECN90 β细胞在不同MOI下感染CVB-eGFP后的处理流程。
(F至H)低MOI感染条件下,CVB感染β细胞的感染情况(F)、细胞存活率(G)和HLA-I表达(H)随时间的变化。
(I和J)在低MOI感染条件下,CVB特异性TCR转导CD8+ T细胞对β细胞的杀伤效果,分别显示T细胞介导的死亡(I)和PPI特异性T细胞介导的死亡(J)。
(K)不同MOI下IFN-γ分泌情况。
表格1 :CVB感染β细胞后鉴定出的病毒肽段信息
| 肽段编号 | 肽段序列 | 来源CVB蛋白区域 | 鉴定次数 | HLA限制性 | 预测结合亲和力(nM) | 与β细胞抗原同源性 |
|---|---|---|---|---|---|---|
| 1 | GLFGQNMQY | P1(VP1) | 3 | HLA-A2 | 142 | 无 |
| 2 | LVQRVVYNA | P1(VP1) | 2 | HLA-A2 | 1852 | 无 |
| 3 | KLVQRVVYNA | P1(VP1) | 1 | HLA-A2 | 56 | 无 |
| 4 | RIYFKPKHV | P3(3A) | 1 | HLA-A3 | 16 | 无 |
| 5 | SILEKSLK | P2(2C) | 2 | HLA-A3 | 98 | 无 |
| 6 | YGIPMAERQ | P2(2C) | 1 | HLA-A3 | 317 | 无 |
| 7 | SLEKKMSNY | P2(2C) | 1 | HLA-A3 | 3016 | 无 |
| 8 | KINMPMSVK | P2(2C) | 1 | HLA-A3 | 17 | 与GAD272–280交叉反应 |
注:表格列出了CVB感染β细胞后通过免疫肽组学鉴定出的部分病毒肽段信息,包括肽段序列、来源CVB蛋白区域、鉴定次数、HLA限制性、预测结合亲和力以及与β细胞抗原的同源性。这些肽段是CVB特异性CD8+ T细胞识别的潜在靶点,其中部分肽段与β细胞自身抗原GAD存在交叉反应性。
| 名称 | 货号 | 规格 |
| V-PLEX Proinflammatory Panel1 (human) Kit (1 Plate) | K15049D-1 | 1Plate |
| V-PLEX Proinflammatory Panel1 (human) Kit (5 Plate) | K15049D-2 | 5Plate |
| V-PLEX Proinflammatory Panel1 (human) Kit (25 Plate) | K15049D-4 | 25Plate |
| RNeasy Mini Kit (250) | 74106 | 250Test |








