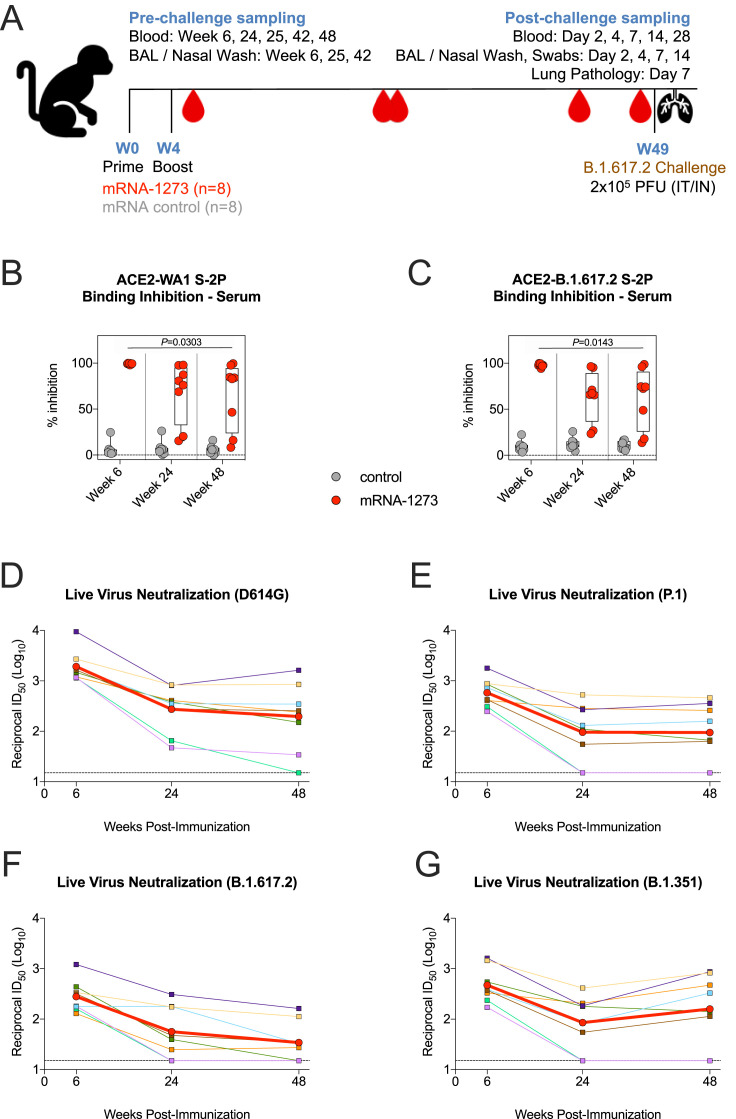
Protection from SARS-CoV-2 Delta one year after mRNA-1273 vaccination in rhesus macaques coincides with anamnestic antibody response in the lung
一、引言
自新冠疫情爆发以来,多种疫苗被开发用于抵御新冠病毒(SARS-CoV-2),其中mRNA-1273疫苗是一种基于信使RNA(mRNA)技术的疫苗。该文献主要研究了mRNA-1273疫苗在猕猴体内接种一年后对B.1.617.2(即Delta)株的保护效果及其免疫机制。通过动物模型实验,深入探讨了疫苗接种后免疫反应的持久性以及对变异株的保护作用,这对于理解疫苗在现实世界中的长期效果和指导疫苗接种策略具有重要意义。
二、研究背景
1.疫苗介绍
mRNA-1273疫苗是一种通过编码新冠病毒刺突(S)蛋白来诱导免疫反应的mRNA疫苗。其在临床试验中表现出较高的有效性,但随着新冠病毒的不断变异,尤其是B.1.617.2(Delta)等变异株的出现,对疫苗防护效果的影响引起了广泛关注。
2.研究目的
本研究旨在评估mRNA-1273疫苗在猕猴体内接种一年后对B.1.617.2变异株的保护作用,并探讨其免疫机制,特别是肺部的免疫记忆反应。
三、研究方法
1.动物模型及分组
研究使用了印度猕猴(Macaca mulatta)作为动物模型。实验动物被分为两组:一组接种mRNA-1273疫苗(100mg),另一组作为对照组接种mRNA对照制剂,分别于第0周和第4周进行两次免疫。
2.免疫反应检测
-
血清中和抗体滴度:通过活病毒中和实验和慢病毒假病毒中和实验,检测血清对B.1.617.2及其相关变异株的中和抗体滴度。
-
IgG结合抗体滴度:采用酶联免疫吸附试验(ELISA)检测血清、支气管肺泡灌洗液(BAL)和鼻洗液中针对病毒受体结合域(RBD)的IgG结合抗体滴度。
-
抗体亲和力测定:通过ELISA法测定抗体亲和力指数,以评估抗体的成熟程度。
-
表位特异性分析:利用表面等离子共振(SPR)技术,对血清抗体的表位特异性进行分析,识别针对B.1.617.2的中和表位。
-
记忆B细胞和T细胞反应:通过细胞内细胞因子染色和流式细胞术,检测记忆B细胞和T细胞(包括CD4+ T细胞和CD8+ T细胞)的反应。
3.病毒挑战及病毒载量测定
-
病毒挑战实验:在最后一次免疫后约49周,对猕猴进行B.1.617.2病毒的鼻内和气管内挑战。
-
病毒载量测定:通过qRT-PCR检测支气管肺泡灌洗液(BAL)和鼻拭子中的病毒RNA载量,以及通过组织培养感染剂量(TCID50)实验测定病毒的感染性。
4.组织病理学分析
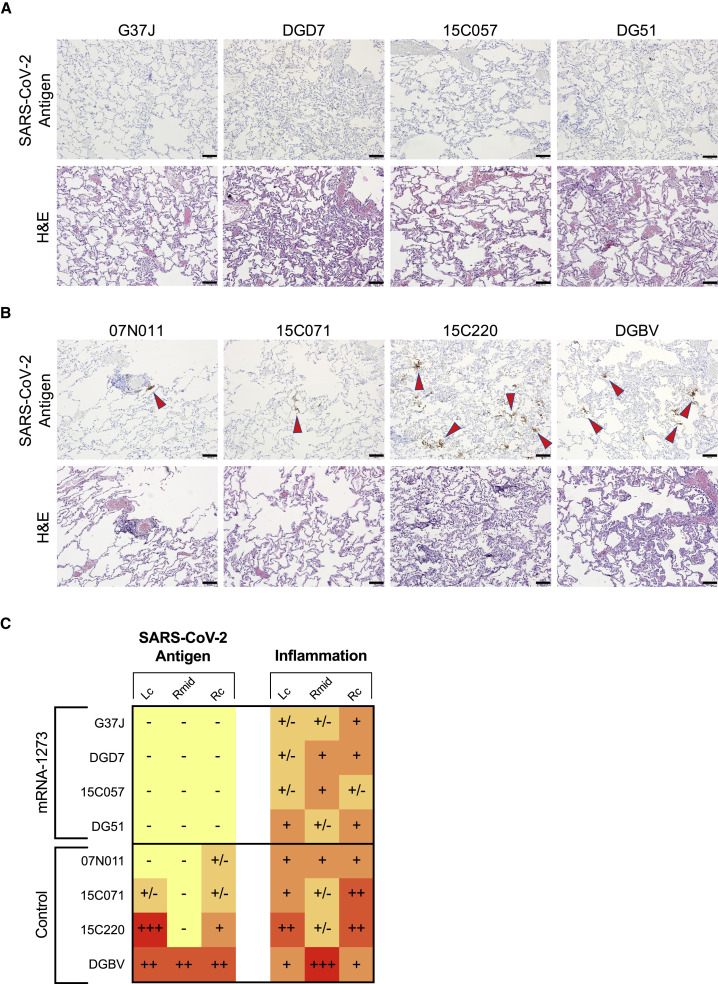
对挑战后7天的猕猴肺组织样本进行组织病理学分析和免疫组化染色,评估肺部炎症和病毒抗原的分布。
四、研究结果
1.血清中和抗体和结合抗体滴度的变化
-
中和抗体滴度:在接种后第6周,血清对B.1.617.2的中和抗体滴度较高(GMT为1,900),但随时间逐渐下降,至第48周(挑战前)滴度显著降低至200(图1E)。慢病毒假病毒中和实验也显示了类似的趋势,第6周针对B.1.617.2的中和GMT为6.9倍降低,至第48周进一步下降。
-
结合抗体滴度:血清中针对WA1 S-2P的IgG结合抗体滴度在第6周达到3,000 WHO International Standard binding antibody units/mL,至第48周下降至188 BAU/mL(图1A)。针对B.1.617.2 RBD的结合抗体滴度在第6周为3.7×10^11 AUC,至第48周下降至1.2×10^9 AUC(图1C)。BAL中的抗体滴度也呈现显著下降趋势,而鼻洗液中的抗体滴度相对稳定。
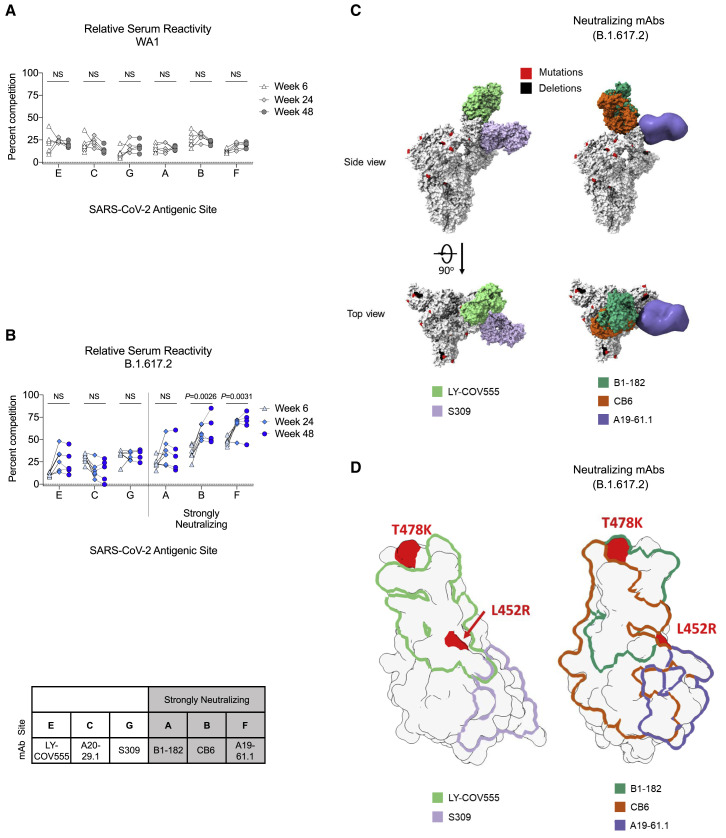
2.表位特异性抗体反应
血清抗体的表位特异性分析显示,尽管抗体滴度随时间下降,但针对B.1.617.2 RBD的抗体表位特异性发生了变化。特别是针对与中和相关的表位(如B.1.617.2 RBD的B和F表位)的抗体比例从第6周到第48周显著增加(B表位:p=0.0026;F表位:p=0.0031)(图2B)。这表明抗体反应的成熟和聚焦,可能提高了抗体的中和能力。
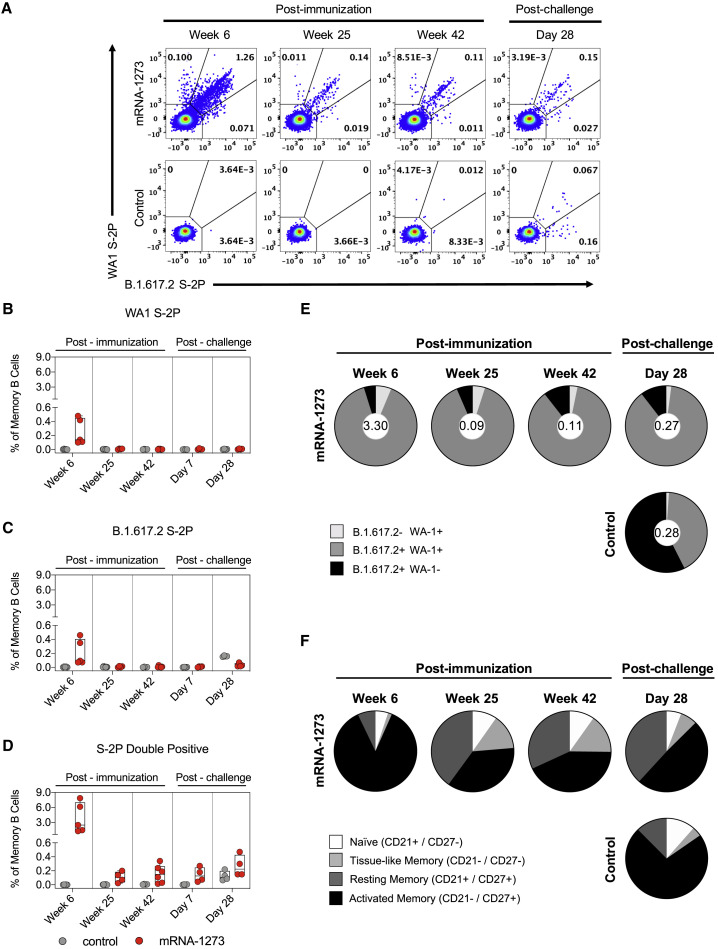
3.记忆B细胞和T细胞反应
-
记忆B细胞:mRNA-1273疫苗接种后,猕猴体内产生了能够同时结合WA1和B.1.617.2 S-2P的记忆B细胞,且这些记忆B细胞在接种后一年仍能被检测到(图4B-D)。在病毒挑战后,这些记忆B细胞显示出快速的扩增和抗体反应,表明其在疫苗诱导的长期免疫记忆中发挥了关键作用。
-
T细胞反应:在血液和BAL中检测到了S特异性TH1细胞和TFH细胞,但随着免疫时间的延长,T细胞反应也有所减弱(图5A-E)。在病毒挑战后,TH1和CD8+ T细胞反应有所增加,但与对照组相比差异不显著。
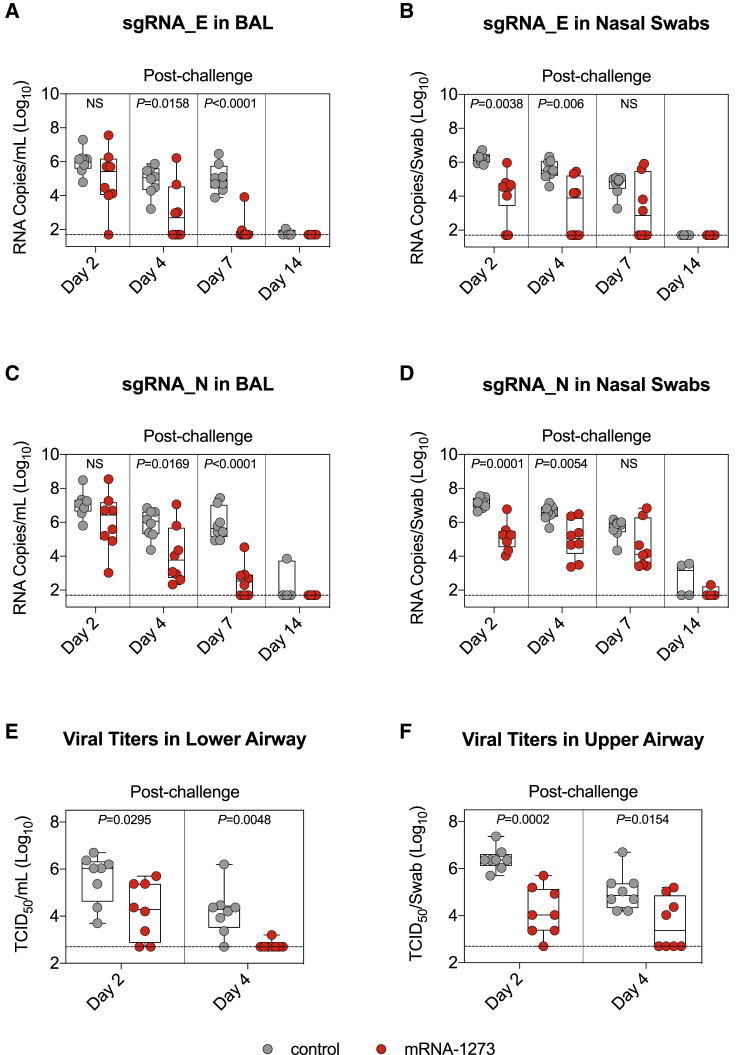
4.病毒挑战后的保护效果
-
肺部保护:在病毒挑战后第4天,疫苗组猕猴的BAL中病毒已不可培养,且亚基因组RNA(sgRNA)水平比对照组低3个对数级(图6A)。同时,BAL中检测到了明显的回忆性抗体反应(590倍的抗体滴度增加),而T细胞反应相对有限(图6E)。
-
上呼吸道保护:在鼻拭子中,疫苗组猕猴的sgRNA水平仅比对照组低1个对数级(图6B),且病毒仍具有感染性(图6F),表明上呼吸道的保护效果有限。
5.组织病理学分析
疫苗组猕猴的肺组织病理变化较轻,未检测到SARS-CoV-2 N抗原(图7A),而对照组猕猴的肺组织中检测到了病毒抗原,并且炎症更为严重(图7B和7C)。
五、研究结论
mRNA-1273疫苗在接种一年后对猕猴的下呼吸道提供了良好的保护,这主要依赖于肺部的回忆性抗体反应,但这种保护是延迟的,并且上呼吸道的保护效果有限。研究结果表明,随着时间的推移,体内的中和抗体滴度和结合抗体滴度逐渐下降,尽管记忆B细胞和T细胞反应仍然存在,但对于上呼吸道的保护可能不足以完全阻止病毒感染和传播。因此,研究强调了加强针接种的重要性,以维持对变异株的高效保护,限制轻度感染和病毒传播。
六、研究局限性
-
病毒挑战剂量:研究中使用的病毒挑战剂量可能与自然感染中的病毒暴露量存在差异,这可能影响对疫苗保护效果的评估。
-
动物模型的适用性:猕猴模型可能不能完全模拟人类对新冠病毒的感染和免疫反应,因此研究结果在人类中的外推需要谨慎。
-
疫苗剂量探索不足:研究未详细探讨不同剂量的mRNA-1273疫苗对免疫反应的影响,这可能限制了对疫苗剂量-反应关系的理解。
七、总结与展望
本研究通过在猕猴模型中评估mRNA-1273疫苗接种一年后对B.1.617.2变异株的保护效果,揭示了疫苗诱导的免疫反应的持久性和保护机制。研究结果对于理解mRNA疫苗在面对新冠病毒变异株时的长期保护效果具有重要意义,并强调了加强针接种的必要性。未来的研究可以进一步探索如何通过疫苗设计和接种策略优化免疫反应,以提高对变异株的广谱保护效果。
补充数据与图表
图1:血清中和抗体和结合抗体滴度的变化
-
图1A:血清中针对WA1 S-2P的IgG结合抗体滴度在第6周达到峰值,随后逐渐下降。
-
图1C:针对B.1.617.2 RBD的IgG结合抗体滴度在第6周为3.7×10^11 AUC,至第48周下降至1.2×10^9 AUC。
-
图1E:血清对D614G的中和抗体滴度在第6周为1,900,至第48周下降至200。
图2:表位特异性抗体反应
-
图2B:针对B.1.617.2 RBD的B和F表位的抗体比例从第6周到第48周显著增加(B表位:p=0.0026;F表位:p=0.0031)。
图4:记忆B细胞反应
-
图4B-D:mRNA-1273疫苗接种后,猕猴体内产生了能够同时结合WA1和B.1.617.2 S-2P的记忆B细胞,且这些记忆B细胞在接种后一年仍能被检测到。
图6:病毒挑战后的保护效果
-
图6A:在病毒挑战后第4天,疫苗组猕猴的BAL中病毒已不可培养,且sgRNA_E水平比对照组低3个对数级。
-
图6B:在鼻拭子中,疫苗组猕猴的sgRNA_E水平仅比对照组低1个对数级。
图7:组织病理学分析
-
图7A:疫苗组猕猴的肺组织病理变化较轻,未检测到SARS-CoV-2 N抗原。
-
图7B:对照组猕猴的肺组织中检测到了病毒抗原,并且炎症更为严重。
| 名称 | 货号 | 规格 |
| Series S Sensor Chip CM5, 10-pack | 29149603 | 10片 |
| V-PLEX Proinflammatory Panel1 (human) Kit (5 Plate) | K15049D-2 | 5Plate |
| V-PLEX Proinflammatory Panel1 (human) Kit (25 Plate) | K15049D-4 | 25Plate |