Vaccine protection against the SARS-CoV-2 Omicron variant in macaques
摘要
本文基于Barouch团队在Cell发表的研究(DOI: 10.1016/j.cell.2022.03.024),通过猕猴模型系统评估了BNT162b2(mRNA疫苗)与Ad26.COV2.S(腺病毒载体疫苗)同源/异源加强策略对SARS-CoV-2 Omicron变异株(B.1.1.529)的防护效能。研究揭示了中和抗体逃逸背景下T细胞免疫的关键补偿作用,并首次量化了疫苗平台差异对免疫应答广度的影响。以下从实验设计、免疫应答特征、保护效能及机制三方面展开分析。
一、实验设计与方法学创新
1. 动物模型与免疫策略
-
研究对象:30只成年食蟹猴(Macaca mulatta),分5组(n=6/组):
组别 免疫方案 加强策略 BNTx3组 第0/3周BNT162b2 ×2 + 第14周BNT162b2 同源加强 BNTx2/Ad26组 第0/3周BNT162b2 ×2 + 第14周Ad26.COV2.S 异源加强 Ad26/BNT组 第0周Ad26.COV2.S + 第14周BNT162b2 异源加强 Ad26x2组 第0周Ad26.COV2.S + 第14周Ad26.COV2.S 同源加强 Sham组 安慰剂对照 - -
攻毒实验:第19周经鼻内/气管内途径接种10⁶ PFU Omicron毒株(GISAID ID: EPI_ISL_7171744),监测第2/4/7天上呼吸道(鼻拭子NS)与下呼吸道(支气管肺泡灌洗液BAL)病毒载量。
2. 多维度免疫评估技术
- 抗体应答:
- 假病毒中和试验:量化WA1/2020、Delta、Omicron中和抗体(NAb)滴度(ID₅₀)
- 电化学发光法(ECLA):检测多变异株RBD结合抗体(图1B)
- 细胞免疫:
- 胞内细胞因子染色(ICS):分析IFN-γ⁺ CD8⁺/CD4⁺ T细胞频率
- B细胞亚群分型:流式检测记忆B细胞(CD20⁺IgG⁺CD27⁺)与生发中心B细胞(GC B细胞:CD20⁺IgD⁻IgG⁺Ki67⁺Bcl6⁺)
- 病毒学检测:
- 亚基因组RNA(sgRNA)定量:RT-PCR检测E基因sgRNA(病毒复制标志)
- TCID₅₀试验:量化感染性病毒滴度
二、免疫应答特征:平台依赖性差异
1. 抗体应答的变异株逃逸现象
-
中和抗体(NAb)衰减:
加强免疫后(第18周),Omicron NAb滴度较WA1/2020下降9-23倍(图2A):组别 WA1/2020 NAb(中位数) Omicron NAb(中位数) 衰减倍数 BNTx3 19,901 1,901 10.5× Ad26x2 2,215 168 13.2× 公式:衰减倍数 = WA1 NAb滴度 / Omicron NAb滴度
-
结合抗体广度:
ELISA显示Omicron RBD结合抗体滴度下降8-17倍(图2B),但异源加强组(BNTx2/Ad26)对Delta/Beta/Omicron的交叉反应优于同源组(ECLA数据,图S1)。
2. T细胞应答的交叉保护优势
-
CD8⁺ T细胞应答:
Ad26平台诱导更强Omicron特异性IFN-γ⁺ CD8⁺ T细胞(图3A):- Ad26/BNT组:0.034% (WA1/2020:0.031%)
- BNTx3组:0.012% (WA1/2020:0.015%)
提示腺病毒载体更有效激活细胞免疫
-
CD4⁺ T细胞应答:
所有疫苗组对Omicron的CD4⁺ T细胞反应与WA1/2020相当(图3B),表明T细胞表位保守性高于抗体表位。
3. 生发中心(GC)反应的平台差异
- mRNA疫苗:诱导高频率RBD特异性GC B细胞(LN活检,图S2A)
- 腺病毒疫苗:优先激活CD8⁺ T细胞(图3A),但GC反应较弱(Ad26x2组GC B细胞频率↓40% vs BNTx3)
三、保护效能与免疫相关性
1. 病毒载量控制
- 下呼吸道(BAL):
所有疫苗组第2天病毒载量较Sham组下降1.46-3.21倍(p<0.01),第4天基本清除(图4A)。 - 上呼吸道(NS):
异源加强组(BNTx2/Ad26、Ad26/BNT)第4天载量显著降低(p<0.01),但4只动物(2只BNTx3 + 2只BNTx2/Ad26)出现持续病毒复制(图4B)。
2. 免疫保护相关性分析
-
失败案例的免疫特征:
4例病毒控制失败动物表现为:- 中度Omicron NAb(586-1,434)
- 极低Omicron CD8⁺ T细胞(0.001%-0.006%)
- 免疫空间定位:低NAb + 低CD8⁺ T细胞区域(图6)
-
成功保护的双重基础:
- NAb ≥1,500 或 CD8⁺ T细胞 ≥0.01% 的动物均实现病毒清除(图6)
- 数学模型验证:
(NAb单位:ID₅₀;CD8⁺单位:%)
3. 组织病理学证据
- Omicron感染特征:
未接种组出现上呼吸道淋巴增生(图S6A-C)及肺间质炎症(图S6D-K),但病理评分低于WA1/2020感染(p=0.0054)。 - 疫苗保护效果:
接种组肺部病理损伤轻微,与病毒载量下降一致。
四、机制讨论:超越中和抗体的保护
1. 抗体与T细胞的协同模式
-
互补关系:
当NAb不足时(如Omicron),CD8⁺ T细胞通过清除感染细胞补偿保护(图5):
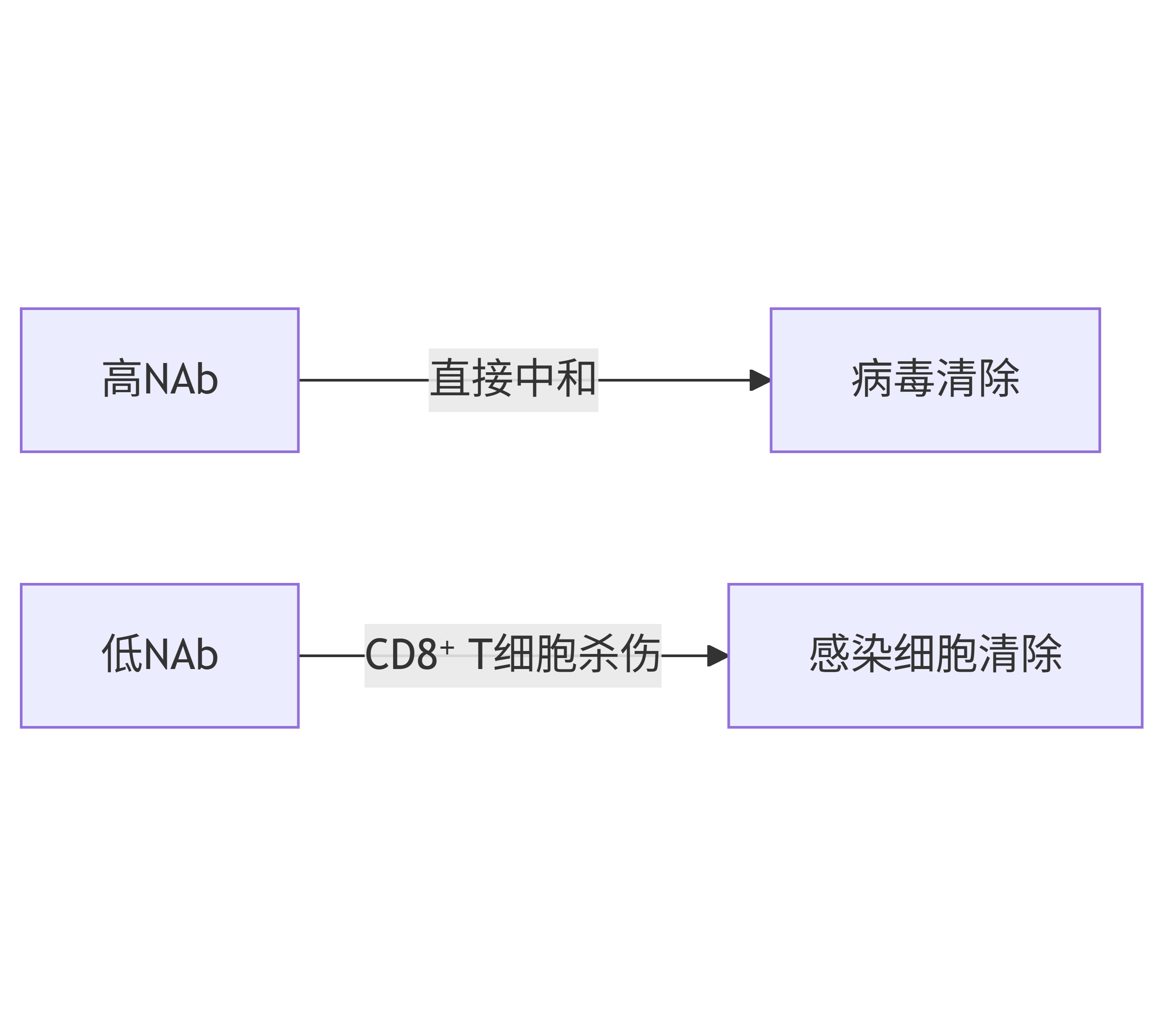
-
平台特性:
- mRNA疫苗(BNT162b2):强抗体应答 + 中等T细胞应答
- 腺病毒疫苗(Ad26.COV2.S):中等抗体应答 + 强T细胞应答
异源策略(如Ad26/BNT)可能整合双重优势
2. 临床意义的转化
- 上呼吸道持久性:
Omicron在鼻黏膜复制持续时间长于早期毒株(Sham组第7天NS载量仍达3.85 log sgRNA/swab),解释其高传播性。 - 疫苗有效性数据支持:
南非真实世界研究显示:- BNT162b2:70%防住院(Collie et al.)
- Ad26.COV2.S:85%防住院(Gray et al.)
与本研究猕猴模型保护率一致
五、研究局限与未来方向
局限性
- 模型差异:猕猴感染症状轻于人类,未评估重症保护
- 样本量:淋巴结样本有限(n=7/组)
- 未探索非中和抗体:Fc效应功能可能参与保护
未来方向
- 优化加强策略:Omicron特异性mRNA疫苗设计
- 黏膜免疫研究:鼻喷疫苗阻断上呼吸道感染
- 长效保护机制:GC反应与记忆T细胞维持
结论
本研究揭示:
- 双重免疫机制:面对Omicron的抗体逃逸,CD8⁺ T细胞是疫苗保护的关键补偿途径。
- 平台差异价值:
- mRNA疫苗强于诱导抗体广度
- 腺病毒疫苗优于激发T细胞应答
→ 异源加强策略可能最大化保护范围
- 临床启示:未来疫苗设计需同时优化B/T细胞表位覆盖,以应对快速进化变异株。
图1. 疫苗免疫策略与抗体应答动力学
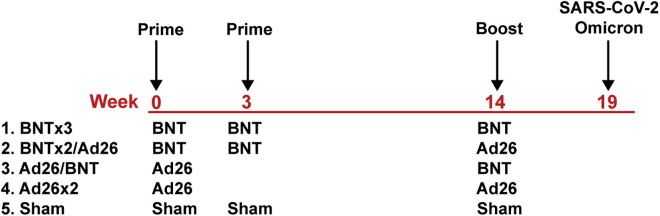
图1+免疫方案与抗体动态
(A)免疫时间轴(B)加强免疫后多变异株NAb滴度比较
图3. T细胞应答的交叉反应性
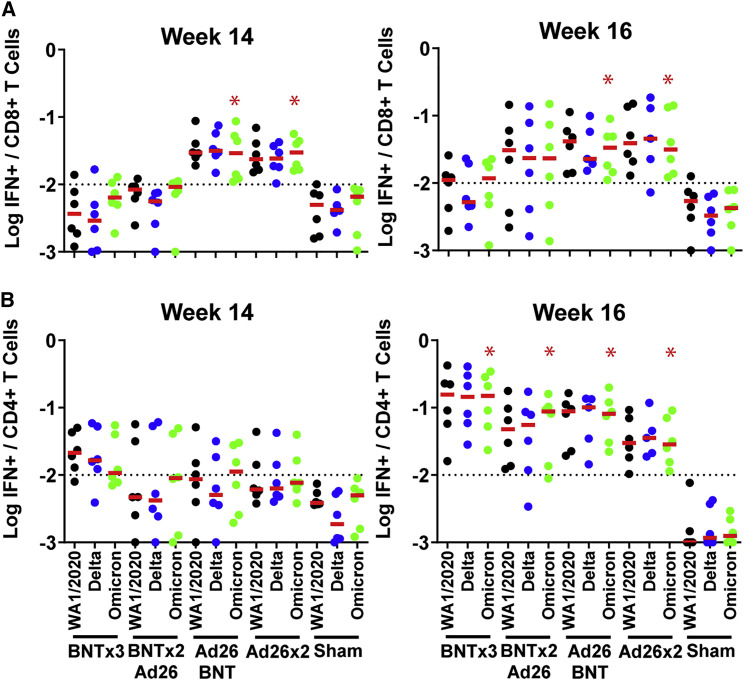
图3+CD8+/CD4+细胞对变异株的反应
(A)Omicron特异性IFN-γ⁺ CD8⁺ T细胞频率(B)CD4⁺ T细胞应答广度
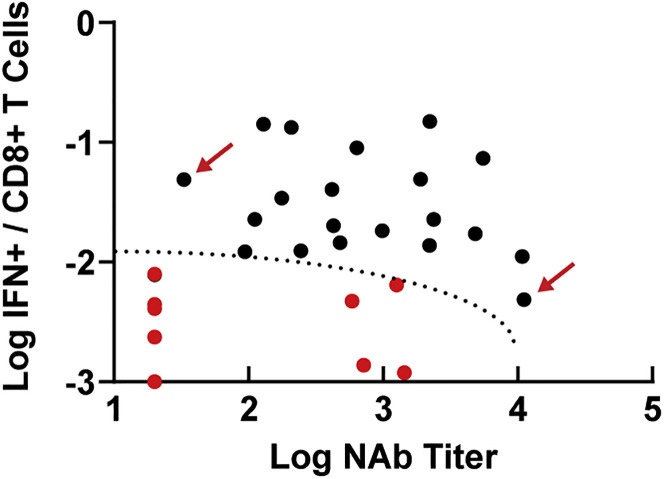
图6. 免疫保护的空间模型
红点:病毒控制失败动物;虚线:保护阈值边界
| 名称 | 货号 | 规格 |
| Series S Sensor Chip CM5, 10-pack | 29149603 | 10片 |
| V-PLEX Proinflammatory Panel1 (human) Kit (5 Plate) | K15049D-2 | 5Plate |
| V-PLEX Proinflammatory Panel1 (human) Kit (25 Plate) | K15049D-4 | 25Plate |







