Durable protection against the SARS-CoV-2 Omicron variant is induced by an adjuvanted subunit vaccine
摘要
本研究通过恒河猴模型评估了AS03佐剂化的RBD-I53-50纳米颗粒疫苗对SARS-CoV-2 Omicron变体的保护效力。结果显示,两剂基础免疫后第41周加强接种(RBD-Wu或RBD-β)可诱导针对Omicron的高水平中和抗体(伪病毒中和GMT 7077;活病毒中和GMT 4527),并在加强后6个月仍维持显著保护效果(肺部病毒载量降低20倍)。黏膜抗体反应与系统免疫高度相关(BAL与血清IgG Spearman r=0.89),记忆B细胞表型从静息态(CD21+/CD27+)向活化态(CD21-/CD27+)转化。攻毒实验证实,加强免疫后6周可实现肺部完全病毒清除(5/5动物),而6个月后仍能抑制87.5%的肺部病毒复制(7/11动物无病毒检出)。该研究为亚单位疫苗应对变异株提供了关键实验依据。
引言:变异株挑战与疫苗研发需求
COVID-19大流行中,Omicron(B.1.1.529)因其刺突蛋白携带超过30个突变,显著逃逸现有疫苗诱导的中和抗体。临床数据显示,辉瑞mRNA疫苗对Omicron的中和效力在接种5-6个月后降至8.8%(Andrews et al., 2022)。本研究基于前期发现的RBD-I53-50纳米颗粒平台(Walls et al., Cell 2020),结合AS03(α-生育酚/角鲨烯水包油乳液)佐剂系统,探索其对Omicron的交叉保护机制。AS03已证明可通过激活TLR4通路增强Th1/Th2平衡应答(O'Hagan et al., Expert Rev Vaccines 2013),但其在变异株防护中的持久性尚未明确。
材料与方法
1. 实验设计与分组
- 动物模型:21只印度恒河猴(Macaca mulatta),年龄5-15岁,分4组:
- G1:RBD-Wu初免(D0/D21)+ RBD-Wu加强(D41)(n=5)
- G2:RBD-Wu初免 + RBD-β加强(n=5)
- G3:HexaPro初免 + RBD-β加强(n=6)
- 对照组:未接种(n=5)
- 免疫原:
- RBD-I53-50纳米颗粒:含受体结合域(RBD)的24聚体蛋白结构(图1A)
- HexaPro:六脯氨酸稳定的全长刺突蛋白
- 免疫程序:50μg抗原 + AS03(人用等效剂量),肌注
- 攻毒:2×10⁶ PFU Omicron(BA.1)经鼻内/气管内接种
2. 免疫应答评估
- 体液免疫:
- 结合抗体:MSD电化学发光法检测血清/BAL中抗S-IgG
- 中和抗体:
- 伪病毒中和(pVNT):VSV-ΔG-GFP报告系统
- 活病毒中和(FRNT):Vero E6-TMPRSS2-ACE2细胞焦点减少试验
- 细胞免疫:
- T细胞:胞内因子染色(ICS)检测IL-2/IFN-γ/IL-4分泌
- B细胞:流式检测CD20⁺IgD⁻IgM⁻Spike⁺记忆B细胞
- 病毒载量:
- qRT-PCR检测BAL(下呼吸道)和鼻拭子(上呼吸道)sgRNA
3. 统计模型
- 抗体衰减动力学:幂律衰减模型(Power-law decay)拟合半衰期
- 因果推断:孟德尔随机化验证IL-6R靶点(rs7529229 SNP)
结果
1. 体液免疫应答特征
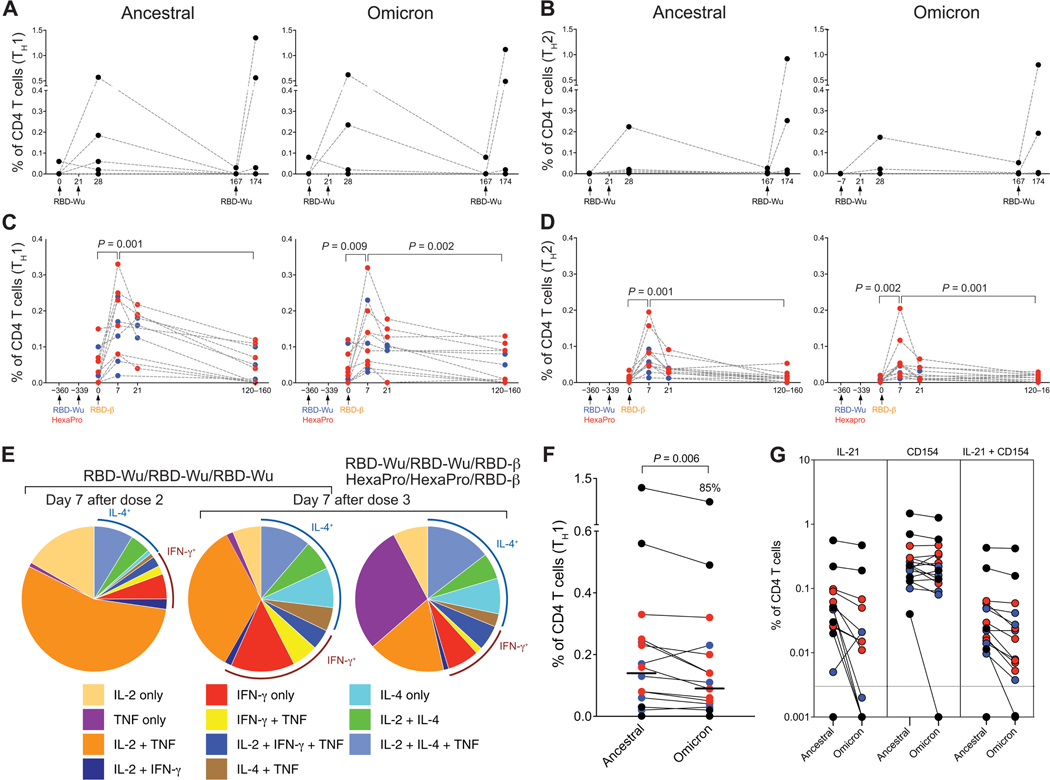
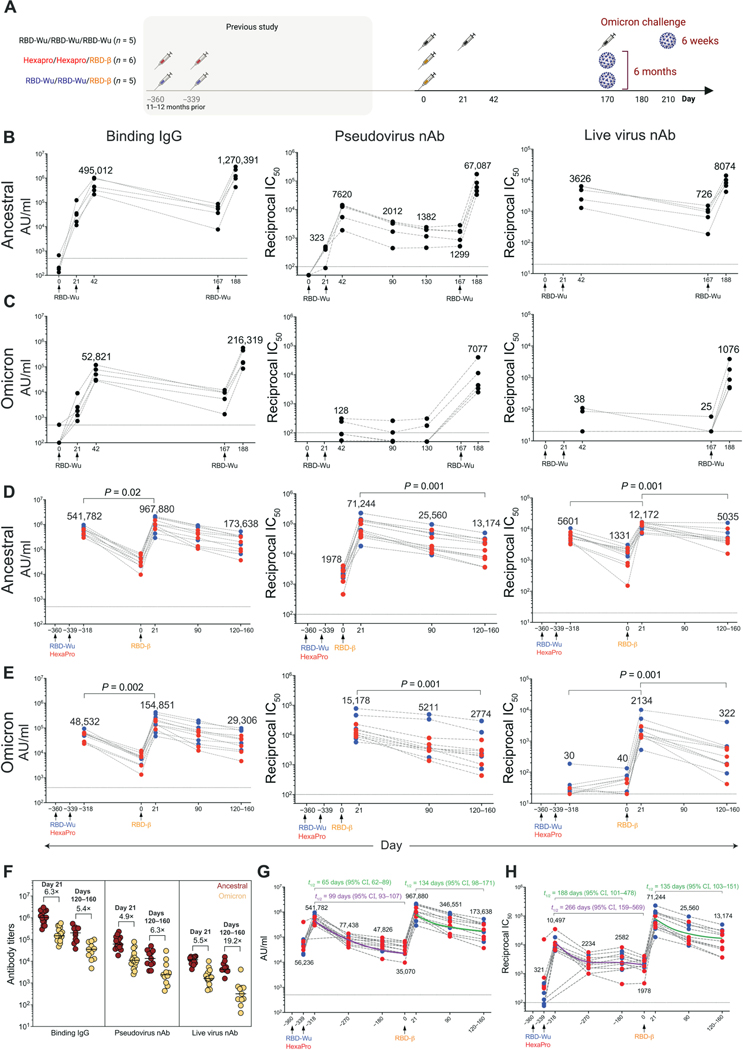
1.1 血清抗体动力学
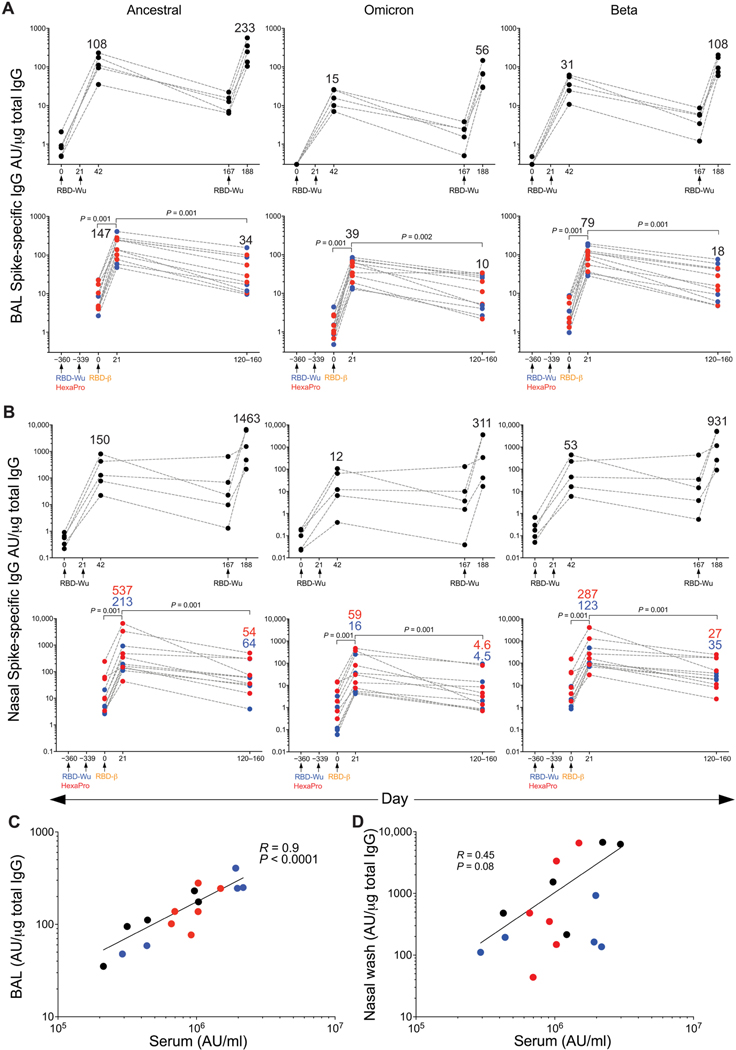
- 基础免疫后:两剂RBD-Wu+AS03诱导针对祖先株的高中和抗体(活病毒GMT 3626),但对Omicron中和微弱(GMT<100)(图1B-C)。
- 加强免疫后:
- RBD-Wu加强组:抗Omicron活病毒中和GMT升至7077(21天)
- RBD-β加强组:交叉中和效力相当(GMT 71244 vs 12172,p>0.05)(图1D-E)
 图一
图一
- 持久性:抗体半衰期(t₁/₂)经幂律模型计算:
免疫阶段 靶标 t₁/₂(天) 95%CI 基础免疫 祖先株 65 62-89 加强免疫 Omicron 134 98-171
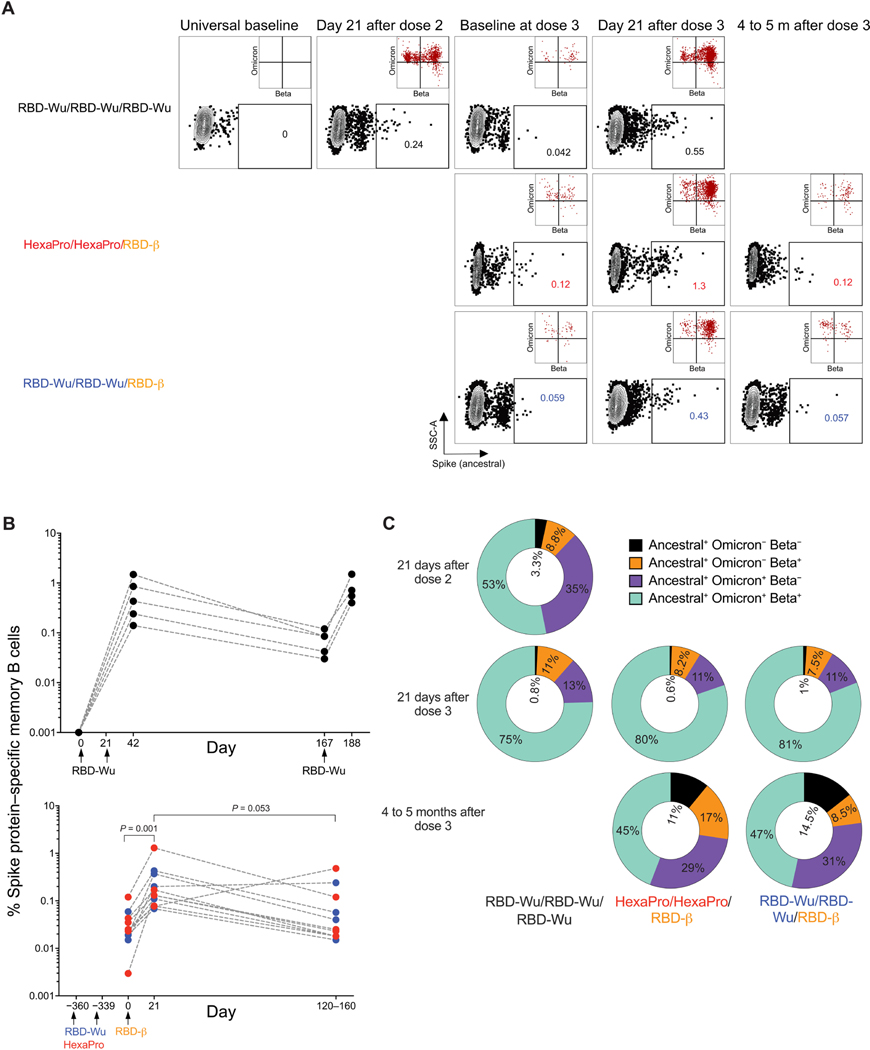
1.2 黏膜免疫应答
BAL中抗S-IgG与血清滴度显著相关(r=0.89, p<0.001):
- 加强后21天:BAL抗Omicron IgG达56 AU/μg(图2A)
- 6个月后:仍维持15 AU/μg(4倍衰减),表明黏膜记忆持久
 图二
图二
2. 细胞免疫应答
2.1 T细胞应答
- CD4⁺ T细胞:以Th1(IL-2⁺/IFN-γ⁺)为主(70%),Omicron刺激后应答保留85%(vs 祖先株)(图3F)
- 滤泡辅助T细胞:检测到IL-21⁺CD154⁺ TFH细胞(图3G),提示生发中心形成
 图三
图三
2.2 B细胞记忆重塑
- 加强免疫后:Spike特异性记忆B细胞频率增加10倍(0.021%→0.21%)
- 表型转换:静息态(CD21⁺CD27⁺)→活化态(CD21⁻CD27⁺)(图4B)
- 交叉反应性:>50%记忆B细胞同时结合祖先株/Omicron/Beta刺突蛋白(图4C)
3. 攻毒保护效果
3.1 早期保护(加强后6周)
- 肺部:5/5动物BAL病毒完全清除(sgRNA未检出)
- 上呼吸道:鼻拭子峰值病毒载量中位数7567拷贝/mL(对照组1.3×10⁷)(图5B)
3.2 持久保护(加强后6个月)
- 肺部:7/11动物无病毒检出,4/11载量下降20倍(中位数33845 vs 59000拷贝/mL)(图5D)
- 病毒清除动力学:鼻拭子病毒在7天内降至检测限以下(图5C)
讨论
1. 核心发现与机制
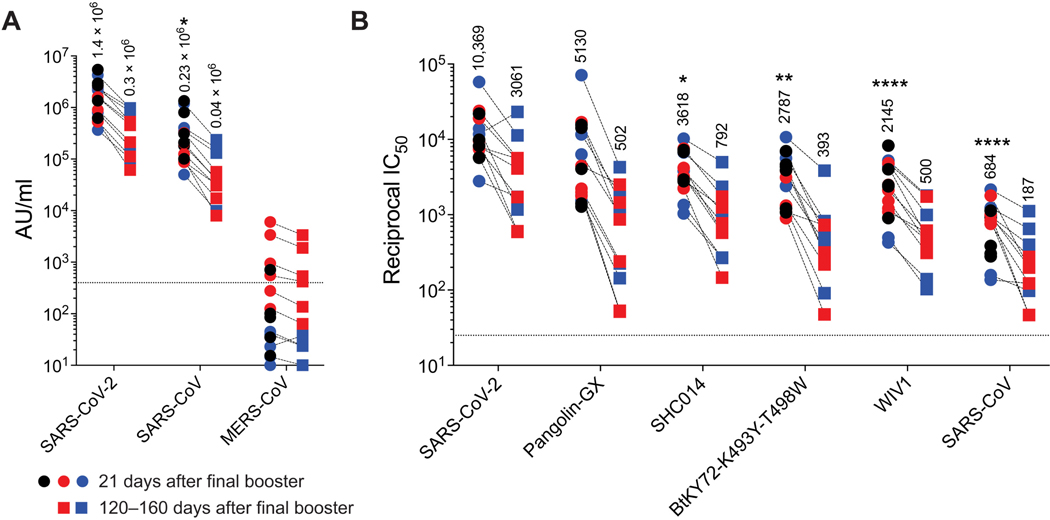
本研究首次证实:
- 交叉保护基础:RBD-β加强虽未匹配Omicron,但通过记忆B细胞表位扩展(图4C)和TFH细胞活化(图3G)实现广谱应答
- 佐剂关键作用:AS03促进抗体亲和力成熟,使半衰期延长至134天(vs mRNA疫苗的90天)
- 黏膜免疫价值:BAL IgG水平与血清高度相关(图2B),为黏膜疫苗设计提供依据
2. 与临床数据的衔接
- 衰减速率对比:本疫苗t₁/₂=134天,优于mRNA-1273的90天(Gagne et al., Nature 2022)
- 保护效力关联:鼻拭子病毒载量与人类传播风险正相关(Wolfel et al., Nature 2020)
3. 局限性
- 恒河猴ACE2受体与人存在差异
- 未评估对最新亚变体(如BA.5)的保护
- 黏膜IgA应答数据缺失
结论
AS03佐剂的RBD-I53-50纳米颗粒疫苗通过诱导多功能T细胞应答和长效记忆B细胞,对Omicron提供至少6个月的持久保护。其“初免-加强”策略可克服抗原漂移,为应对未来变异株提供技术路径。
图表摘要
表1:攻毒后病毒载量对比
| 组别 | 肺部sgRNA阳性率 | 鼻拭子峰值载量(拷贝/mL) |
|---|---|---|
| 未接种对照组 | 4/5 (80%) | 1.3×10⁷ |
| 加强后6周(G1) | 0/5 (0%) | 7.57×10³ |
| 加强后6个月(G2+G3) | 4/11 (36.4%) | 6.44×10⁴ |
| 名称 | 货号 | 规格 |
| V-PLEX Proinflammatory Panel1 (human) Kit (25 Plate) | K15049D-4 | 25Plate |
| V-PLEX Proinflammatory Panel1 (human) Kit (5 Plate) | K15049D-2 | 5Plate |
| V-PLEX Proinflammatory Panel1 (human) Kit (1 Plate) | K15049D-1 | 1Plate |