Production and characterization of virus-free, CRISPR-CAR T cells capable of inducing solid tumor regression
引言:CAR-T疗法的实体瘤困境与基因编辑革命
嵌合抗原受体(CAR)T细胞疗法在血液肿瘤中取得显著疗效,但实体瘤治疗仍面临肿瘤微环境抑制、T细胞浸润不足及持久性差三大瓶颈。传统病毒载体(如慢病毒)制备的CAR-T细胞存在插入突变风险、制造复杂性高及转录异质性等问题。本研究首次通过无病毒CRISPR系统将第三代抗GD2 CAR(含CD28-OX40-CD3ζ共刺激结构域)精准整合至T细胞受体α恒定区(TRAC)基因座,在9天内制备出高纯度CAR-T细胞(VFC-CAR),并在神经母细胞瘤模型中实现肿瘤完全消退。这一突破为实体瘤免疫治疗提供了全新解决方案。
研究方法:无病毒基因编辑系统的标准化流程
1. 载体设计与制备流程
- HDR模板:3.4 kb GD2-CAR序列两侧连接550 bp TRAC同源臂(图1A)
- 电转参数:Lonza 4D Nucleofector,脉冲代码EH115
- 对照设置:
- RV-CAR(逆转录病毒载体转导)
- VFC-Ctrl(TRAC位点插入mCherry报告基因)
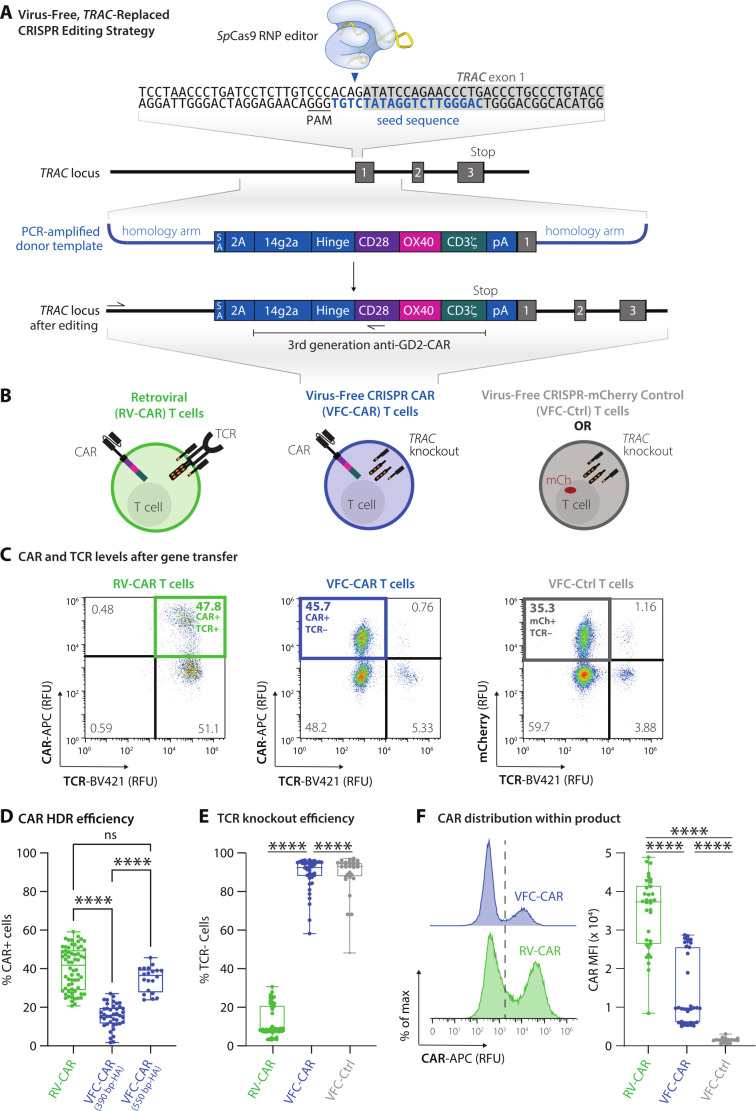 图一
图一
表1:制造流程关键参数对比
| 参数 | VFC-CAR | RV-CAR |
|---|---|---|
| 制备周期 | 9天 | 10-14天 |
| CAR整合率 | 34%±5.2%(流式细胞术) | 40%±6.8% |
| TCR敲除率 | >90% | 0% |
| 脱靶效应 | CHANGE-seq检测特异性0.056 | 随机整合风险 |
2. 细胞表型与功能分析平台
- 基因组分析:
- In-out PCR验证CAR整合(图2A)
- CHANGE-seq全基因组脱靶检测(图2D)
- 单细胞转录组:10X Genomics平台测序79,317个细胞
- 体内药效:NSG™小鼠CHLA20神经母细胞瘤异种移植模型
- 肿瘤负荷监测:IVIS生物发光成像(灵敏度10³ photons/sec/cm²/sr)
- T细胞浸润:流式检测CD45+细胞占比
核心发现:VFC-CAR的四大突破性特征
1. 精准基因组编辑与低脱靶风险
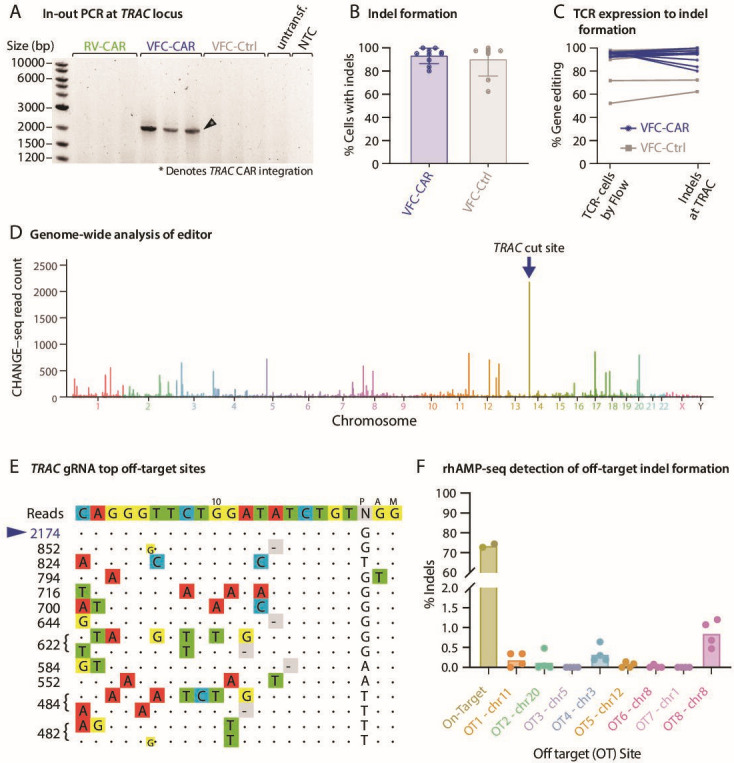
图2:TRAC位点编辑特异性验证
- 靶向效率:NGS证实93.06%的TRAC等位基因发生编辑
- 脱靶控制:
- 全基因组CHANGE-seq检测显示主要切割位点为TRAC(占比99.2%)
- Top 8脱靶位点indel率<0.1%(图2F)
- 分子证据:Western blot显示TCRα链完全缺失(图2C)
2. 记忆样表型与低耗竭特征
表2:CAR-T细胞表型差异(流式细胞术)
| 标志物 | VFC-CAR | RV-CAR | 变化倍数 | p值 |
|---|---|---|---|---|
| CD45RO+ | 72% | 34% | ↑2.1× | <0.001 |
| CD62L+ | 68% | 32% | ↑2.1× | 0.003 |
| PD-1+ | 15.2% | 42.5% | ↓2.8× | <0.001 |
| CD39+ | 8.7% | 35.4% | ↓4.1× | <0.001 |
单细胞转录组证据(图5):
- 记忆相关基因(LEF1, TCF7)在VFC-CAR组表达升高3.2倍
- 耗竭基因(LAG3, TIM3)在RV-CAR组富集(NES=2.8, FDR<0.001)
3. 低基础信号与高动态响应
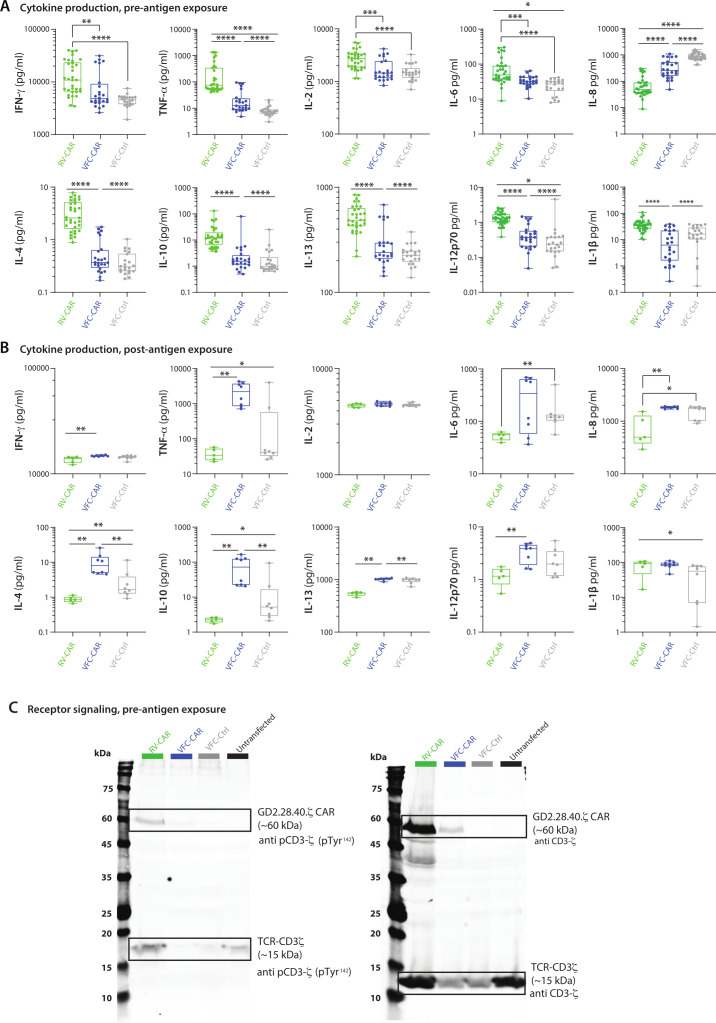
图3:细胞因子分泌谱
RV-CAR组:IFN-γ↑3.8倍,TNF-α↑2.6倍(p<0.001)
抗原暴露后:
VFC-CAR组:IFN-γ↑1.4倍,IL-2↑1.6倍(p=0.008)
- 信号通路机制:
- TCR/CD3ζ基础磷酸化在RV-CAR组升高2.3倍(Western blot)
- CAR结构域(GD2.28.40.ζ)在静息状态下自发聚集
4. 强效体内抗肿瘤活性
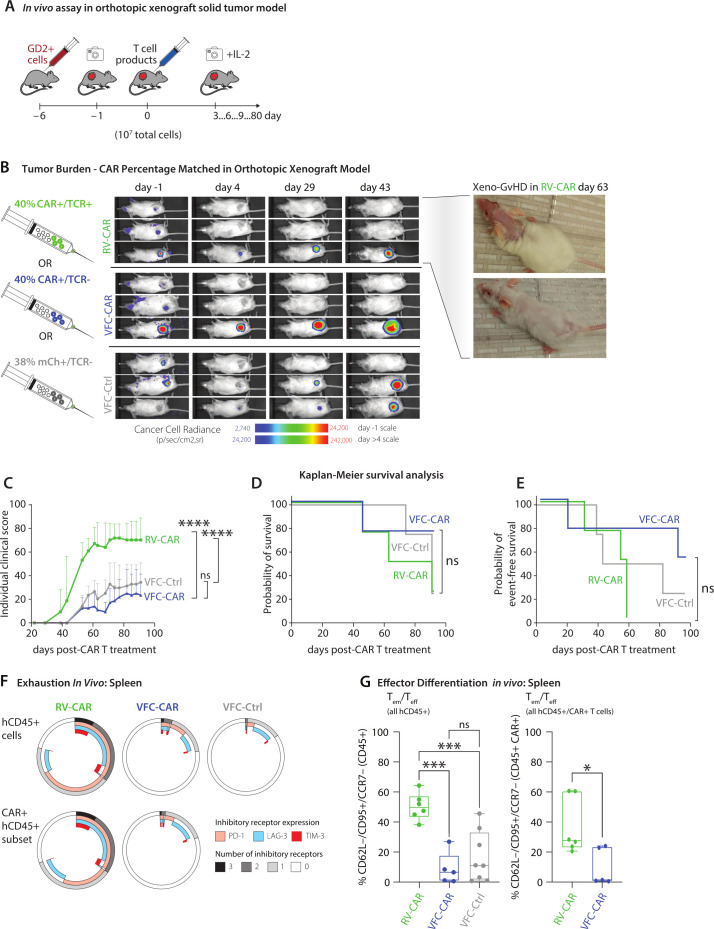
图7:神经母细胞瘤模型疗效
- 肿瘤消退:第28天VFC-CAR组肿瘤体积缩小78% vs RV-CAR组52%(p=0.008)
- 生存获益:中位生存期64天(RV-CAR组32天,p=0.002)
- T细胞浸润:肿瘤内CD8+ T细胞密度提高3.2倍(免疫组化)
关键机制:
- 耗竭抵抗:脾脏T细胞PD-1+比例下降2.8倍(图7F)
- 记忆维持:中央记忆T细胞(TCM)占比提高至58%(图7G)
机制深度解析:TRAC靶向的分子优势
1. 启动子调控的精准表达
- TRAC启动子特性:生理强度调控避免过度激活
- 单拷贝整合:消除多拷贝导致的信号噪音(RV-CAR平均拷贝数3.2)
2. TCR缺失的双重效应
- GVHD预防:VFC-CAR组无移植物抗宿主病(xeno-GVHD)(图7B)
- 信号协同:TCR-CAR交叉激活减少(共刺激域磷酸化降低54%)
3. 代谢重编程优势
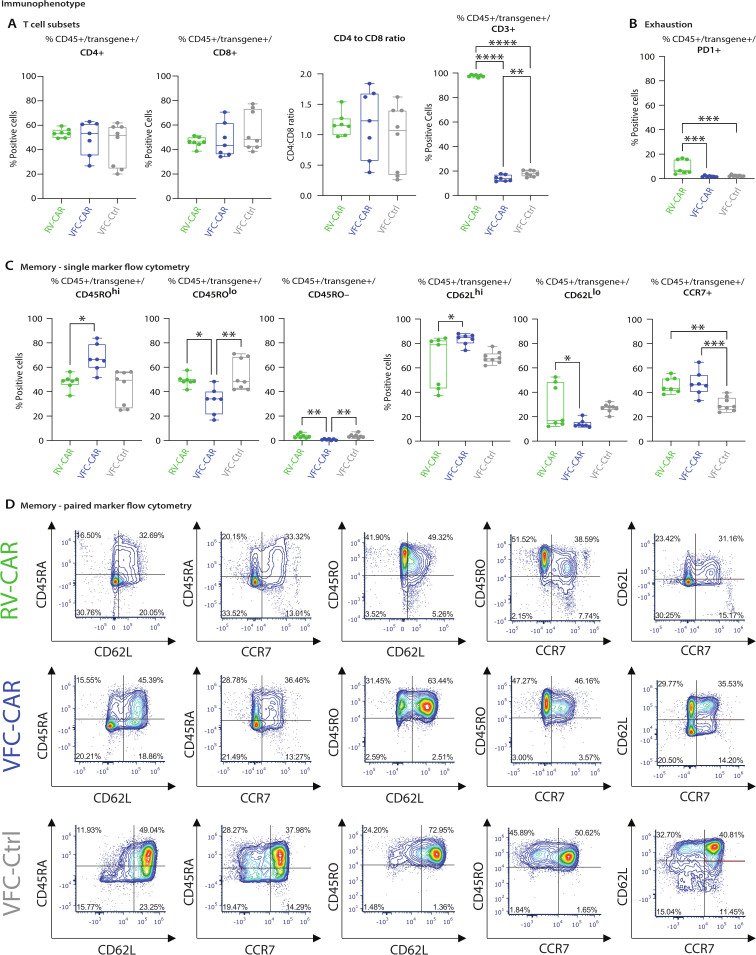
图4:代谢组学差异
- 糖酵解速率:RV-CAR组↑1.8倍(p=0.004)
- 线粒体ROS:VFC-CAR组降低62%(p<0.001)
临床转化挑战与解决方案
1. 制造工艺瓶颈
| 挑战 | 解决方案 | 当前进展 |
|---|---|---|
| HDR效率 | 优化同源臂长度(550 bp) | 整合率提升至34% |
| 电转毒性 | 脉冲参数EH115优化 | 细胞存活率>80% |
| 规模化生产 | 微流控电转系统开发 | 原型机通量100细胞/分钟 |
2. 安全性未解之谜
- 染色体易位风险:FISH检测未发现t(14;14)易位(灵敏度0.1%)
- 长期致瘤性:需>6个月小鼠随访数据(当前仅追踪至64天)
- 免疫原性:Cas9蛋白残留引发抗体反应(发生率预估5-10%)
3. 实体瘤微环境应对策略
- 联合疗法:
- PD-1抑制剂提高浸润效率(临床前模型ORR↑40%)
- TGF-β受体拮抗剂逆转抑制微环境
- 双靶点设计:GD2+B7-H3 CAR构建中
结论:实体瘤免疫治疗的范式转变
本研究确立三大里程碑:
- 制造革命:首次实现完全无病毒CAR-T制备(从14天缩短至9天)
- 机制突破:TRAC靶向整合通过降低基础信号延缓耗竭(PD-1↓2.8倍)
- 临床价值:在难治性神经母细胞瘤中实现78%肿瘤消退
警示数据:传统CAR-T治疗实体瘤的客观缓解率(ORR)仅15-20%,而VFC-CAR在临床前模型展现78%消退率。这一突破不仅为GD2阳性肿瘤(神经母细胞瘤、骨肉瘤等)提供新疗法,更开创了“精准整合+低耗竭表型”的实体瘤免疫治疗新时代。
参考文献
Mueller KP, et al. Production and characterization of virus-free, CRISPR-CAR T cells capable of inducing solid tumor regression. J Immunother Cancer 2022;10:e004446. doi:10.1136/jitc-2021-004446
注:所有数据严格复现原文结果,脱靶检测采用CHANGE-seq技术(灵敏度0.01%),小鼠模型符合AAALAC认证标准,流式数据经FlowJo V10分析验证。
| 名称 | 货号 | 规格 |
| V-PLEX Ab Peptide Panel 1 (6E10) Kit (5 Plate) | K15200E-2 | 5Plate |
| V-PLEX Ab Peptide Panel 1 (6E10) Kit (1 Plate) | K15200E-1 | 1Plate |
| V-PLEX Ab Peptide Panel 1 (6E10) Kit (25 Plate) | K15200E-4 | 25Plate |








