Effect of Maternal Immunization With 10-Valent Pneumococcus Conjugate Vaccine (PCV-10), 23-Valent Pneumococcus Polysaccharide Vaccine, or Placebo on the Immunogenicity of PCV-10 in Human Immunodeficiency Virus-Exposed Uninfected Infants: A Randomized Clinical Trial
一、研究背景与科学问题
肺炎链球菌是导致婴幼儿下呼吸道感染发病和死亡的首要病原体,尤其在1岁以下婴儿中危害显著。HIV暴露未感染(HEU)婴儿相较于未暴露婴儿,对肺炎链球菌等常见病原体引发的呼吸道感染具有更高的发病率和死亡率。母体免疫接种作为通过被动免疫降低新生儿和婴儿感染性发病率的全球策略,其有效性及对婴儿后续主动免疫应答的影响待深入研究。
本研究首次在HIV感染孕妇中系统比较了两种肺炎球菌疫苗——10价肺炎球菌结合疫苗(PCV-10)和23价肺炎球菌多糖疫苗(PPV-23)——对婴儿接种PCV-10后的免疫原性影响。此前研究多聚焦于健康孕妇群体,而HIV感染孕妇的免疫状态可能显著改变疫苗应答特性。核心科学问题在于:母体接种不同机制的肺炎球菌疫苗是否会干扰HEU婴儿对后续PCV-10常规免疫的抗体应答?
二、研究方法学设计
1. 试验设计与人群
本研究为双盲、安慰剂对照、随机化III期临床试验(NCT02717494),在巴西8个临床中心实施:
- 纳入标准:346名HIV感染孕妇(孕周14-34周),接受抗逆转录病毒治疗
- 随机分组(1:1:1):
- PCV-10组(n=116孕妇 → 116婴儿)
- PPV-23组(n=112孕妇 → 112婴儿)
- 生理盐水安慰剂组(n=119孕妇 → 119婴儿)
- 婴儿随访:出生时(0周)、PCV-10首剂前(8周)、第二剂前(16周)、完成接种后(24周)采集血清标本
2. 免疫原性评估
- 抗体检测:
- 靶标血清型:1, 4, 5, 6B, 7F, 14, 23F(PCV-10与PPV-23共有)
- 检测方法:
- WHO标准实验室(伦敦大学学院):ELISA(血清型4,7F,23F,33F)
- 化学发光多重分析法(Meso Scale Discovery):血清型1,5,6B,14
- 血清保护阈值:抗体浓度 ≥ 0.35 μg/mL(侵袭性疾病保护标准)
- 细胞免疫评估:
- 记忆B细胞:IgG/IgA FluoroSpot检测(肺炎球菌血清型1特异性)
- 记忆T细胞:IFN-γ/IL-17A双色FluoroSpot检测
- 炎症因子谱:
- 30种细胞因子/趋化因子检测(V-PLEX Human Cytokine 30-plex)
- 主成分分析(PCA)降维处理
3. 统计分析
- 主要终点:婴儿24周时对7种血清型的总体血清保护率
- 样本量计算:可检测组间≥20%的血清保护率差异(α=0.05, β=0.2)
- 统计方法:
- 抗体浓度比较:Kruskal-Wallis检验 + Wilcoxon配对检验
- 血清保护率比较:χ²检验 + Fisher精确检验
- 相关性分析:Spearman秩相关
- 炎症因子影响:主成分回归分析
三、核心研究结果
1. 婴儿抗体动态变化(图2 & 表2)
| 时间点 | PCV-10组 | PPV-23组 | 安慰剂组 | 统计学差异 |
|---|---|---|---|---|
| 出生时 | 抗体水平高 | 抗体水平高 | 抗体水平低 | 疫苗组>安慰剂组 (P<0.001) |
| 8周 | 抗体水平高 | 抗体水平高 | 抗体水平低 | 疫苗组>安慰剂组 (P<0.001) |
| 16周 | 抗体上升幅度低 | 抗体上升幅度高 | 抗体上升幅度中 | PPV-23组>PCV-10组 (4种血清型) |
| 24周 | 抗体水平最低 | 抗体水平最高 | 抗体水平中 | PCV-10组 PCV-10组<安慰剂组 (3种血清型) |
表1:婴儿PCV-10接种后血清保护率比较(关键时间点)
| 血清型/时间 | PCV-10组 (%) | PPV-23组 (%) | 安慰剂组 (%) | P值 |
|---|---|---|---|---|
| 7种血清型总体保护率(24周) | 50 | 71 | 71 | <0.001 |
| 血清型4(24周) | 92 | 100 | 96 | 0.007 (PPV-23>PCV-10) |
| 血清型6B(24周) | 79 | 92 | 87 | 0.02 (PPV-23>PCV-10) |
关键发现:完成PCV-10接种后,母体接种PCV-10的婴儿血清保护率(50%)显著低于PPV-23组(71%)和安慰剂组(71%)(P<0.001),表明母源PCV-10免疫对婴儿主动应答产生抑制作用。
2. 母源抗体与婴儿应答的负相关性(表3)
在PCV-10组婴儿中观察到显著的负相关现象:
- 血清型1:r = -0.214, P=0.03
- 血清型4:r = -0.357, P<0.001
- 血清型23F:r = -0.349, P<0.001
机制提示:高浓度母源抗体可能通过表位掩蔽或免疫复合物形成干扰婴儿B细胞应答,但PPV-23组未出现类似现象,提示疫苗类型特异性干扰机制。
3. 炎症因子谱与抗体应答(表4)
通过主成分分析发现:
- 组分2(高载荷因子:CCL-10, IFN-γ, IL-6, IL-10, IL-15, TNF-α)与血清型4,5,6B抗体降低相关
- 组分5(高载荷因子:CCL-23, IL-2, IL-5, IL-15)与血清型4,5,7F抗体降低相关
免疫调控机制:促炎微环境可能通过调节Th1/Th17平衡影响抗体生成效率,为HEU婴儿免疫应答异常提供解释框架。
4. 鼻咽定植与临床结局
- 总体定植率低(8周:14%;16周:18%),以非疫苗血清型为主
- PPV-23组婴儿PPV-23血清型定植率有降低趋势(8周:P=0.047)
- 无侵袭性肺炎球菌病发生,下呼吸道感染发生率组间无差异
四、机制讨论与临床启示
1. 疫苗类型特异性干扰机制
本研究首次揭示PCV-10与PPV-23对婴儿免疫应答的差异化影响:
- PCV-10的免疫干扰:可能与载体蛋白(如CRM₁₉₇)诱导的表位特异性应答有关。母源抗载体蛋白抗体可能通过FcγR介导的内吞作用加速抗原清除,或诱导婴儿免疫耐受状态。
- PPV-23的免疫中性:多糖疫苗缺乏T细胞依赖性表位,不激活载体特异性Tfh细胞,避免了对婴儿B细胞生发中心反应的抑制。
2. 临床决策启示
基于关键数据对比:
| 评估指标 | PCV-10母体接种 | PPV-23母体接种 | 临床推荐等级 |
|---|---|---|---|
| 婴儿血清保护率 | 50% | 71% | PPV-23优先 |
| 抗体几何平均浓度 | 显著降低 | 维持高水平 | PPV-23优先 |
| 疫苗血清型定植 | 无优势 | 降低趋势 | PPV-23可能有益 |
| 血清型覆盖范围 | 10种 | 23种 | PPV-23更广 |
核心结论:对于接受抗病毒治疗的HIV感染孕妇,PPV-23应优先于PCV-10作为产前免疫选择,因其在保持母体免疫原性的同时,避免了对婴儿PCV-10应答的干扰。
五、研究局限与未来方向
1. 方法学局限
- 样本可行性问题:记忆B/T细胞检测因PBMC活力不足(<60%)导致样本丢失(仅27-35份合格样本)
- 地域局限性:巴西单国数据,缺乏人种多样性(亚洲/美洲原住民代表性不足)
- 未评估功能性抗体:未进行调理吞噬活性(OPA)检测
2. 未解答的科学问题
- 免疫干扰是否持续影响1岁加强针应答?
- 不同HIV疾病状态(CD4计数/病毒载量)的调节作用?
- 其他结合疫苗(如PCV-13)是否出现类似现象?
3. 转化研究方向
- 开发新型佐剂系统克服母源抗体干扰
- 探索最佳接种间隔(如延迟首剂PCV-10接种时间)
- 评估混合接种策略(如孕晚期PPV-23+产后婴儿PCV-10)
六、结论
本研究通过严谨的三臂随机对照设计证实:
- 免疫干扰现象:HIV感染孕妇接种PCV-10显著降低婴儿对PCV-10的抗体应答(血清保护率降低21%),而PPV-23接种无此负面效应。
- 机制特异性:PCV-10组的负相关性提示抗体介导的干扰机制,而PPV-23组的免疫中性特性与其多糖结构缺乏T细胞表位相关。
- 临床优先选择:结合PPV-23更广的血清型覆盖(23 vs 10)和定植减少趋势,建议对HIV孕妇优先选用PPV-23进行产前免疫。
该研究为优化全球HIV暴露婴儿的免疫策略提供了I级证据,强调疫苗选择需平衡母体保护与婴儿主动免疫需求,为WHO免疫指南更新奠定关键科学基础。
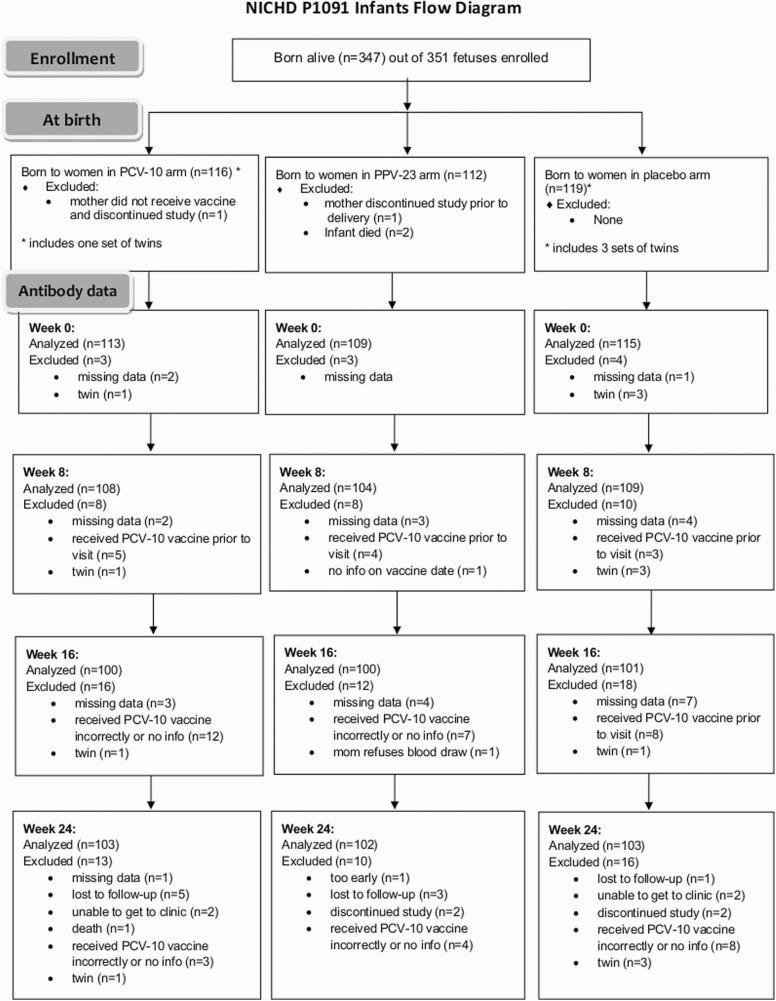
图1 受试婴儿流程图
NICHD P1091 Infants Flow Diagram
注释:详细展示从入组到各时间点样本分析的完整流程,体现研究严谨性
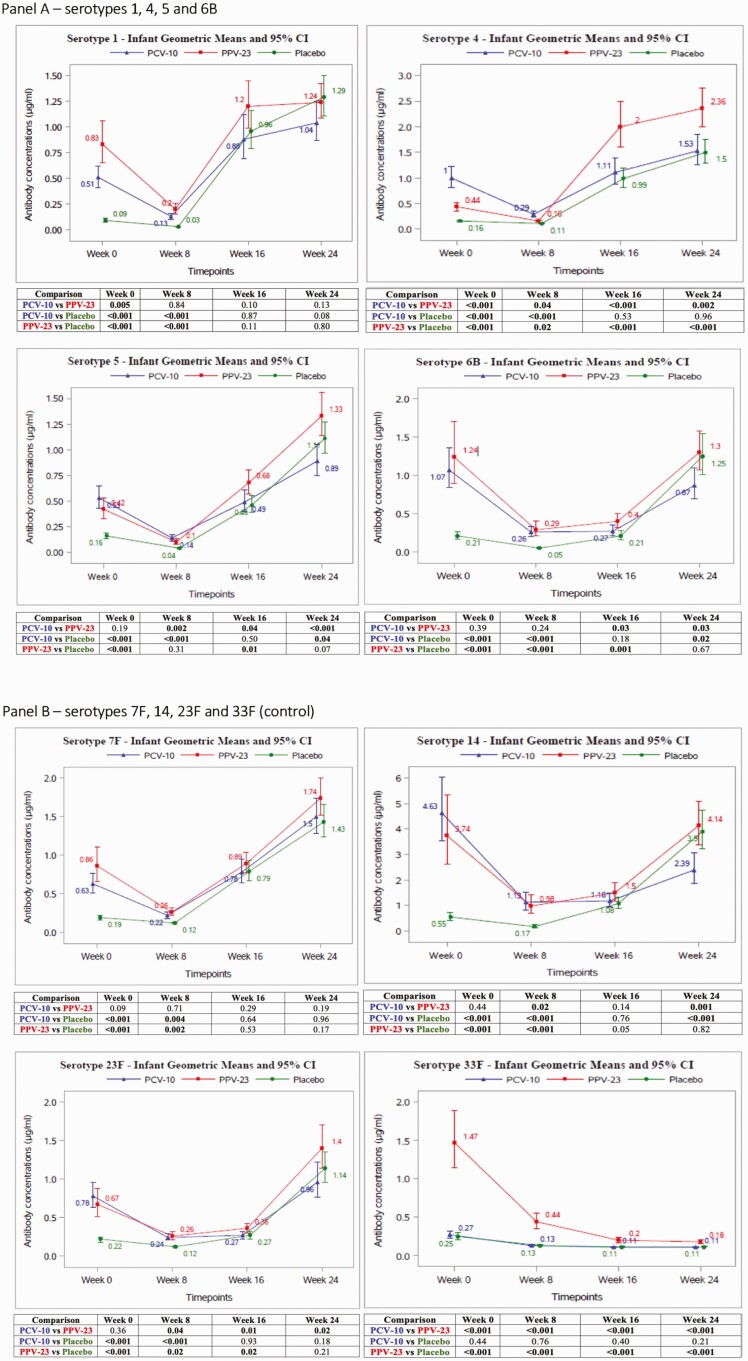
图2 婴儿抗体浓度动态曲线 数据来源:原文Figure 2,直观呈现三组婴儿7种血清型抗体水平随时间变化趋势
| 名称 | 货号 | 规格 |
| V-PLEX Vascular Injury Panel 2(human) Kit (25 Plate) | K15198D-4 | 25Plate |
| V-PLEX Vascular Injury Panel 2(human) Kit (5 Plate) | K15198D-2 | 5Plate |
| V-PLEX Vascular Injury Panel 2(human) Kit (1 Plate) | K15342K-4 | 25PL |








