β-Amyloid in blood neuronal-derived extracellular vesicles is elevated in cognitively normal adults at risk of Alzheimer's disease and predicts cerebral amyloidosis
一、研究背景与核心问题
阿尔茨海默病(AD)的病理进程在临床症状出现前数十年即已启动,其特征性病理改变为β-淀粉样蛋白(Aβ)沉积形成的老年斑和过度磷酸化Tau蛋白构成的神经原纤维缠结。目前AD的确诊依赖于脑脊液检测或淀粉样蛋白正电子发射断层扫描(amyloid-PET),但二者均存在侵入性高、费用昂贵或普及度低的问题。因此,开发基于血液的生物标志物对实现AD的早期筛查和干预至关重要。
神经元源性细胞外囊泡(neuronal-derived extracellular vesicles, nEVs)是近年备受关注的生物标志物载体。它们由神经元释放,可穿过血脑屏障进入外周循环,携带反映神经元状态的生物分子(如Aβ、Tau蛋白)。本研究聚焦于血浆nEVs中的Aβ42,旨在解决两个关键问题:
- nEV Aβ42在AD连续体(从认知正常但脑Aβ沉积阳性[Aβ+NCs]到AD痴呆[ADD])中的动态变化规律
- nEV Aβ42与脑淀粉样蛋白沉积(amyloid-PET)、脑区体积(sMRI)及认知功能纵向变化的关联性
理论依据:
nEVs通过免疫沉淀法(anti-CD171抗体)从血浆中分离,其神经元特异性由标志物Tubb3/SNAP25确认(Western blot验证)。囊泡内Aβ42采用单分子阵列技术(Simoa)检测,灵敏度达飞克级,克服了传统ELISA法的灵敏度限制。
二、研究方法与队列设计
1. 研究队列
研究基于“中国认知衰退纵向研究(SILCODE)”,纳入246名参与者:
- 84名 Aβ- NCs(认知正常且脑Aβ阴性)
- 72名 Aβ+ NCs(认知正常但脑Aβ阳性)
- 45名 aMCI(遗忘型轻度认知障碍)
- 45名 ADD(AD痴呆)
所有受试者均接受神经心理学评估(MMSE、MoCA-B、AVLT等)、APOE基因分型和脑影像学检查(表1)。
表1:受试者基线特征
| 组别 | Aβ- NCs (n=84) | Aβ+ NCs (n=72) | aMCI (n=45) | ADD (n=45) |
|---|---|---|---|---|
| 年龄(岁) | 65.3 ± 5.5 | 67.2 ± 6.6 | 69.6 ± 6.8 | 73.9 ± 8.8 |
| APOE4携带率 | 27.4% | 44.4% | 53.3% | 68.9% |
| AV45 SUVR | 1.096 ± 0.059 | 1.241 ± 0.060 | 1.390 ± 0.085 | 1.419 ± 0.084 |
| 内嗅皮层体积/TIV | 4.226 ± 1.251 | 3.933 ± 1.206 | 3.479 ± 1.217 | 2.317 ± 0.834 |
注:#p<0.05 vs Aβ-NCs;*p<0.05;**p<0.01;***p<0.001;SUVR:标准化摄取值比;TIV:颅内总体积
2. 关键技术流程
-
nEV分离与验证:
血浆经Exoquick®沉淀后,用抗CD171抗体免疫沉淀富集nEVs。通过透射电镜(TEM)确认囊泡形态(直径≈150 nm),纳米颗粒追踪分析(NTA)定量浓度,Western blot验证神经元标志物(Tubb3/SNAP25)和纯度标志物(Albumin/GM130阴性)。 -
生物标志物检测:
- nEV Aβ42/Aβ40:Simoa Neurology 4-Plex E试剂盒
- 血浆Aβ42/Aβ40:电化学发光法(MSD平台)
- 脑Aβ沉积:¹⁸F-florbetapir (AV45) PET,SUVR>1.18定义为Aβ阳性
- 脑结构体积:3T MRI,CAT12工具箱分析海马、内嗅皮层等区域体积
三、核心研究结果
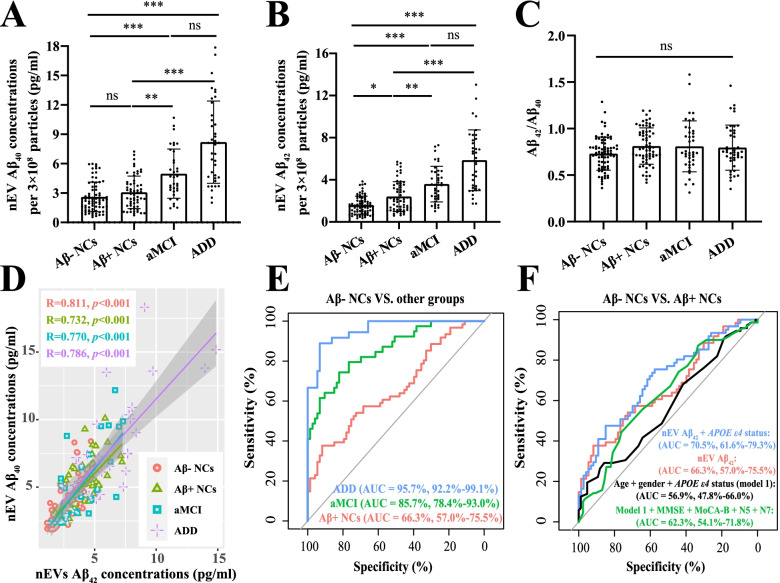
1. nEV Aβ42沿AD连续体梯度升高
在调整囊泡浓度至3×10⁸颗粒后,nEV Aβ42呈现明显的疾病进展相关性:
- Aβ-NCs:1.592 ± 0.852 pg/mL
- Aβ+NCs:2.406 ± 1.417 pg/mL(较Aβ-NCs升高51%,p<0.05)
- aMCI:3.593 ± 1.699 pg/mL(较Aβ+NCs升高49%,p<0.01)
- ADD:5.853 ± 2.880 pg/mL(较aMCI升高63%,p=0.086)
图1:nEV Aβ42浓度在AD连续体中的变化
图1(A)nEV Aβ42浓度;(B)nEV Aβ40浓度;(C)Aβ42/Aβ40比值无组间差异;(D)Aβ42与Aβ40显著正相关(R=0.811)
2. nEV Aβ42的诊断效能
ROC曲线分析显示,nEV Aβ42对区分不同疾病阶段具有优异性能:
- 区分Aβ+NCs与Aβ-NCs:AUC=0.663
- 区分aMCI与NCs(含Aβ+):AUC=0.791
- 区分ADD与NCs:AUC=0.957
联合APOEε4状态可将Aβ+NCs的识别AUC提升至0.705(图1E-F)。
表2:nEV Aβ42的诊断效能(ROC AUC)
| 对比组 | nEV Aβ42单独 | nEV Aβ42 + APOEε4 |
|---|---|---|
| Aβ-NCs vs Aβ+NCs | 0.663 | 0.705 |
| Aβ-NCs vs aMCI | 0.857 | 0.873 |
| Aβ-NCs vs ADD | 0.957 | 0.965 |
3. nEV Aβ42与脑淀粉样蛋白沉积强相关
nEV Aβ42水平与全局AV45 SUVR显著正相关(R=0.532, p<0.001),且这种关联在Aβ+NCs(R=0.417–0.570)和认知障碍患者中持续存在(表3)。线性回归显示,nEV Aβ42可解释脑Aβ沉积变异的41.1%。
图3:nEV Aβ42与AV45 SUVR的相关性

图3(左)总人群;(右)按诊断分组
表3:nEV Aβ42与脑区AV45 SUVR的偏相关分析
| 脑区 | 总人群 (R) | Aβ+NCs (R) |
|---|---|---|
| 左侧颞叶 | 0.462 | 0.418 |
| 右侧颞叶 | 0.549 | 0.538 |
| 左侧顶叶 | 0.570 | 0.466 |
| 右侧顶叶 | 0.603 | 0.457 |
| 内嗅皮层 | 0.444 | 0.381 |
注:***p<0.001;**p<0.01;校正年龄、性别、APOEε4状态
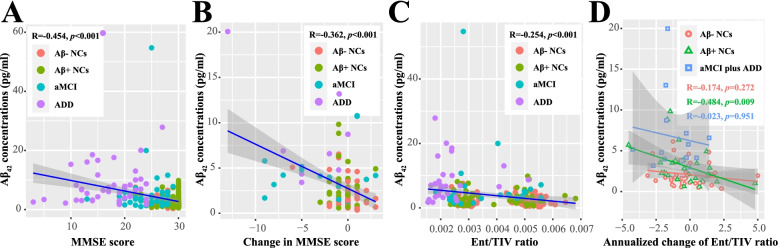
4. nEV Aβ42预测认知衰退与脑萎缩
在104名接受纵向评估的受试者中,基线nEV Aβ42水平与以下指标显著相关:
- 认知功能下降:MMSE评分年化下降率(R=0.454, p<0.001)
- 内嗅皮层萎缩:体积年化变化率(R=0.362, p<0.001)
图4:nEV Aβ42与纵向变化的关联
图4(A)MMSE变化;(B)MoCA-B变化;(C)基线内嗅皮层体积;(D)内嗅皮层年化萎缩率
四、讨论与意义
1. 方法学创新与优势
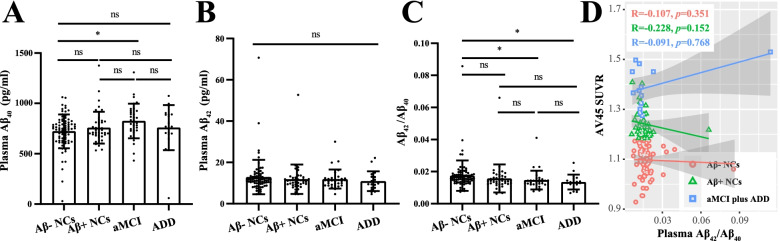
本研究通过CD171免疫沉淀富集nEVs,解决了外周血EVs来源混杂的问题。Simoa技术的应用使nEV内低丰度Aβ42的精准定量成为可能(灵敏度比ELISA高1000倍)。与传统血浆Aβ相比,nEV Aβ42具有显著优势:
- 血浆Aβ42:在NCs、aMCI、ADD间无差异(图2)
- nEV Aβ42:梯度升高且与PET金标准强相关
图2:血浆Aβ与nEV Aβ诊断效能对比
2. 临床转化价值
- 早期筛查:nEV Aβ42可识别脑Aβ沉积阳性但认知正常的AD高危人群(Aβ+NCs),为超早期干预提供窗口期。
- 疾病监测:其浓度梯度反映AD病理进展程度(Aβ-NCs→ADD)。
- 预后预测:基线水平可预测内嗅皮层萎缩速率(AD最早受累脑区)。
3. 局限性
- 样本量较小(尤其纵向队列)
- nEV分离流程复杂,临床推广需简化
- 缺乏tau病理数据(p-tau181/NFL未检出)
- 未纳入其他神经退行性疾病对照
五、结论
本研究证实:
- 血浆nEV Aβ42是AD连续体的敏感生物标志物,其浓度从Aβ-NCs到ADD逐步升高。
- nEV Aβ42可识别脑Aβ沉积阳性的认知正常个体(AUC=0.663),联合APOEε4可提升至0.705。
- nEV Aβ42与脑淀粉样蛋白沉积(PET SUVR)显著正相关(R=0.532),并预测认知衰退和内嗅皮层萎缩。
该标志物为AD的早期诊断、风险分层和临床试验入组提供了新型液体活检工具,未来需通过多中心研究验证其临床适用性。
| 名称 | 货号 | 规格 |
| V-PLEX Vascular Injury Panel 2(human) Kit (25 Plate) | K15198D-4 | 25Plate |
| V-PLEX Vascular Injury Panel 2(human) Kit (5 Plate) | K15198D-2 | 5Plate |
| V-PLEX Vascular Injury Panel 2(human) Kit (1 Plate) | K15342K-4 | 25PL |