A comparison between tau and amyloid-β cerebrospinal fluid biomarkers in chronic traumatic encephalopathy and Alzheimer disease
一、研究背景与核心问题
慢性创伤性脑病(CTE)和阿尔茨海默病(AD)是两种以进行性认知衰退为特征的神经退行性疾病,其临床表型(如记忆障碍)常重叠,但病理机制截然不同:
- CTE病理特征:过度磷酸化tau蛋白(p-tau)在神经元、星形胶质细胞及皮质沟回深部小血管周围异常沉积,尤其累及皮质浅层(II-III层)。其发生与反复头部撞击(RHI)暴露密切相关。
- AD病理特征:β淀粉样蛋白(Aβ)斑块和tau蛋白神经原纤维缠结(NFTs),病理进程始于脑干和内嗅皮层,逐步向内侧颞叶及新皮质扩散。
目前,CTE的确诊依赖尸检神经病理学检查,缺乏有效的生前生物标志物。而脑脊液(CSF)中的tau蛋白(总tau/t-tau、磷酸化tau/p-tau)和Aβ(Aβ1-42、Aβ1-40)已被证实是AD的可靠生物标志物,可反映脑内病理变化并早于认知衰退出现。

核心科学问题:
CTE与AD的CSF生物标志物谱是否存在差异?能否利用这些差异实现CTE的生前诊断及与AD的鉴别?
二、研究方法与实验设计
1. 研究人群与分组
研究纳入192例尸检病例(来源:VA-BU-CLF脑库、Framingham心脏研究、BU ADRC),根据神经病理学标准严格分组:
| 病理分组 | 例数 (n) | CTE分期 | AD病理程度 (NIA-Reagan标准) |
|---|---|---|---|
| 无CTE/无AD(对照组) | 41 | - | - |
| 低阶段CTE (Low CTE) | 18 | I-II期 | 无或低概率AD |
| 高阶段CTE (High CTE) | 43 | III-IV期 | 无或低概率AD |
| 低程度AD (Low AD) | 23 | - | 低概率AD |
| 中-高度AD (Int/High AD) | 56 | - | 中-高概率AD |
| CTE合并AD (CTE+AD) | 11 | I-IV期 | 中-高概率AD |
关键病理标准:
- CTE诊断与分期:依据国际共识标准(McKee et al., 2016)
- AD病理分级:基于Braak NFT分期和CERAD神经炎性斑块密度评分
2. 脑脊液(CSF)生物标志物检测
- 样本处理:尸检后经枕骨大孔采集CSF,离心后分装储存于-80°C。
- 检测平台:Meso Scale Discovery(MSD)多因子免疫分析系统。
- 目标标志物:
- Aβ肽段:Aβ1-40, Aβ1-42
- Tau蛋白:总tau(t-tau)、磷酸化tau(p-tau181, p-tau231)
- 检测方法:采用特异性抗体(如AT270捕获p-tau181,HT7检测)。
3. 统计分析方法
- 组间比较:Kruskal-Wallis检验(非参数)比较各病理组生物标志物水平。
- 协变量校正:通过秩归一化(rank-normalization)和ANCOVA模型校正年龄、性别、死后间隔(PMI)等混杂因素。
- 诊断价值评估:
- 二元逻辑回归分析:评估p-tau231和Aβ1-42对CTE的诊断效能。
- ROC曲线分析:计算曲线下面积(AUC)评估标志物组合的敏感性与特异性。
三、核心研究结果
1. 早期疾病阶段(低阶段CTE vs 低程度AD vs 对照组)
-
p-tau231显著升高:
低阶段CTE组的p-tau231水平显著高于对照组(p=0.03)和低程度AD组(p=0.017)(图1B)。 提示p-tau231可能是CTE早期病理的特异性标志。 -
Aβ1-42显著降低:
低阶段CTE组的Aβ1-42水平显著低于对照组(p=0.006)(图1D)。 与传统AD模型不同,CTE早期即出现Aβ1-42下降。 -
其他标志物无差异:
t-tau、p-tau181、Aβ1-40在组间无统计学差异(图1A,C,E)。
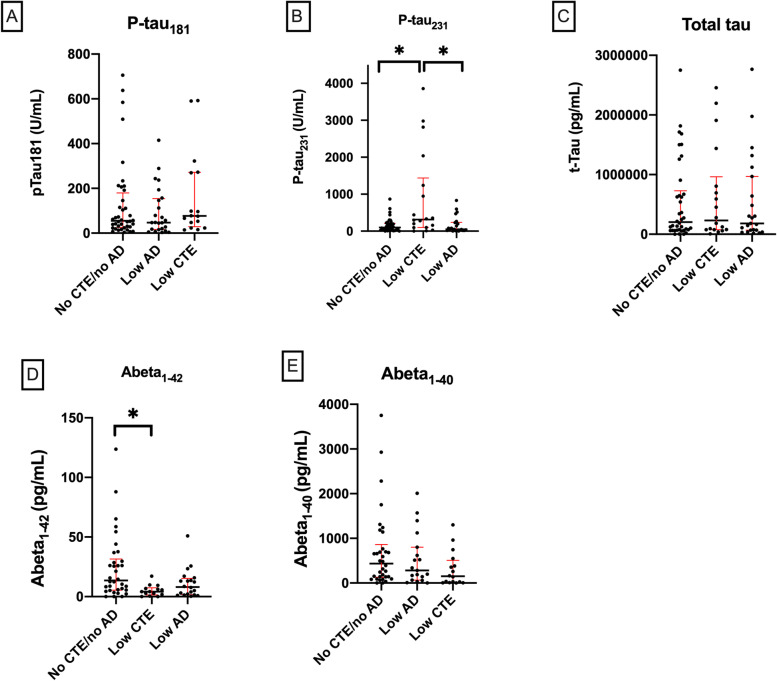
图1. 早期疾病阶段CSF生物标志物水平比较
(A)p-tau181、(B)p-tau231、(C)t-tau、(D)Aβ1-42、(E)Aβ1-40
*注:箱线图显示中位数及四分位距;p<0.05(经多重比较校正)
2. 晚期疾病阶段(高阶段CTE vs 中-高度AD vs CTE+AD)
-
p-tau231持续升高:
高阶段CTE组的p-tau231水平显著高于中-高度AD组(p=0.024)(图2B)。 -
Aβ1-42显著降低:
高阶段CTE组的Aβ1-42水平显著低于中-高度AD组(p=0.015)(图2D)。 -
其他标志物无差异:
p-tau181、t-tau、Aβ1-40在组间无显著差异(图2A,C,E)。
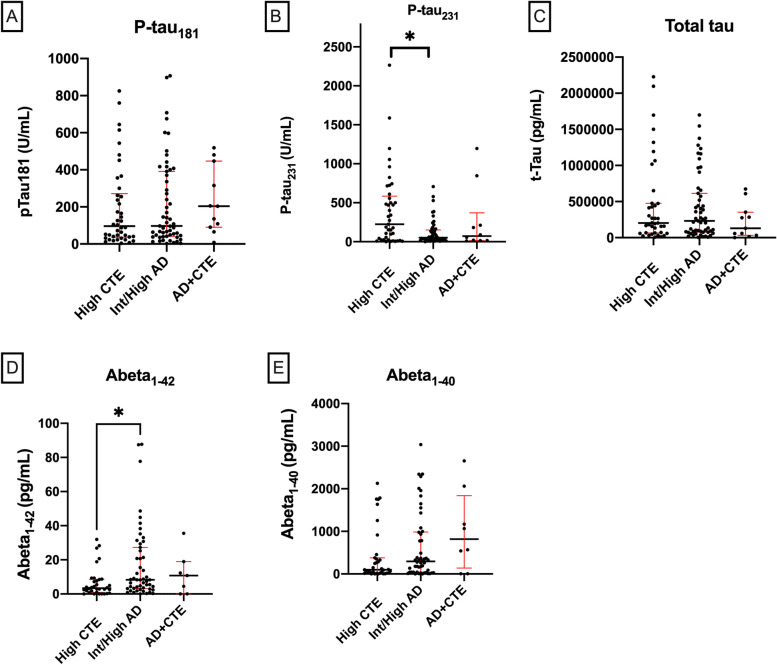
图2. 晚期疾病阶段CSF生物标志物水平比较
(A)p-tau181、(B)p-tau231、(C)t-tau、(D)Aβ1-42、(E)Aβ1-40
3. 诊断价值:p-tau231与Aβ1-42组合效能突出
-
区分CTE与对照组:
p-tau231(OR=1.53)和Aβ1-42(OR=0.35)联合模型的AUC达0.88(p<0.001)(表2,图3A)。 -
区分CTE与AD:
联合模型的AUC进一步提升至0.93(p<0.001)(图3B)。
表2. CSF标志物对CTE vs 对照组的诊断效能(二元逻辑回归)
| 变量 | OR值 | 95% CI | p值 |
|---|---|---|---|
| p-tau231 (U/10μL) | 1.53 | 1.08–2.16 | 0.016 |
| Aβ1-42 (pg/100μL) | 0.35 | 0.17–0.74 | 0.006 |

图3. ROC曲线分析 (A)CTE vs 对照组(AUC=0.88);(B)CTE vs AD(AUC=0.93)
四、关键机制讨论
1. p-tau231:CTE的潜在特异性标志物
- 病理关联性:CTE的tau病理主要分布于皮质浅层血管周围,而AD的tau缠结始于内嗅皮层。p-tau231的升高可能反映CTE特有的tau蛋白磷酸化模式或神经元损伤机制。
- 敏感性与特异性:相较于传统标志物p-tau181,p-tau231在区分CTE与AD时表现出更高特异性,提示其作为CTE特异性生物标志物的潜力。
2. Aβ1-42下降的独特意义
- 与传统AD模型的背离:在AD中,CSF Aβ1-42下降主要归因于Aβ在脑实质斑块中的沉积。但在CTE中:
- Aβ沉积呈局灶性且以弥漫性斑块为主(非神经炎性斑块)。
- 脑组织Aβ水平与CSF Aβ1-42无显著相关性(p=0.11),提示其下降可能反映清除障碍而非沉积增加。
- 血管机制假说:反复头部撞击可能导致血脑屏障损伤或淋巴清除功能受损,促使Aβ1-42滞留于脑实质而非释放入CSF。
3. CTE与AD的病理交互作用
- 共存病例分析:CTE+AD组的生物标志物谱介于单纯CTE与AD之间,提示两种病理可能独立作用而非协同放大。
- 年龄的混杂效应:CTE组平均年龄显著低于AD组(低阶段CTE: 64.6岁 vs 低程度AD: 86.7岁),但统计模型通过年龄校正证实了标志物的独立诊断价值。
五、研究亮点与局限性
创新性贡献:
- 首个CTE尸检CSF生物标志物研究:填补了CTE缺乏可靠体液诊断标志物的空白。
- 发现p-tau231的鉴别价值:为开发CTE特异性检测提供新靶点。
- 提出Aβ清除障碍假说:挑战传统“沉积-清除”模型,推动CTE机制研究。
局限性:
- 尸检CSF的固有偏差:死后自溶可能影响蛋白稳定性(尽管通过pH/RIN/血红蛋白控制质量)。
- 年龄与性别偏倚:CTE组以年轻男性为主,AD组含更多女性,需在生前队列验证。
- 接触运动史数据缺失:部分病例缺乏RHI暴露量化数据,无法完全排除混杂。
六、结论与临床意义
本研究首次系统证实:
- p-tau231升高是CTE的敏感标志物,尤其在早期阶段即显著区别于AD和对照组。
- Aβ1-42下降在CTE中同样显著,但其机制可能与AD不同,反映清除障碍而非沉积增加。
- 联合p-tau231与Aβ1-42可高效区分CTE与AD(AUC=0.93),为开发CTE生前诊断工具奠定基础。
未来方向:
- 在生前队列(如退役运动员)中验证p-tau231的诊断效能。
- 探索血浆p-tau231作为无创筛查标志物的可行性。
- 深入研究CTE中Aβ代谢异常的分子机制。
| 名称 | 货号 | 规格 |
| V-PLEX Vascular Injury Panel 2(human) Kit (25 Plate) | K15198D-4 | 25Plate |
| V-PLEX Vascular Injury Panel 2(human) Kit (5 Plate) | K15198D-2 | 5Plate |
| V-PLEX Vascular Injury Panel 2(human) Kit (1 Plate) | K15342K-4 | 25PL |







