Durability of ChAdOx1 nCoV-19 vaccination in people living with HIV
引言:HIV感染者的疫苗应答挑战
HIV感染者(PWH)因慢性免疫激活、CD4+ T细胞功能异常及滤泡辅助性T细胞(Tfh)频率变化,常表现出疫苗应答减弱。随着SARS-CoV-2变异株(VOCs)的出现,评估ChAdOx1 nCoV-19(AZD1222)疫苗在PWH中的长期免疫效果至关重要。本研究作为COV002临床试验(NCT04400838)的子研究,首次系统评估了54名接受稳定抗逆转录病毒治疗(ART)的PWH接种两剂疫苗后6个月的免疫持久性,并与HIV阴性对照组进行比较。
关键问题:
- HIV相关的免疫耗竭是否影响疫苗应答的维持?
- 对变异株(Alpha/Beta/Gamma/Delta)的交叉保护是否持久?
- 预存的地方性冠状病毒(CCC)免疫能否增强疫苗反应?
研究方法与队列特征
研究设计
- 人群:54名男性PWH(年龄42.5±7.3岁),均接受ART治疗(病毒载量<50 copies/mL,CD4+ T细胞>350 cells/μL),与50名HIV阴性对照(年龄38.5±10.3岁)匹配。
- 干预:两剂ChAdOx1 nCoV-19疫苗,间隔4-6周。
- 时间点:接种前(D0)、接种后14天(D14)、28天(D28)、42天(D42)、56天(D56)及182天(D182)。
- 检测指标:
- 体液免疫:抗S/RBD/N蛋白IgG(ELISA/MSD)、活病毒中和试验(FRNT)、ACE2抑制试验。
- 细胞免疫:IFNγ ELISpot、T细胞增殖(CTV稀释法)、激活标志物(AIM)检测。
- 交叉反应:针对HKU1、OC43、229E、NL63等CCC的抗体与T细胞应答。
免疫激活基线差异
PWH表现出持续的免疫激活和耗竭特征(图1):
- CD38+HLA-DR+ CD4+/CD8+ T细胞频率显著高于对照组(p<0.001)。
- T-betloEomeshi 耗竭性CD4+/CD8+ T细胞比例升高(p<0.01)。 接种后14天出现短暂激活升高,但至D182恢复至基线水平(补充图1)。
图一
表1:PWH与对照组免疫激活标志物比较(D182)
标志物 PWH(中位数%) 对照组(中位数%) p值 CD4+ CD38+HLA-DR+ 8.7 3.2 <0.001 CD8+ CD38+HLA-DR+ 12.5 4.1 <0.001 CD4+ T-betloEomeshi 15.3 5.6 <0.01 CD8+ T-betloEomeshi 18.9 7.3 <0.01
体液免疫应答:抗体持久性但中和活性下降
抗体动态变化
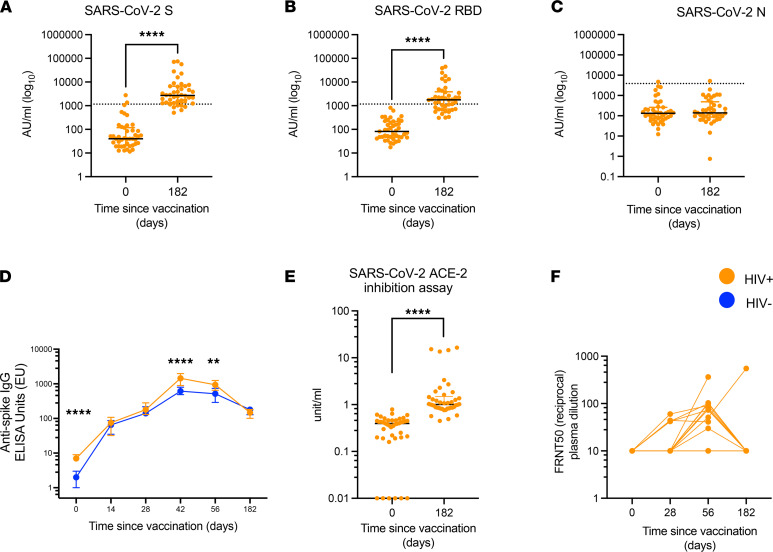
- 抗S/RBD IgG:D182时83.3% PWH维持阳性抗S抗体(图2A),64.2%维持抗RBD抗体(图2B),且滴度与HIV阴性组无差异(图2D)。
- 抗N抗体:始终阴性(图2C),排除自然感染干扰。
- 衰减趋势:抗S IgG从D56峰值(中位数4,200 AU/mL)降至D182(1,850 AU/mL),但仍显著高于基线(p<0.001)(补充图2D)。
功能性抗体分析
- ACE2抑制活性:D182时显著高于基线(p<0.001)(图2E),且与抗RBD滴度强相关(r=0.82, p<0.0001)(补充图2C)。
- 中和抗体:活病毒中和试验(FRNT)显示,92%(13/14)的PWH在D182时中和滴度降至检测限以下(FRNT50 <20)(图2F)。表明尽管结合抗体持续存在,但功能性中和能力显著衰减。
图2:体液免疫应答动态
(A-C)抗S/RBD/N IgG水平;(D)PWH与对照组抗S IgG对比;(E)ACE2抑制率;(F)活病毒中和滴度
细胞免疫应答:T细胞反应持久但增殖能力减弱
IFNγ ELISpot与增殖试验
- IFNγ分泌:SARS-CoV-2特异性T细胞反应在D182仍维持(图3A),且与对照组无差异(图3B)。
- 增殖动态:
- CD4+ T细胞对S1/S2肽库的增殖率在D42达峰(S1:4.8%;S2:3.5%),D182降至2.1%/1.7%(图3C-D)。
- CD8+ T细胞增殖率较低(D42峰值:S1 1.9%;S2 1.5%),D182进一步衰减(图3E-F)。
- 表型特征:
- 疫苗特异性CD4+ T细胞(AIM+)以Th17(CXCR3-CCR6+)为主(图4H),与HIV Gag/CMV特异性反应相似(图4F-G)。
- 未发现特定Th亚群与抗体滴度相关。
图3:T细胞应答动态

(A)IFNγ ELISpot;(B)PWH与对照组对比;(C-F)CD4+/CD8+ T细胞增殖率
对变异株(VOCs)的交叉反应
体液免疫
- ACE2抑制:对Alpha/Beta/Gamma变异株的抑制率均低于野生株(WT)(p<0.01),其中Beta/Gamma下降最显著(降幅>50%)(图5A-B)。
细胞免疫
- T细胞增殖:
- CD4+ T细胞对S1的反应在各VOCs间无差异(图5C)。
- CD4+ T细胞对S2的反应对所有VOCs均减弱(p<0.05)(图5D),可能与S2保守区突变有关。
- CD8+ T细胞对Delta-S2的反应在PWH中低于对照组(p<0.05)(图5G-J)。
图五
表2:VOCs的T细胞增殖反应比较(D182)
抗原 WT(中位数%) Beta(%) Gamma(%) Delta(%) CD4+ S1 2.1 1.9 1.8 2.0 CD4+ S2 1.7 1.3* 1.4* 1.5* CD8+ S2 0.8 0.7 0.7 0.6* 与WT相比p<0.05
预存免疫对疫苗应答的影响
预存交叉反应性T细胞
- 基线应答者(BR):23/54名PWH存在预存SARS-CoV-2反应(增殖率>1%)。
- 增强效应:BR组在接种后各时间点的CD4+ T细胞增殖率均高于无应答者(B-NR)(图6A-B)。
- 机制关联:
- BR组的预存反应与Beta属CCC(HKU1/OC43)的S2特异性T细胞相关(r>0.6, p<0.001)(图6C-D)。
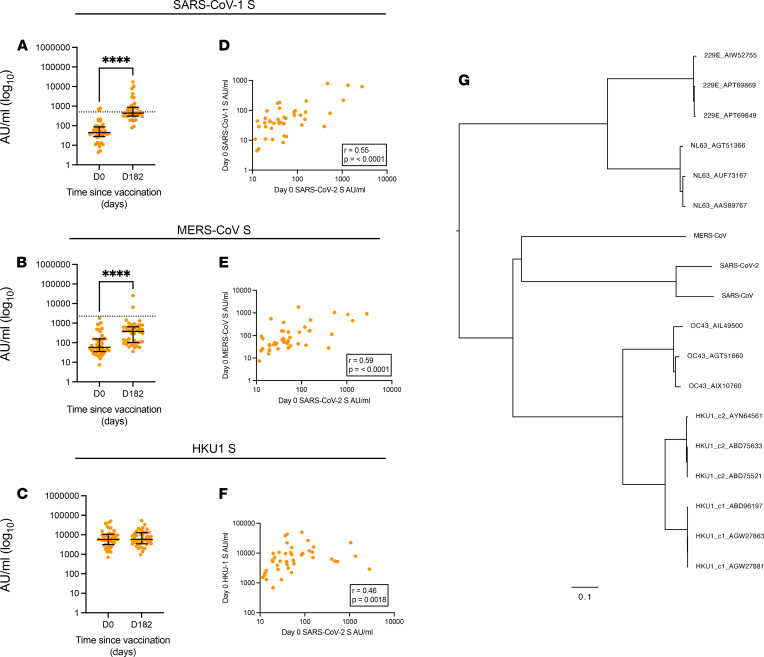
- 抗HKU1/OC43抗体与抗SARS-CoV-2 S抗体强相关(r=0.71/0.68, p<0.001)(图7D-F)。
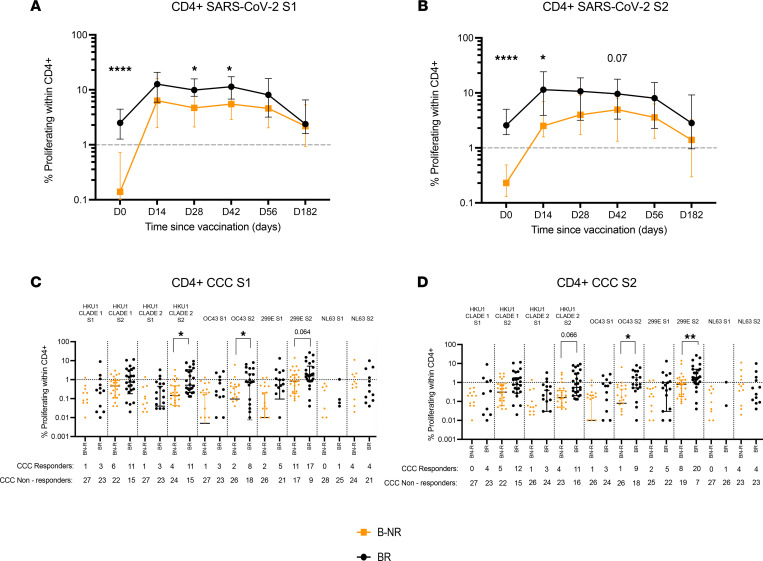 图六
图六
系统发育分析
SARS-CoV-2与Beta属CCC(HKU1/OC43)的S蛋白同源性最高(图7G),解释了交叉反应基础。
图7:预存免疫的关联分析
(G)冠状病毒S蛋白系统发育树;(D-F)抗SARS-CoV-2与CCC抗体的相关性
讨论与临床意义
核心发现
- 免疫持久性:PWH的体液与细胞免疫应答可持续6个月,且与HIV阴性人群无差异,支持现行疫苗接种策略。
- 中和衰减挑战:尽管结合抗体持续存在,92%的PWH在6个月时丧失中和活性,提示需加强针。
- 变异株应对:对Beta/Gamma株的中和活性显著下降,但T细胞反应部分保留,可能与重症保护相关。
- 预存免疫价值:既往Beta属冠状病毒(HKU1/OC43)暴露可能通过交叉反应性T细胞增强疫苗应答。
局限性
- 样本量较小(n=54)且仅限男性。
- 未评估非中和抗体功能(如ADCP/ADCC)。
- 未直接验证预存免疫对临床结局的影响。
实践建议
- 加强针必要性:鉴于中和抗体衰减,PWH应优先接种加强针。
- 长期监测:需持续评估12个月以上应答及对新兴变异株(如Omicron)的反应。
- 疫苗策略优化:针对预存免疫的机制研究可能指导新型疫苗设计。
结论
本研究首次证实:接受ART治疗的PWH接种ChAdOx1 nCoV-19疫苗后,体液与细胞免疫应答可持续6个月,且与HIV阴性人群相当。尽管中和活性显著衰减,但对变异株的T细胞交叉反应仍部分保留。预存的Beta属冠状病毒免疫可能增强疫苗应答,为优化PWH的免疫策略提供了关键依据。
| 名称 | 货号 | 规格 |
| hKLK3 DuoSet (1 KIT) | DY1344 | 1KIT |
| U-PLEX Metabolic 3-Plex Combo 2 (ms) SECTOR (5 PL) | K15305K-2 | 5PL |
| RNeasy Micro Kit (50) | 74004 | 50Test |