A Novel Microphysiological Colon Platform to Decipher Mechanisms Driving Human Intestinal Permeability
研究背景与意义
肠道屏障功能在人体健康中起着至关重要的作用,其功能障碍与多种疾病密切相关。肠道屏障主要由肠道上皮细胞通过紧密连接形成,能够有效地将宿主免疫系统与共生菌群分隔开,从而维持肠道内环境的稳态。然而,肠道屏障功能的破坏(即“肠漏”现象)与感染、炎症性肠病(IBD)、药物毒性以及衰老等多种疾病有关。近年来,尽管科学家们在理解肠道屏障功能及其病理生理机制方面取得了显著进展,但由于缺乏能够模拟人类肠道上皮分子特征和结构的类器官系统,严重阻碍了相关治疗策略的开发和生理机制的深入研究。
为了解决这一问题,研究人员开发了一种新型的微生理结肠平台——Colon Intestine-Chip。该平台结合了人体活检来源的富含亮氨酸重复序列的G蛋白偶联受体5(LGR5)阳性的类器官和器官芯片技术,旨在模拟人类肠道上皮的特性,为研究肠道屏障完整性提供新的视角和工具。这一创新平台不仅能够模拟体内肠道屏障的动态微环境,还能够精确控制实验条件,为研究肠道屏障功能障碍的机制提供了前所未有的机会。
方法与实验设计
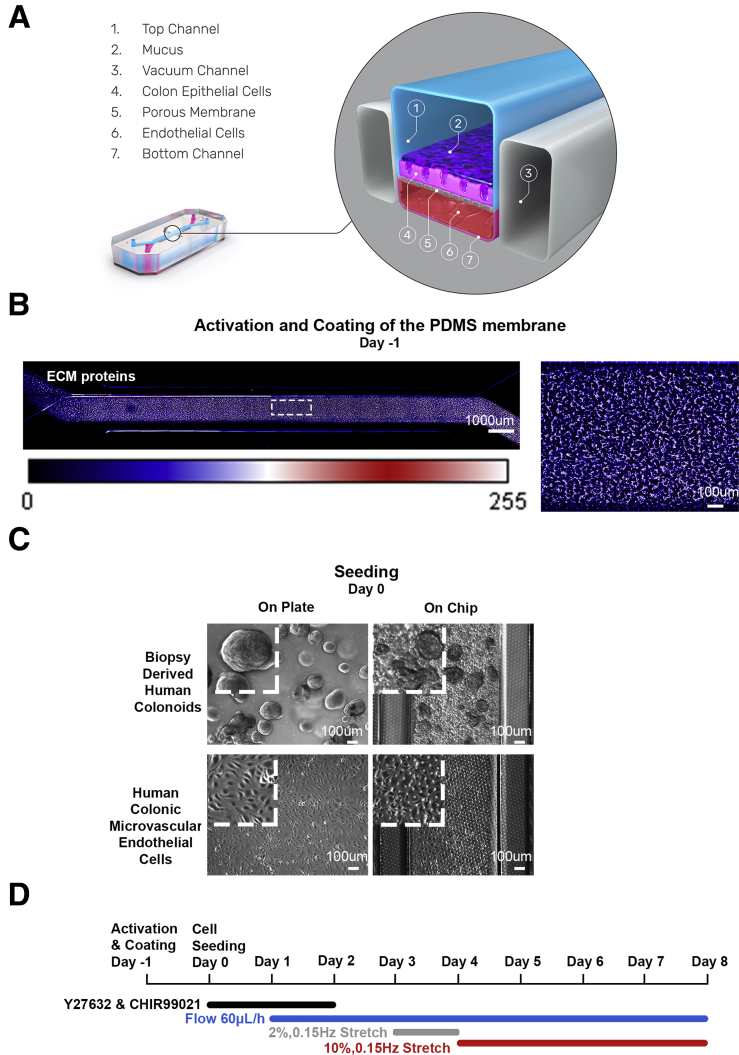
研究人员利用人体结肠活检样本分离得到的类器官和结肠特异性微血管内皮细胞,在Colon Intestine-Chip上构建了三维黏膜层。芯片的上下表面预先涂覆了细胞外基质(ECM)蛋白,分别接种了经酶处理的类器官片段和内皮细胞。实验过程中,通过Zoë Culture Module(Emulate, Inc)维持流体流动,并在培养初期添加支持干细胞特性的因子Y-27632和CHIR99021,随后逐步施加周期性拉伸以模拟肠道的蠕动样运动。研究人员通过RNA测序分析、免疫荧光染色、扫描电子显微镜等多种技术手段,对芯片上的细胞进行了全面的表征,以验证其与人体组织和悬浮培养类器官的相似性,并评估了不同供体间系统的变异性。
细胞培养与芯片建立
类器官培养:研究人员使用来自两名男性供体和一名女性供体的人体结肠活检样本,按照约翰霍普金斯大学机构审查委员会批准的实验方案,分离并培养类器官。类器官在含有Matrigel的培养基中培养,并添加了IntestiCult类器官生长培养基、抗生素primocin以及干细胞支持因子Y-27632和CHIR99021。
内皮细胞培养:结肠特异性微血管内皮细胞(cHIMECs)购自Cell Biologics和Cell Systems,培养在含有5%胎牛血清的内皮细胞生长培养基MV2中。
芯片建立:Colon Intestine-Chip由两个平行通道组成,通道之间由一个多孔聚二甲基硅氧烷(PDMS)膜分隔。在芯片建立过程中,研究人员对PDMS膜进行预处理,包括使用Emulate Reagent 1和Emulate Reagent 2进行活化,随后用胶原蛋白IV和Matrigel进行包被。类器官和内皮细胞分别接种在芯片的上通道和下通道,并在特定条件下进行培养。
实验条件与刺激
研究人员通过在内皮细胞通道中施加不同浓度的干扰素-γ(IFN-γ)和白细胞介素-22(IL-22),模拟体内炎症条件下对肠道上皮屏障的影响。实验中,IFN-γ被用于评估其对结肠屏障的影响,而IL-22则因其在IBD中的矛盾作用而被特别关注。研究人员详细记录了细胞在不同刺激条件下的形态变化、紧密连接蛋白的表达、细胞凋亡情况以及上皮屏障的通透性变化。
实验结果与关键发现
芯片平台的验证
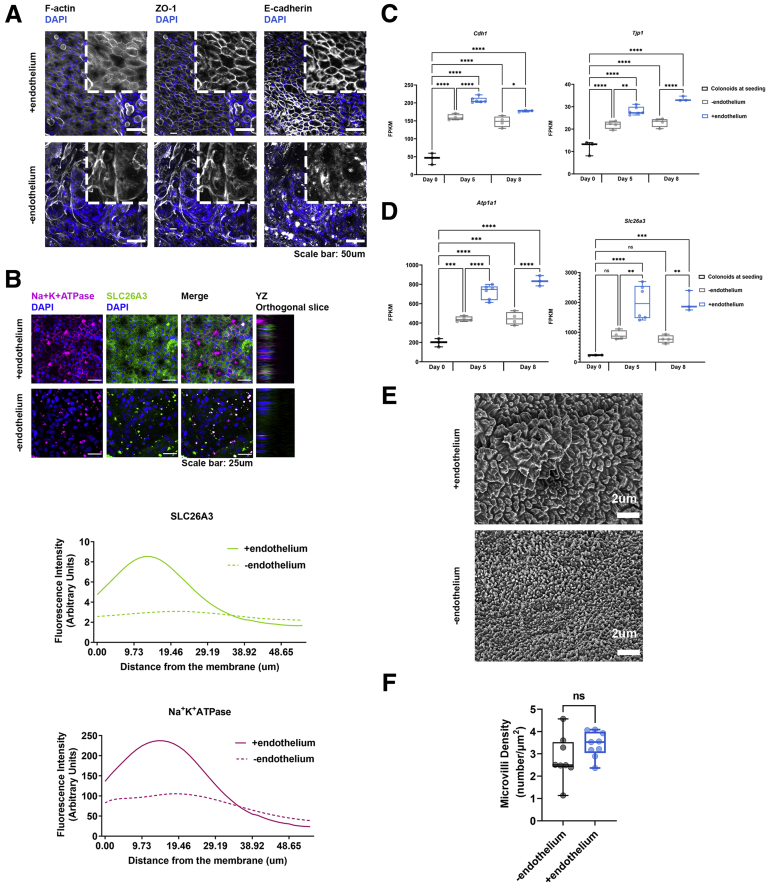
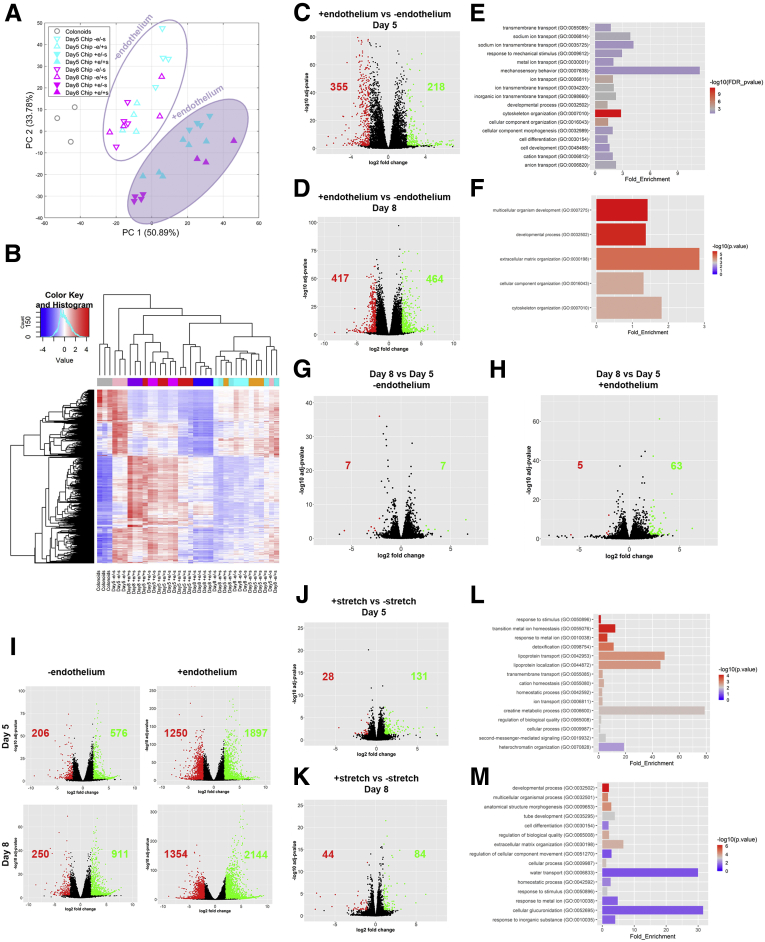
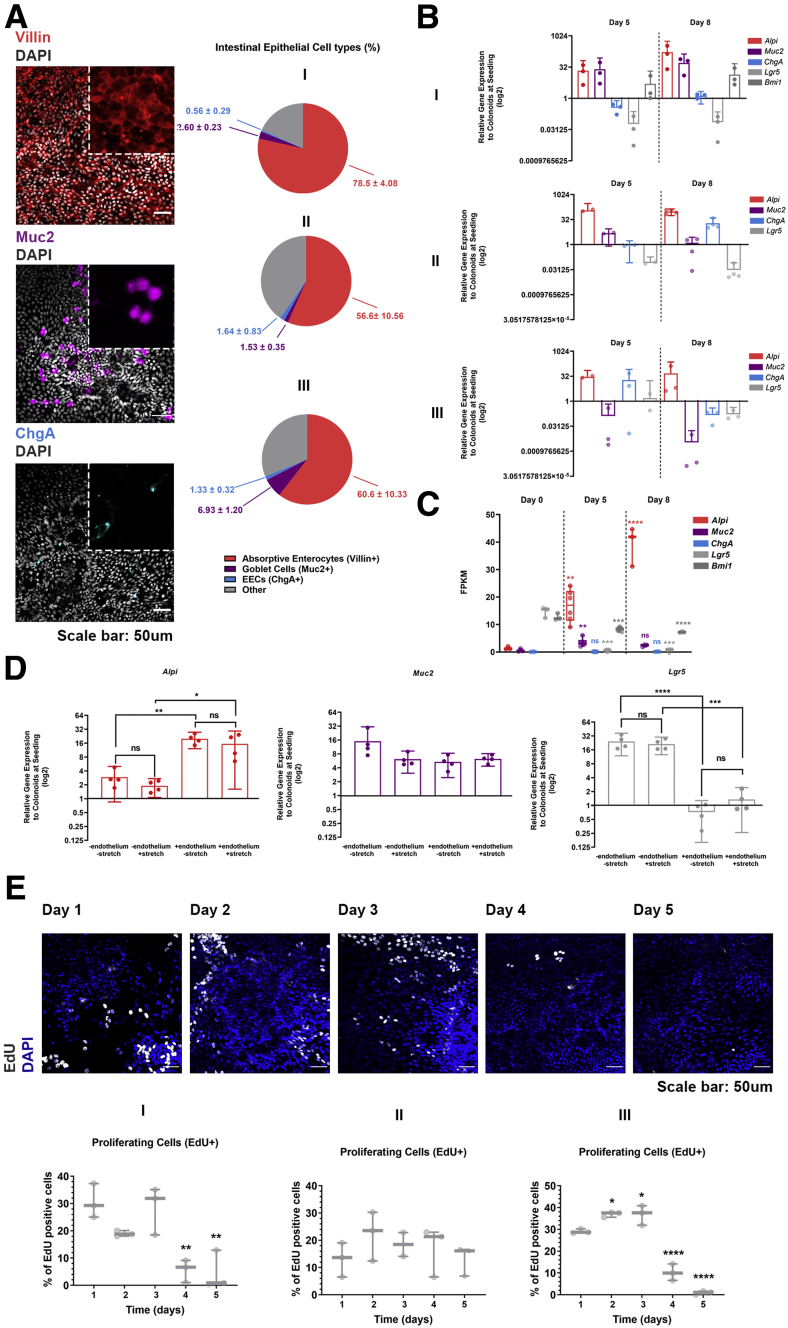
实验数据显示,Colon Intestine-Chip成功模拟了人体肠道上皮的细胞结构和功能特征。通过RNA测序分析,研究人员发现芯片上的类器官衍生肠道上皮细胞(IECs)与悬浮培养的类器官相比,在基因表达谱上存在显著差异,表明芯片环境能够促进细胞的分化和成熟。免疫荧光染色结果显示,ZO-1和E-钙黏蛋白(E-cadherin)等紧密连接蛋白在芯片培养的IECs中呈现出典型的细胞膜定位,而在悬浮培养的类器官中则主要位于细胞质中。此外,扫描电子显微镜观察到芯片培养的IECs形成了成熟的刷状缘,微绒毛密集排列,这在悬浮培养的类器官中并未观察到。
内皮细胞在肠道屏障形成中的作用
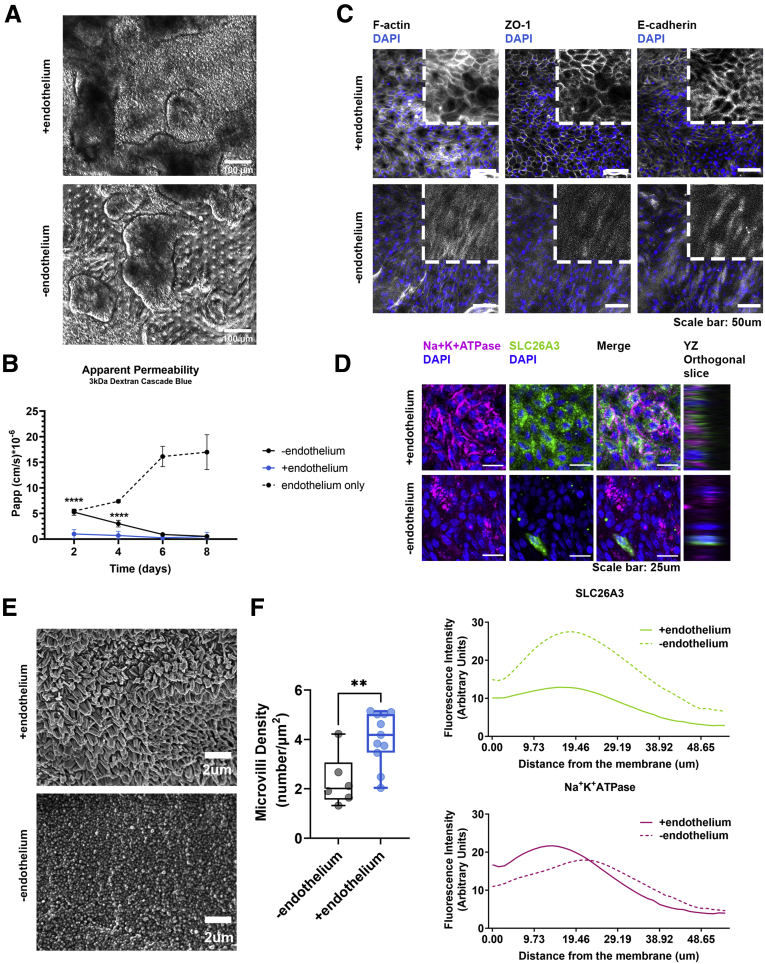
研究发现,与内皮细胞共培养显著增强了肠道上皮屏障的完整性。具体表现为,在存在内皮细胞的情况下,3 kDa FITC-葡聚糖的表观渗透系数(Papp)显著降低,表明肠道上皮屏障的通透性降低。此外,共培养体系中IECs的紧密连接网络在培养早期即已形成,并在后续培养中得以维持。相比之下,缺乏内皮细胞的培养体系中,紧密连接结构不完整,ZO-1和E-cadherin蛋白主要位于细胞质中。这些结果表明,内皮细胞在肠道上皮屏障的形成和成熟过程中发挥着关键作用。
IL-22对肠道屏障的影响
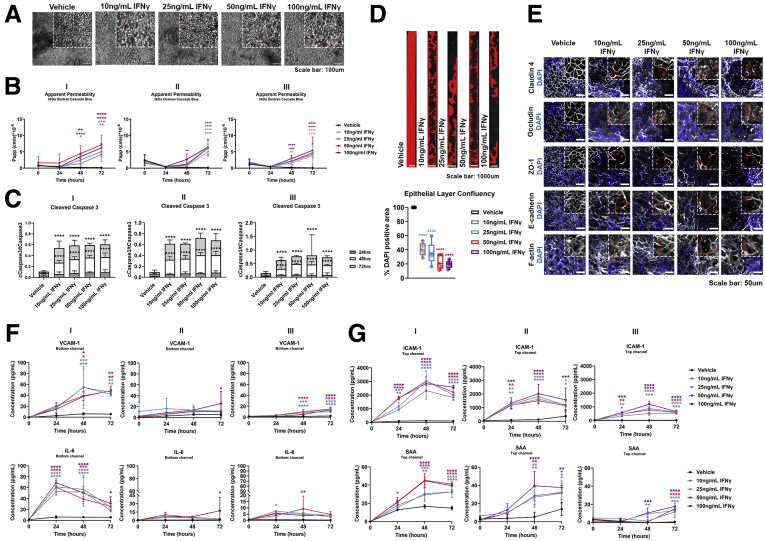
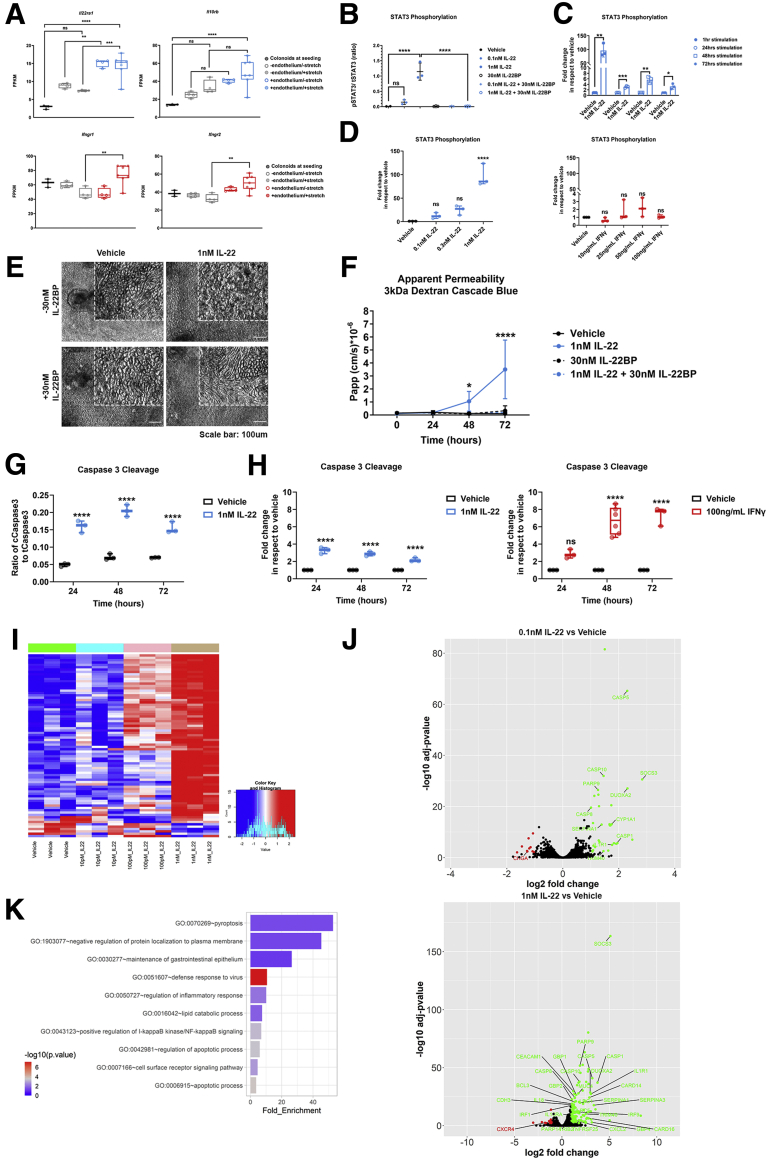
与以往在小鼠模型中观察到的保护性作用不同,研究人员发现IL-22在人体Colon Intestine-Chip中诱导了肠道上皮屏障的破坏。实验中,IL-22处理导致IECs的形态发生改变,细胞边界模糊,浮游细胞数量增加。同时,Papp值显著升高,表明肠道上皮屏障的通透性增加。此外,IL-22处理还诱导了Caspase 3的裂解和活性增加,提示IL-22可能通过促进细胞凋亡来破坏肠道屏障功能。基因本体(GO)富集分析进一步支持了这些发现,显示IL-22处理显著富集了与炎症反应和凋亡途径相关的生物过程。
图表与数据支持
图1:展示了Colon Intestine-Chip的结构示意图,包括上皮通道、黏液层、真空腔室、结肠IECs、PDMS膜、cHIMECs和内皮通道。
图2:显示了在存在或缺失内皮细胞的情况下,结肠上皮细胞在培养第5天的相衬图像,以及3 kDa FITC-葡聚糖的Papp值变化。
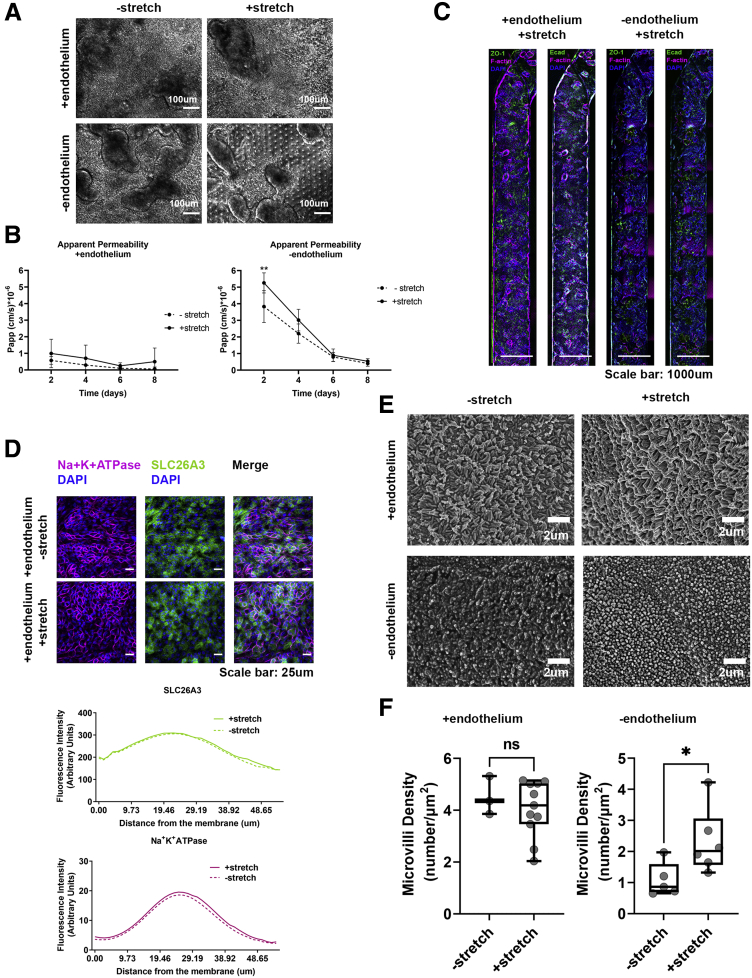
图3:描绘了在存在或缺失拉伸条件下,结肠上皮细胞的ZO-1和E-钙黏蛋白的免疫荧光染色图像,以及Na+/K+ ATPase和SLC26A3的极性表达情况。
图4:展示了在存在内皮细胞的情况下,结肠上皮细胞在培养第8天的ZO-1和E-钙黏蛋白的免疫荧光染色图像,以及基因表达分析结果。
图5:呈现了不同培养条件下IECs的基因表达差异的主成分分析(PCA)和差异表达基因的火山图。
图6:展示了在芯片培养的IECs中,吸收性肠细胞、杯状细胞和内分泌细胞的免疫荧光图像及基因表达分析结果。
图7:描绘了IFN-γ处理对结肠上皮单层形态、Papp值、Caspase 3活性、上皮层覆盖面积以及紧密连接蛋白分布的影响。
图8:展示了IL-22及其受体在IECs中的表达,IL-22对STAT3磷酸化的影响,以及IL-22处理对IECs形态、Papp值、Caspase 3活性和基因表达的影响。
研究结论与展望
研究人员开发的Colon Intestine-Chip平台为研究人类肠道上皮屏障的发育和稳态提供了一个强大的工具。该平台不仅能够模拟肠道屏障的动态微环境,还能够揭示在炎症条件下肠道屏障功能障碍的机制。通过在芯片上施加IFN-γ和IL-22等细胞因子,研究人员成功模拟了肠道屏障的破坏过程,并发现了IL-22在人体肠道屏障中与小鼠模型不同的作用机制。这些发现不仅增进了我们对肠道屏障功能调节的理解,还为开发针对肠道屏障功能障碍的治疗策略提供了新的靶点。
未来,研究人员计划进一步利用Colon Intestine-Chip平台探索更多与肠道屏障相关的生物学过程和疾病机制。例如,通过基因编辑技术(如CRISPR-Cas9)在芯片上的细胞中引入特定的基因突变,研究这些突变如何影响肠道屏障功能。此外,该平台还可以用于测试和筛选能够增强或修复肠道屏障功能的药物,为临床治疗提供新的思路和方法。
| 名称 | 货号 | 规格 |
| V-PLEX Vascular Injury Panel 2(human) Kit (25 Plate) | K15198D-4 | 25Plate |
| V-PLEX Vascular Injury Panel 2(human) Kit (5 Plate) | K15198D-2 | 5Plate |
| V-PLEX Vascular Injury Panel 2(human) Kit (1 Plate) | K15198D-1 | 1Plate |