Messenger RNA expressing PfCSP induces functional, protective immune responses against malaria in mice
一、文献背景与研究意义
疟疾作为一种跨越人类历史的传染性疾病,至今仍是全球重大公共卫生威胁。据世界卫生组织(WHO)2019 年报告,2018 年全球疟疾临床病例达 2.28 亿例,死亡人数 40.5 万,其中恶性疟原虫(Plasmodium falciparum)是导致发病率和死亡率最高的疟原虫种类。目前疟疾防控依赖媒介控制、抗疟药物及疫苗,但蚊虫抗药性和寄生虫药物抗性的蔓延,使得研发高效疫苗成为当务之急。
当前临床进展最领先的疟疾疫苗候选物 RTS,S/AS01,其保护效力仅为 30%~40%,且随时间衰减。该疫苗基于恶性疟原虫子孢子期主要表面抗原 —— 环子孢子蛋白(PfCSP)的 C 端片段及 18 个 NANP 重复序列,与乙肝表面抗原形成病毒样颗粒(VLP)。为突破传统疫苗的局限,研究人员转向新型疫苗技术,其中信使 RNA(mRNA)平台凭借精准抗原设计、不整合宿主基因组、同时激活体液与细胞免疫的优势,在新冠疫苗成功应用后,成为传染病疫苗研发的前沿方向。
本文(发表于npj Vaccines 2021 年,DOI: 10.1038/s41541-021-00345-0)以 PfCSP 为靶抗原,构建 PfCSP mRNA 疫苗,通过脂质纳米颗粒(LNP)递送,系统评估其在哺乳动物细胞中的表达效率、小鼠模型中的免疫原性及抗疟保护效果,探索剂量、免疫间隔、mRNA 修饰等因素对疫苗效力的影响,为疟疾 mRNA 疫苗研发提供关键数据支撑。
二、研究材料与方法解析
2.1 核心实验材料
2.1.1 PfCSP mRNA 设计与制备
研究采用两种 PfCSP mRNA(表 1),均基于恶性疟原虫 3D7 株 PfCSP 序列(NCBI 参考序列:XM_001351086.1),编码全长 PfCSP(含 N 端、38 个 NANP 重复区、C 端 α-TSR 区),但去除糖基磷脂酰肌醇(GPI)锚定序列以避免膜定位干扰。两种 mRNA 的关键差异在于核苷修饰、密码子优化及纯化方式,直接影响其稳定性与免疫原性。
表 1 PfCSP mRNA 的关键特性对比
2.1.2 脂质纳米颗粒(LNP)制剂
为解决 mRNA 体外易降解、细胞摄取效率低的问题,研究采用三种基于 Acuitas Therapeutics 专利脂质的 LNP 制剂(表 2),核心成分为可电离脂质(pKa 6.0~6.5)、DSPC、胆固醇、PEG - 脂质,通过自组装法封装 PfCSP mRNA( aqueous 相 mRNA 与乙醇相脂质快速混合)。LNP 的理化特性直接影响 mRNA 递送效率,其中粒径、多分散指数(PDI)及包封率是关键指标。
表 2 三种 LNP 制剂的理化表征
2.1.3 细胞系与动物模型
细胞系:中国仓鼠卵巢细胞(CHO-E77.4),用于 mRNA 转染与 PfCSP 表达验证,培养于含 10% 胎牛血清、2mM L - 谷氨酰胺及青霉素 - 链霉素的 RPMI-1640 培养基中 。
动物模型:5~6 周龄雌性 BALB/cJ 及 C57BL/6 小鼠,分别用于同源与异源疟原虫挑战实验。挑战用疟原虫为转基因伯氏疟原虫(Pb-PfCSP) ,包括表达恶性疟原虫 NF54/3D7 株 PfCSP 的 Pb (ANKA)-PfCSP(用于 BALB/c)及表达 Wellcome 株 PfCSP 的 Pb-PfCSP(用于 C57BL/6),子孢子从感染的斯氏按蚊唾液腺中提取。
2.2 关键检测方法
2.2.1 PfCSP 表达验证
免疫荧光染色:CHO 细胞转染 PfCSP mRNA 后 16h,用抗 PfCSP 单克隆抗体(2A10)与 FITC 标记二抗孵育,DAPI 染核,通过荧光显微镜观察 PfCSP 定位,计算 FITC/DAPI 荧光面积比量化表达水平。
Western blot:收集转染后 8、24、48h 的细胞沉淀(pellet)与上清(supernatant),经 SDS-PAGE 电泳后转印至硝酸纤维素膜,用兔抗 r-PfCSP 多克隆抗体检测,以 10ng 重组 PfCSP(r-PfCSP,分子量~33kDa,凝胶迁移~50kDa)为参照,ImageJ 软件分析条带密度 。
2.2.2 免疫应答评估
体液免疫检测:
ELISA:包被 r-PfCSP、(NANP)₆重复肽或 α-TSR 肽,检测血清中特异性 IgG 滴度(定义为 OD₄₁₅=1 时的稀释度)、抗体亲和力(硫氰酸钠变性法计算亲和力指数)及 IgG 亚类(IgG1、IgG2a、IgG2b)。
肝期发育抑制实验(ILSDA):将小鼠血清(1:40 稀释)与恶性疟原虫子孢子共孵育后感染人肝细胞,通过定量疟原虫 18S rRNA 计算子孢子入侵抑制率,评估抗体功能性。
细胞免疫检测:
ELISpot:分离免疫后小鼠脾细胞,用 PfCSP 重叠 15 肽库刺激,检测 IFN-γ 分泌细胞(斑点形成细胞,SFC)数量。
MSD 多因子检测:脾细胞刺激 48h 后,采用 Meso Scale Discovery 平台定量上清中 10 种细胞因子(IFN-γ、TNF-α、IL-2、IL-12p70 等 Th1 因子;IL-4、IL-5 等 Th2 因子;IL-1β、IL-6 等促炎因子)。
2.2.3 保护效果评估
小鼠免疫后 2 周,静脉注射 1000 个 Pb-PfCSP 子孢子,于挑战后 7、8、10、11、14 天制作 Giemsa 染色薄血涂片,显微镜观察血期寄生虫。
三、核心研究结果解析
3.1 PfCSP mRNA 在哺乳动物细胞中的表达与定位
PfCSP 的有效表达是疫苗发挥作用的前提。研究通过免疫荧光与 Western blot 验证了 PfCSP mRNA 在 CHO 细胞中的表达特性(图 1):
表达定位:免疫荧光显示,PfCSP 主要定位于细胞质(FITC 信号与 DAPI 核信号无重叠),阴性对照(仅转染试剂)无 FITC 信号;Western blot 结果表明,PfCSP 仅在细胞沉淀(pellet)中检测到,上清(supernatant)中未检测到(图 1B),证明 PfCSP 为细胞关联蛋白,即使含天然信号肽也不分泌,这一特性可避免抗原被体液稀释,增强抗原提呈效率。
表达动力学:Western blot 条带密度分析显示,PfCSP 表达在转染后 8~24h 达到峰值,48h 时蛋白水平显著下降(图 1B);两种 mRNA-LNP(TriLink 与 UPenn)转染后 48h,均能在细胞沉淀中检测到 PfCSP,且 UPenn mRNA-LNP 的表达水平显著高于 TriLink(图 1C),提示核苷修饰可能提升 mRNA 的翻译效率或稳定性。
图 1 PfCSP mRNA 在 CHO 细胞中的表达与定位
A:免疫荧光染色结果(×630 magnification),左:DAPI 核染色(蓝色),中:PfCSP FITC 染色(绿色),右:叠加图;B:不同时间点(8h、24h、48h)CHO 细胞 pellet 与 supernatant 的 Western blot 分析,r-PfCSP(10ng)为参照,箭头指示 PfCSP 条带(~60kDa);C:PfCSP mRNA-LNP(TriLink vs UPenn)转染 48h 后的 Western blot 对比,Boost+TransIT 为阳性对照。
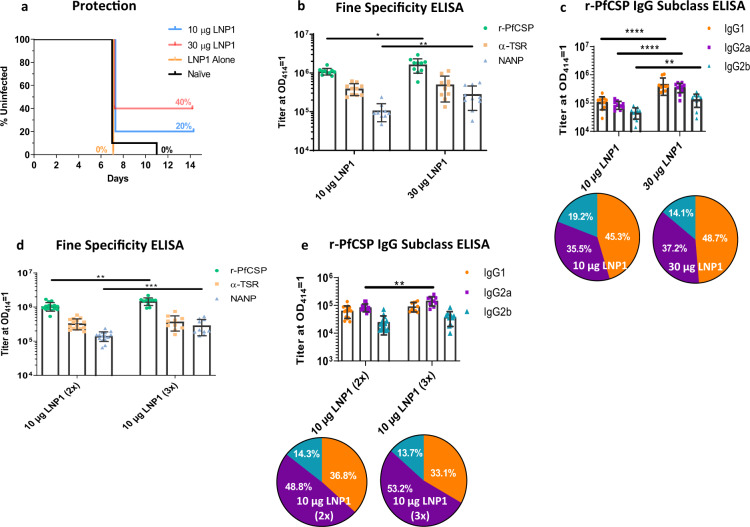
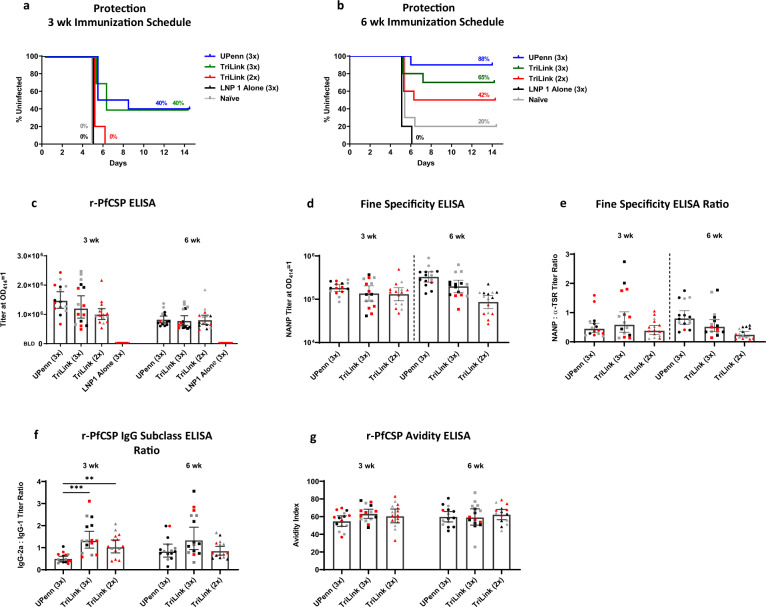
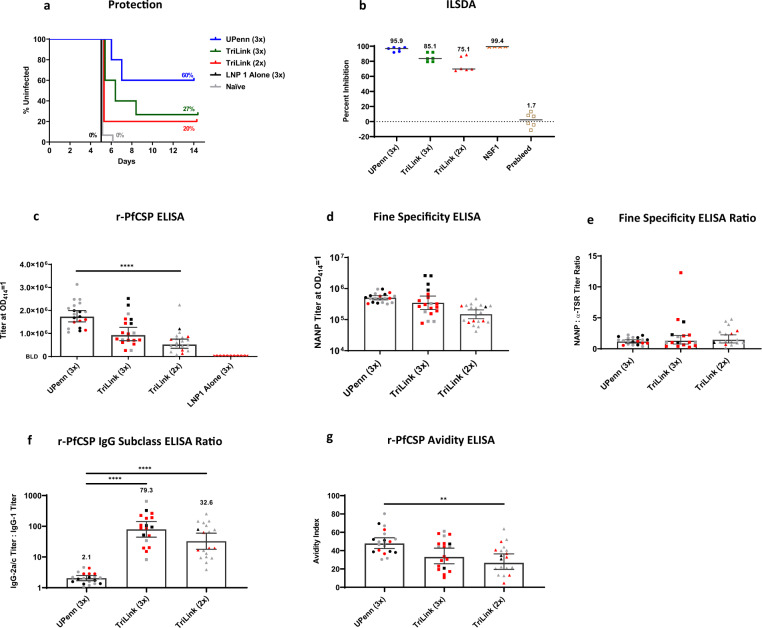
3.2 PfCSP mRNA-LNP 平台的免疫原性分析
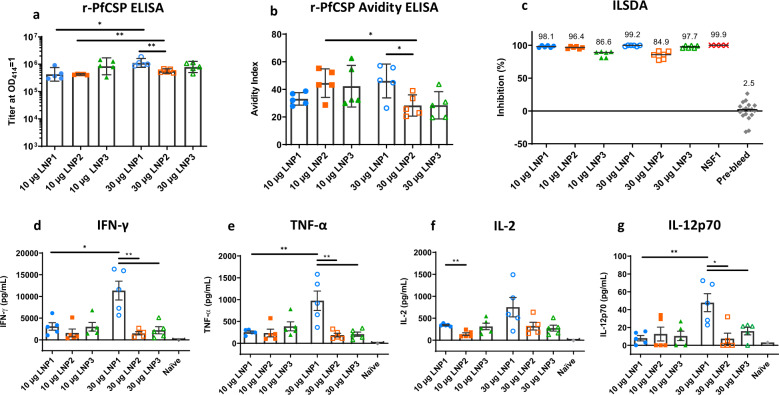
LNP 作为 mRNA 递送载体,同时发挥 “保护 mRNA + 佐剂” 双重功能。研究对比三种 LNP 制剂的免疫原性,发现 LNP1 在体液与细胞免疫诱导中表现最优(图 2、表 3):
体液免疫应答:
IgG 滴度:两剂免疫(3 周间隔)后,LNP1 高剂量组(30μg)的 r-PfCSP 特异性 IgG 滴度(几何均值~10⁶)显著高于 LNP2 高剂量组(~10⁵),LNP3 组滴度最低(图 2A);低剂量组(10μg)中,LNP1 的 IgG 滴度也显著高于 LNP2 与 LNP3。
抗体亲和力:LNP1 高剂量组的抗体亲和力指数(~80)显著高于 LNP2 高剂量组(~50);有趣的是,LNP2 与 LNP3 的高剂量组亲和力指数反而低于低剂量组(图 2B),提示过高剂量可能导致抗体成熟不充分。
抗体功能性(ILSDA):所有 LNP 组均能诱导子孢子入侵抑制,但 LNP1 效果最优 —— 低剂量组抑制率 98.1%,高剂量组 99.2%,显著高于 LNP2(最高 86.6%)与 LNP3(最高 84.9%)(图 2C),证明 LNP1 诱导的抗体具有强效抗子孢子活性。
细胞免疫应答:
Th1 型细胞因子占优:MSD 检测显示,LNP1 高剂量组的 Th1 型细胞因子(IFN-γ、TNF-α、IL-2、IL-12p70)浓度显著高于 LNP2 与 LNP3(图 2D-G),其中 IFN-γ 浓度达 15000pg/mL 以上,是 LNP2 高剂量组的 2 倍;Th2 型细胞因子(IL-4、IL-5)浓度极低(<100pg/mL),提示 LNP1 诱导Th1 偏向的细胞免疫,这一免疫表型与抗胞内病原体(如疟原虫肝期)的保护机制一致。
促炎因子调节:LNP1 高剂量组的 IL-10(免疫调节因子)浓度显著高于其他组,IL-10 可通过抑制过度炎症反应,维持免疫应答的稳态,避免免疫病理损伤 。
表 3 三种 LNP 制剂诱导的免疫应答关键指标(两剂免疫,3 周间隔)
| 名称 | 货号 | 规格 |
| V-PLEX Vascular Injury Panel 2(human) Kit (25 Plate) | K15198D-4 | 25Plate |
| V-PLEX Vascular Injury Panel 2(human) Kit (5 Plate) | K15198D-2 | 5Plate |
| V-PLEX Vascular Injury Panel 2(human) Kit (1 Plate) | K15198D-1 | 1Plate |