MiR-126, IL-7, CXCR1/2 receptors, inflammation and circulating endothelial progenitor cells: The study on targets for treatment pathways in a model of subclinical cardiovascular disease (type 1 diabetes mellitus)
引言
1型糖尿病(T1DM)与心血管疾病(CVD)的过早发生密切相关,并伴有炎症状态。研究表明,促血管生成的miR-126-3p和miR-126-5p可能在CVD中发挥作用。动物实验已证实miR-126具有促血管生成的作用。本研究假设,在T1DM患者中,miR-126-3p和miR-126-5p的表达降低,而促炎细胞因子的表达升高。研究旨在探讨miR-126在T1DM中的表达变化及其潜在的炎症和血管保护机制。
研究背景
心血管疾病(CVD)是全球主要的死亡原因,而在1型糖尿病(T1DM)患者中,CVD的发生率显著增加,是导致早期死亡的主要原因。CVD与炎症密切相关,促炎细胞因子在其中起关键作用。近年来,microRNAs(miRNAs)作为CVD的生物标志物和调控因子受到广泛关注。miRNAs是一类小的非编码RNA分子,通过与mRNA的3′非翻译区结合来负向调控基因表达。miR-126是其中一种重要的miRNA,其在血管内皮细胞中高度表达,具有促进血管生成和增强血管完整性的作用。
研究方法
研究纳入了29名血糖控制良好的T1DM患者和20名年龄及性别匹配的健康对照者。收集血液样本进行临床和细胞因子分析。研究获得了英国国家健康与护理研究伦理委员会的批准,并遵循赫尔辛基宣言。
miRNA检测:
从血浆和外周血单核细胞(PBMCs)中提取miRNA,使用miRCURY RNA分离试剂盒。
使用qRT-PCR技术检测miR-126-3p和miR-126-5p的表达水平。
细胞因子分析:
使用Meso Scale Discovery技术检测血浆中的IL-7、IL-8、TNF-α和VEGF-C水平。
CXCR1/2 mRNA检测:
使用QIAGEN RT2 First Strand Kit从PBMCs中提取总RNA,并使用RT2 Profiler™ Custom Human PCR Array检测CXCR1和CXCR2的mRNA表达水平。
数据处理与分析:
使用Ingenuity Pathway Analysis(IPA)软件预测miR-126-3p/-5p调控的靶基因、细胞功能和病理状态。
研究结果
患者特征:
T1DM患者的糖化血红蛋白(HbA1c)水平显著高于健康对照组(57.3 ± 7.6 mmol/mol vs. 35.1 ± 2.8 mmol/mol,p < 0.001)。
T1DM患者循环内皮祖细胞(CD34+CD133+CD45dim)数量显著低于健康对照组(0.02 ± 0.01 vs. 0.09 ± 0.03 per 100 lymphocytes,p < 0.001)。
细胞因子变化:
T1DM患者血浆中的IL-7、IL-8、TNF-α和VEGF-C水平显著高于健康对照组(p = 0.008, p = 0.003, p = 0.041, p = 0.013)。
miR-126表达:
在PBMCs中,miR-126-5p的表达在T1DM患者中显著上调(fold change = 1.8,p = 0.01),而在血浆中未观察到显著变化。
miR-126-3p在PBMCs和血浆中的表达均未显著改变。
相关性分析:
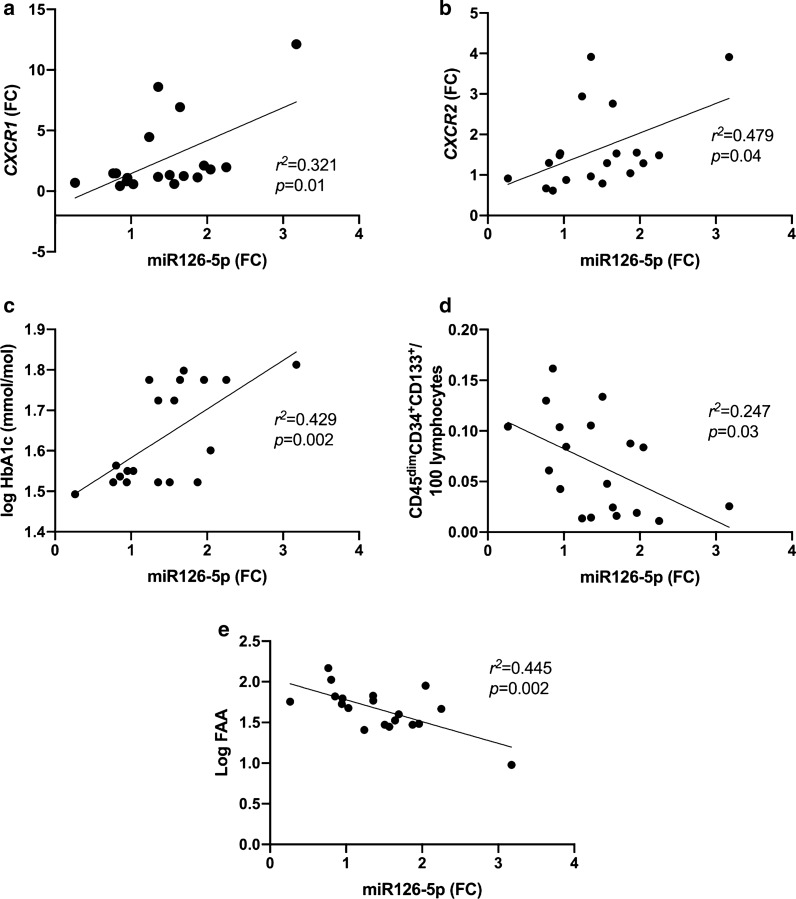
miR-126-5p与CXCR1和CXCR2 mRNA表达呈正相关(r2 = 0.321, p = 0.01;r2 = 0.479, p < 0.05)。
miR-126-5p与HbA1c水平呈正相关(r2 = 0.429, p = 0.002)。
miR-126-5p与循环内皮祖细胞(CD45dimCD34+CD133+)和纤维连接蛋白粘附试验呈负相关(r2 = 0.247, p = 0.03;r2 = 0.445, p = 0.002)。
IPA分析:
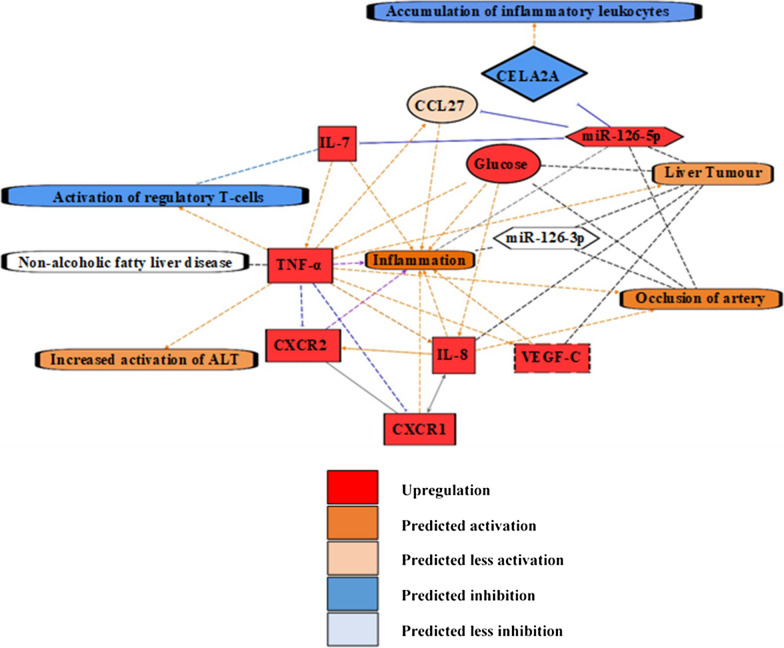
IPA预测miR-126-5p通过抑制CCL27、CELA2A和IL-7发挥抗炎作用,而miR-126-3p无直接抗炎作用。
IL-7被预测为最上游的细胞因子靶点,能够间接调控其他细胞因子的表达。
讨论
T1DM作为一种炎症性疾病:
T1DM患者表现出显著的炎症状态,包括促炎细胞因子(如TNF-α、IL-8)和稳态细胞因子(如IL-7)的升高。
IL-7在T1DM中起关键作用,能够促进CD8+自身反应性记忆T细胞的生成,导致胰岛β细胞的慢性自身免疫性破坏。
miR-126-5p的表达变化:
研究发现,miR-126-5p在PBMCs中显著上调,这可能是一种对高血糖和炎症状态的代偿性反应。
IPA分析表明,miR-126-5p通过抑制多种炎症因子发挥抗炎作用,而miR-126-3p在T1DM中未表现出显著变化。
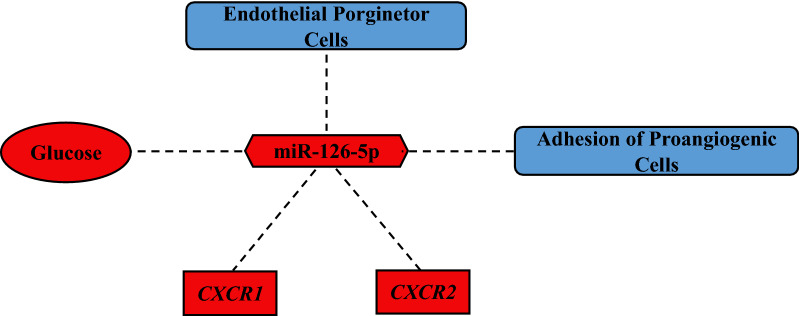
miR-126-5p与血管健康的关联:
miR-126-5p与循环内皮祖细胞和纤维连接蛋白粘附试验呈负相关,表明其在血管健康中的潜在作用。
这些结果表明,miR-126-5p可能在T1DM患者的血管保护中发挥重要作用。
潜在治疗策略:
研究结果提示,miR-126-5p上调可能是一种代偿机制,旨在减轻T1DM中的炎症和CVD风险。
针对IL-7的治疗可能成为管理T1DM炎症和CVD的新策略。
结论
本研究揭示了T1DM患者中miR-126-5p的上调与炎症状态和血管健康之间的复杂关系。miR-126-5p的上调可能是一种对高血糖和炎症的代偿性反应。未来的研究需要在更大的T1DM患者队列中进一步验证这些发现,并探索基于miR-126-5p的治疗策略的潜力。此外,针对IL-7的治疗可能成为管理T1DM炎症和CVD的新策略。
关键图表
miR-126-5p在T1DM患者和健康对照组PBMCs中的表达差异(图1):
显示T1DM患者PBMCs中miR-126-5p的表达显著上调。
miR-126-5p与CXCR1/2、HbA1c和血管健康的相关性(图2):
展示了miR-126-5p与CXCR1/2 mRNA、HbA1c水平以及循环内皮祖细胞和纤维连接蛋白粘附试验之间的相关性。
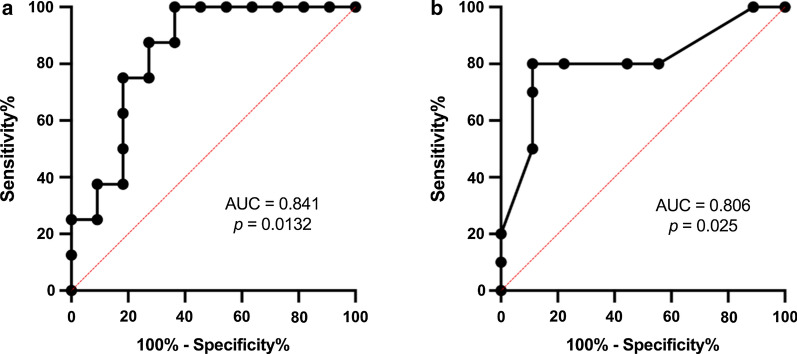
miR-126-5p的ROC曲线分析(图3):
ROC分析显示miR-126-5p能够显著区分T1DM患者和健康对照组,AUC = 0.841,p = 0.0132。
IPA分析预测的miR-126-5p抗炎机制(图4):
展示了miR-126-5p通过抑制CCL27、CELA2A和IL-7发挥抗炎作用的预测网络。
miR-126-5p与血管健康和炎症的相互作用图(图5):
以图形方式总结了miR-126-5p在T1DM中与血管健康和炎症的相互作用。
| 名称 | 货号 | 规格 |
| V-PLEX GLP-1 Active Kit , SECTOR (1 PL) | K1503OD-1 | 1PL |
| V-PLEX Vascular Injury Panel 2(human) Kit (5 Plate) | K15198D-2 | 5Plate |
| V-PLEX Vascular Injury Panel 2(human) Kit (1 Plate) | K15198D-1 | 1Plate |