Distinct Bioenergetic Features of Human Invariant Natural Killer T Cells Enable Retained Functions in Nutrient-Deprived States
一、引言
在免疫学研究领域,人类不变自然杀伤T细胞(iNKT细胞)因其在天然免疫和适应性免疫之间的桥梁作用而备受关注。iNKT细胞不仅能迅速激活并分泌细胞因子,还具有直接杀伤肿瘤细胞的能力。然而,关于iNKT细胞在营养匮乏的肿瘤微环境(TME)中如何生存并保持功能的机制尚不清楚。相比之下,传统T细胞(TCONV)的代谢特性及其在肿瘤治疗中的应用已得到较为广泛的研究。本文将基于Priya Khurana等人在Frontiers in Immunology上发表的关于iNKT细胞的生能特性研究,解析iNKT细胞如何在营养匮乏的状态下维持其功能。
研究表明,在TME中,由于肿瘤细胞的快速增殖,营养物质如葡萄糖和谷氨酰胺会变得稀缺。传统的T细胞在这些条件下通常会出现功能受损的现象。iNKT细胞则表现出了独特的代谢特性,使其能够在营养匮乏的环境中保持其细胞因子分泌和细胞毒性功能。这种独特的生能特性为基于iNKT细胞的肿瘤免疫治疗提供了新的视角。
二、研究背景
iNKT细胞是一类特殊的T淋巴细胞亚群,能够识别由CD1d分子呈递的糖脂类抗原。它们具有天然杀伤(NK)细胞样的快速效应功能。一些研究表明,iNKT细胞在肿瘤微环境中的存在与更好的肿瘤预后相关。然而,iNKT细胞的代谢特性以及这些特性如何影响其在肿瘤微环境中的功能尚未得到充分研究。与TCONV细胞不同,iNKT细胞在激活时并不依赖于糖酵解和谷氨酰胺分解,而是更多地依赖于脂肪酸氧化(FAO)和氧化磷酸化(OXPHOS)。
本研究深入探讨了人类iNKT细胞的代谢特性,并比较了这些特性与传统T细胞在营养匮乏条件下的差异,为设计新型免疫治疗策略提供了理论依据。
三、研究方法
1. 细胞分离与培养
研究人员从健康人类供体的外周血单核细胞(PBMC)中分离并扩增iNKT细胞和传统T细胞(TCONV)。iNKT细胞通过流式细胞分选(FACS)获得,而TCONV细胞则通过Rosette Sep磁珠分离技术获得。这些细胞在含有IL-2和IL-15等细胞因子的培养基中扩增,以确保细胞的活性和功能。
2. 实验设计
研究设计了一系列实验,包括细胞培养、流式细胞术、转录组分析、代谢通量分析和细胞因子检测等。
细胞培养:iNKT细胞和TCONV细胞在正常培养基或营养匮乏培养基(如低葡萄糖或无谷氨酰胺)中培养。通过改变培养条件,研究人员模拟了肿瘤微环境中的营养匮乏状态,研究细胞的代谢特性和功能。
流式细胞术:用于检测细胞内的线粒体质量和膜电位等指标。通过MitoTracker Green和TMRM染料标记细胞,研究人员可以量化iNKT细胞和TCONV细胞在不同条件下的线粒体特性。
转录组分析:利用NanoString nCounter技术对iNKT细胞和TCONV细胞的基因表达进行分析。研究聚焦于与代谢相关的基因,如糖酵解、脂肪酸氧化和AMPK信号通路中的基因。
代谢通量分析:使用Seahorse XF分析仪测量iNKT细胞和TCONV细胞的氧气消耗率(OCR)和胞外酸化率(ECAR)。通过实时监测这些参数,研究人员可以评估细胞的代谢活性和底物利用情况。
细胞因子检测:通过ELISA和V-Plex Pro-Inflammatory Panel 1 Human Kit检测细胞培养上清液中的细胞因子水平,如IFN-γ、TNF-α和IL-4。这些实验方法的综合应用使研究人员能够全面评估iNKT细胞和TCONV细胞的代谢特性及其在营养匮乏条件下的功能表现。
四、研究结果
1. iNKT细胞在营养匮乏环境下保留功能
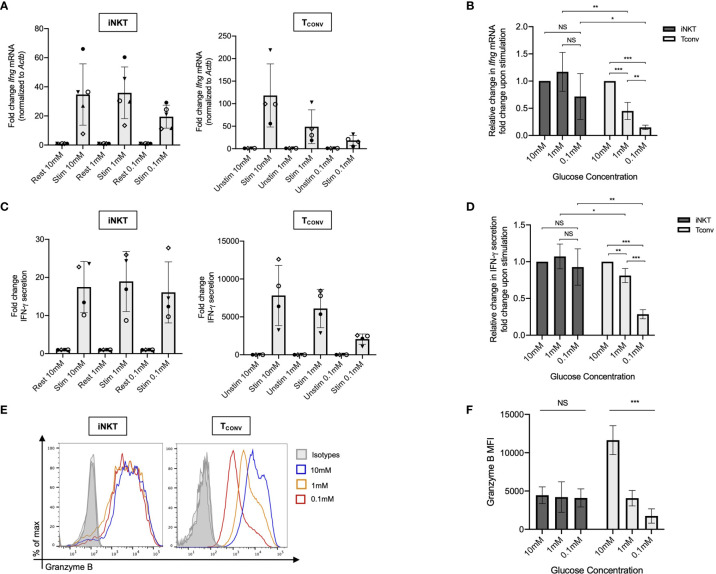
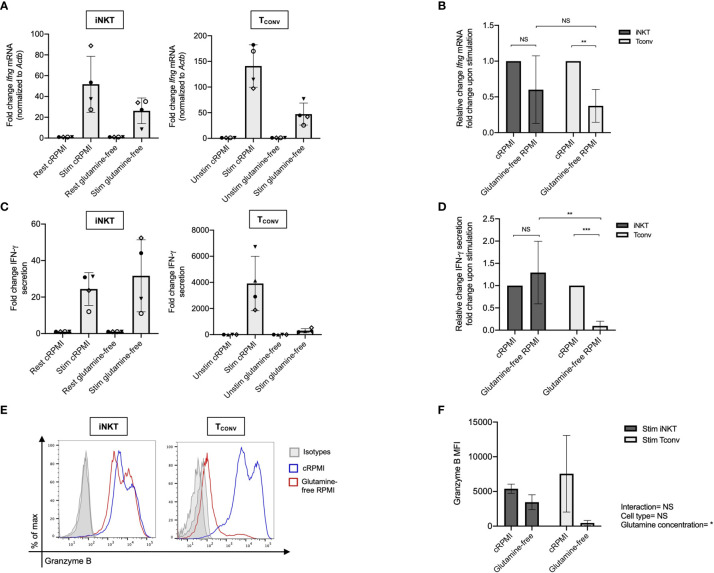
在正常培养条件下,iNKT细胞和TCONV细胞都表现出较高的细胞因子分泌能力。然而,当细胞在低葡萄糖(1 mM或0.1 mM)或无谷氨酰胺的培养基中培养时,TCONV细胞表现出显著的细胞因子分泌下降,而iNKT细胞的分泌水平基本保持不变。例如,在0.1 mM葡萄糖条件下,TCONV细胞的IFN-γ mRNA水平下降了85%,而iNKT细胞则没有显著变化(图1A-D)。
图1. iNKT细胞和TCONV细胞在低葡萄糖条件下的IFN-γ mRNA表达和分泌水平。
此外,iNKT细胞在低葡萄糖条件下还能维持较高的颗粒酶B(Granzyme B)水平,这表明其细胞毒性功能并未受到影响(图1E-F)。
图2. iNKT细胞和TCONV细胞在不同葡萄糖浓度下的颗粒酶B表达水平。
这些结果表明,iNKT细胞相较于TCONV细胞在营养匮乏环境下具有更强的功能保留能力。
2. iNKT细胞的代谢特性
转录组分析显示,iNKT细胞在激活后上调的糖酵解相关基因数量少于TCONV细胞。在13个糖酵解基因中,9个基因在TCONV细胞中显著上调,而在iNKT细胞中仅上调了其中的4个(表1)。这表明iNKT细胞在激活后并不依赖于糖酵解来支持其功能。
表1. 糖酵解基因在iNKT细胞和TCONV细胞中的表达差异
| 基因名称 | p值 | q值 | 高表达细胞类型 |
|---|---|---|---|
| PFKL | 1.8003E-05 | 1.6498E-04 | iNKT |
| PFKM | 2.7224E-05 | 1.6498E-04 | TCONV |
| HK2 | 7.0098E-05 | 2.8319E-04 | TCONV |
| LDHA | 1.2875E-04 | 3.9011E-04 | TCONV |
| LDHB | 2.0950E-04 | 4.2319E-04 | TCONV |
| ALDOA | 6.6621E-03 | 1.0093E-02 | TCONV |
| ENO1 | 1.8666E-02 | 2.1844E-02 | TCONV |
| GAPDH | 1.9826E-02 | 2.1844E-02 | TCONV |
| PDHA1 | 2.7659E-02 | 2.7936E-02 | TCONV |
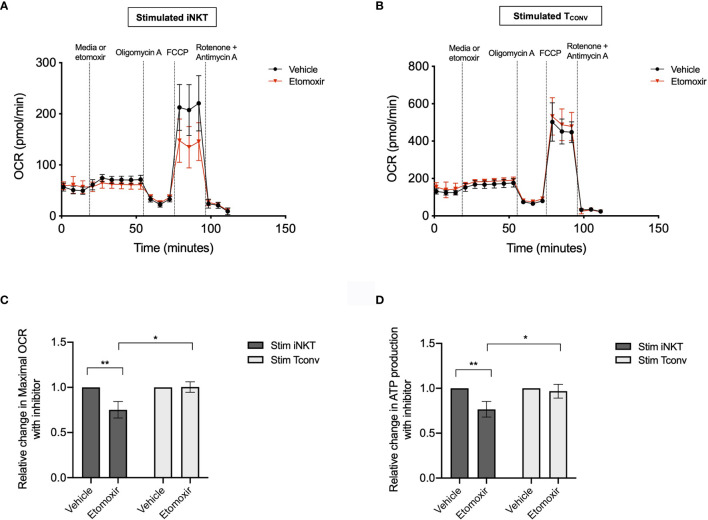
此外,代谢通量分析结果显示,iNKT细胞在激活后表现出更高的脂肪酸氧化(FAO)活性。与TCONV细胞相比,iNKT细胞在添加抑制剂etomoxir(阻断脂肪酸氧化)后,其最大呼吸速率显著下降,而TCONV细胞则不受影响(图3A-B)。这表明iNKT细胞更依赖于脂肪酸作为能量来源。
图3. iNKT细胞和TCONV细胞在etomoxir处理后的OCR变化。
3. iNKT细胞的线粒体特性
流式细胞术检测显示,iNKT细胞在激活后具有更高的线粒体质量和膜电位(图4A-B)。这表明iNKT细胞的线粒体功能更为活跃,可能为其在营养匮乏环境下的能量代谢提供了支持。
图4. iNKT细胞和TCONV细胞的线粒体质量和膜电位。
此外,转录组分析揭示了iNKT细胞中与脂肪酸氧化相关的基因表达水平高于TCONV细胞(图4C)。例如,Cpt1a基因(脂肪酸氧化的关键酶)在iNKT细胞中的表达显著高于TCONV细胞(图4D)。这些结果进一步支持了iNKT细胞在激活后依赖于脂肪酸氧化的代谢模式。
4. AMPK信号通路的参与
AMPK是一种重要的能量感应分子,能够通过调节代谢途径来维持细胞的能量平衡。转录组分析显示,iNKT细胞中与AMPK信号通路相关的基因表达水平显著高于TCONV细胞(图4E)。这表明AMPK信号通路在iNKT细胞的代谢调节中可能发挥了重要作用。
图5. iNKT细胞和TCONV细胞中AMPK信号通路基因的表达差异。
五、讨论
本研究深入探讨了人类iNKT细胞在营养匮乏环境下的代谢特性和功能保留机制。研究表明,iNKT细胞在低葡萄糖和无谷氨酰胺的条件下仍能保持其细胞因子分泌和细胞毒性功能,而传统T细胞则表现出显著的功能下降。这种差异可能源于iNKT细胞独特的代谢模式:相较于依赖糖酵解的TCONV细胞,iNKT细胞更倾向于利用脂肪酸氧化和氧化磷酸化来满足其能量需求。
iNKT细胞的线粒体特性和AMPK信号通路的激活可能为其在营养匮乏环境下提供了代谢优势。线粒体作为细胞的能量工厂,在iNKT细胞中表现出更高的活性,这支持了其在营养匮乏环境下的能量需求。同时,AMPK的激活促进了脂肪酸氧化等分解代谢过程,进一步增强了iNKT细胞的代谢灵活性。
这些发现为基于iNKT细胞的肿瘤免疫治疗提供了重要的理论依据。在肿瘤微环境中,iNKT细胞的独特代谢特性可能使其在与肿瘤细胞竞争营养物质时具有优势,从而更有效地发挥其抗肿瘤功能。
六、结论
Priya Khurana等人的研究表明,人类iNKT细胞在营养匮乏的环境中表现出独特的代谢特性和功能保留能力。这些特性主要体现在以下几个方面:
在低葡萄糖和无谷氨酰胺的条件下,iNKT细胞仍能维持其细胞因子分泌和细胞毒性功能。
iNKT细胞在激活后主要依赖于脂肪酸氧化和氧化磷酸化,而非糖酵解。
iNKT细胞具有更高的线粒体活性和AMPK信号通路的激活,为其在营养匮乏环境下的生存和功能提供了支持。
这些发现不仅增进了我们对iNKT细胞代谢特性的理解,还为设计新型肿瘤免疫治疗策略提供了重要的启示。通过利用iNKT细胞的独特代谢特性,有望开发出更高效的免疫治疗方法,以提高抗肿瘤治疗的效果。
| 名称 | 货号 | 规格 |
| V-PLEX GLP-1 Active Kit , SECTOR (1 PL) | K1503OD-1 | 1PL |
| V-PLEX Vascular Injury Panel 2(human) Kit (5 Plate) | K15198D-2 | 5Plate |
| V-PLEX Vascular Injury Panel 2(human) Kit (1 Plate) | K15198D-1 | 1Plate |