今天小优带您走进另外一种细胞死亡的形式,有丝分裂细胞死亡。2019年7月11日,来自美国洛克菲勒大学的Hironori Funabiki和Christian Zierhut教授团队合作在Cell杂志上发表了题为 The Cytoplasmic DNA Sensor cGAS Promotes Mitotic Cell Death 的研究长文,揭示了cGAS促进有丝分裂异常细胞死亡的过程。小优带大家来梳理一下这篇文章思路。
文章简述
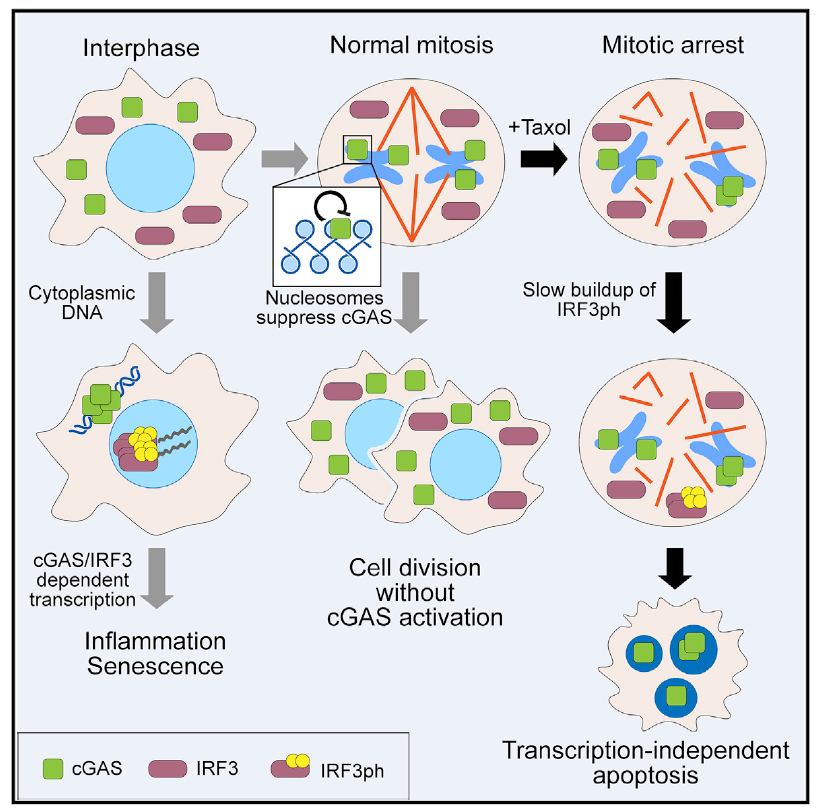
细胞质DNA感受器cGAS(cyclic GMP-AMP synthase,环鸟苷酸-腺苷酸合成酶)的激活在正常有丝分裂过程中会被核小体抑制,但是在有丝分裂阻滞时,cGAS会通过缓慢的积累IRF3的磷酸化作用从而促进细胞死亡。
△点击放大图片
1.核小体竞争性抑制 DNA 诱导的cGAS 激活
切入点
为什么染色质可以和cGAS相互作用?cGAS在其中起到了什么作用?
研究过程
通过pull-down实验作者发现 cGAS在体外对核小体的结合明显强于对DNA的结合(图 1B)。定量凝胶位移分析进一步证明重组cGAS蛋白对核小体的亲和力比DNA高出2倍(图 1C)。对cGAS的DNA 结合区域进行突变之后 (Civril et al., 2013) 大大降低了对DNA的结合力(KRKK 突变体,图 1D),但对核小体的结合力影响不大(图 1E),表明 cGAS对DNA和核小体的结合机制有所不同。此外,cGAS可以结合纯化的 H2A-H2B 异质二聚体(图 1F),对H2A-H2B上核小体蛋白结合的acidic patch区域突变之后,明显降低了cGAS的结合作用(ap*A 和 ap*KR,图 1F)。核小体能够通过 cGAS 刺激 cGAMP 合成,但与 DNA 结合的 cGAS 相比,核小体结合的cGAS 催化速率减少了 3 倍(Kcat,图 1G、1H 和 S1D)。当增加核小体的数量时,核小体竞争性地抑制了DNA对cGAS的激活作用(图 1I)。
结论
在染色体上,核小体会干扰 cGAS的激活。
在这些实验中,cGAS蛋白,H2A,H2B,H3,H4组蛋白,cGAS突变蛋白都是使用Cytiva纯化产品进行纯化的。
具体方案
组蛋白H2A,H2B,H3和H4纯化:H2A,H2B,H3,H4分别构建质粒并在大肠杆菌中表达,蛋白N端加His标签。表达后发现这些蛋白存在于包涵体内,因此要使用变性的条件溶解包涵体纯化。组蛋白分别在变性的条件下用HisTRap预装柱进行纯化(6 M Guanidine HCl; 500 mM NaCl; 50 mM Tris-Cl [pH 8 at 22℃]; 5 mM 2-mercaptoethanol; 7.5 mM imidazole),通过透析到 20 mM MOPS; 500 mM NaCl; 2% glycerol; 1 mM EDTA; 5 mM 2-mercaptoethanol; pH 7 at
22℃进行复性,然后使用Superdex Increase分子筛进行进一步纯化。
cGAS突变蛋白纯化:
构建突变cGAS质粒,突变位点为 K173E R176E K407E K411A,在质粒N端加上MBP标签,C端加上His标签,在大肠杆菌中表达。在标签和蛋白之间加上TEV蛋白酶识别位点。质粒转染到大肠杆菌中。包含cGAS表达质粒的E. coli Rosetta 2 (DE3 pLysS)在1.5 x TBG-M9 medium (15 g/l tryptone; 7.5 g/l yeast extract;5 g/l NaCl; 0.15 g/l MgSO4; 1.5 g/l NH4Cl; 3 g/l KH2PO4; 6 g/l Na2HPO4; 0.4% glucose)培养基中进行培养,当OD600为大约0.9时,加入0.6M IPTG诱导剂在18℃培养20h。细胞用裂解液 (50 mM Tris-Cl [pH 7.5 at 4℃]; 0.3 M NaCl; 10 mM 2-mercaptoethanol;1 mM PMSF; 0.25 mg/mL lysozyme; 10 mg/mL leupeptin; 10 mg/ml pepstatin; 10 mg/ml chymostatin)裂解并超声。用MBPTrap预装柱进行蛋白纯化。纯化后用TEV蛋白酶进行标签切除。由于TEV蛋白酶本身带有His标签,所以用HisTrap预装柱去除标签。切除标签后的蛋白再用HiTrap heparin预装柱进行纯化。最后用Superdex 200 Increase 10/300进行精细纯化,缓冲液为20 mM Tris-Cl [pH 7.5 at 4C]; 0.3 M NaCl; 1 mM DTT。
此外,检测蛋白和蛋白,蛋白和核酸,抗原和抗体之间的结合和相互作用可以使用Biacore检测。Biacore基于SPR原理,提供高灵敏度的亲和力,动力学和活性浓度检测。Biacore基于的SPR技术已写入中国,美国和日本药典,想要进一步了解可咨询小优哦。
部分相关产品
| 货号 | 名称 | 说明 |
| 15102 | cGAS (D1D3G) Rabbit mAb | 一抗 |
| 17524802 | HISTRAP HP 5 X 5 mL | His标签纯化柱 |
| 28918780 | MBPTrap 5 x 5mL | MBP标签纯化柱 |
| 28990944 | Superdex 200 Increase 10/300 GL | 分子筛纯化柱 |
| P8112S | TEV Protease | TEV蛋白酶 |
| abs50034-22T | 染色质免疫共沉淀(ChIP)试剂盒 | 染色质免疫共沉淀(ChIP)试剂盒 |
| abs9331-100ml | RNA提取试剂盒 | RNA提取试剂盒 |
| abs60055-1ml | 2×Pfu Master Mix | DNA扩增 |
| abs60023-50T | 质粒提取试剂盒 | 质粒提取试剂盒 |
2. cGAS 依赖的IRF3磷酸化在有丝分裂阻滞时缓慢积累
切入点
cGAS在有丝分裂时会被招募到染色体上,cGAS会起到什么作用?
研究过程
为了确定染色体结合的 cGAS 是否在有丝分裂过程中可以激活下游的信号传导通路,作者检测有丝分裂的过程中IRF3蛋白Ser396位点的磷酸化变化,这是一种广泛使用的 cGAS 激活指标(Chen er al.,2016)。当过表达 GFP 标记的 IRF3时,用紫杉醇或诺考达唑诱导的有丝分裂阻滞期间发现了缓慢的cGAS 依赖性的IRF3蛋白Ser396位点磷酸化的增加(图 2A、2B 和 S2A),以一种依赖于 IRF3 激酶 TBK1 的方式(Chen et al,2016)(图 2B)。有丝分裂时,cGAS 依赖性磷酸化也在内源性 IRF3 的 Ser396 以及 Ser386中被发现(Schoggins et al,2014)(图 2C、2D)。
最近,有丝分裂缺陷被发现与cGAS 激活间接相关(Dou et al,2017;Gluck et al,2017;Harding et al,2017;Mackenzie et al,2017;Yang et al,2017)。实验表明,细胞用高浓度的紫杉醇(500 nM),以及proTAME,一种APC的抑制剂(Zeng 等人,2010)处理之后,引起细胞周期停滞,并阻滞了滑动和微核形成(图 4D)。因此,cGAS 依赖性 IRF3 磷酸化并不来自微核,但对有丝分裂细胞具有特异性。
结论
尽管在有丝分裂期间染色体富集cGAS,但 cGAS 信号通路的激活需要较长的时间。
部分相关产品
| 货号 | 名称 | 说明 |
| 4947S | Phospho-IRF-3 (Ser396) (4D4G) Rabbit mAb | 一抗 |
| ab76493 | Anti-IRF3 (phospho S386) antibody [EPR2346] | 一抗 |
| 40909 | TBK1 antibody (mAb) | 一抗 |
| 10600023 | PVDF 0.45UM 300MMx4M 1/PK | PVDF转印膜 |
| 10600021 | PVDF 0.2UM 260MMx4M 1/PK | PVDF转印膜 |
| 10600002 | PT 0.45UM 300MMx4M 1/PK | NC转印膜 |
| 10600001 | PT 0.2UM 300MMx4M 1/PK | NC转印膜 |
3. cGAS在有丝分裂阻滞时影响细胞命运
切入点
尽管在正常有丝分裂期间,cGAS信号通路发生缓慢。但在细胞有丝分裂阻滞时,cGAS看似起到了很大的作用?
研究过程
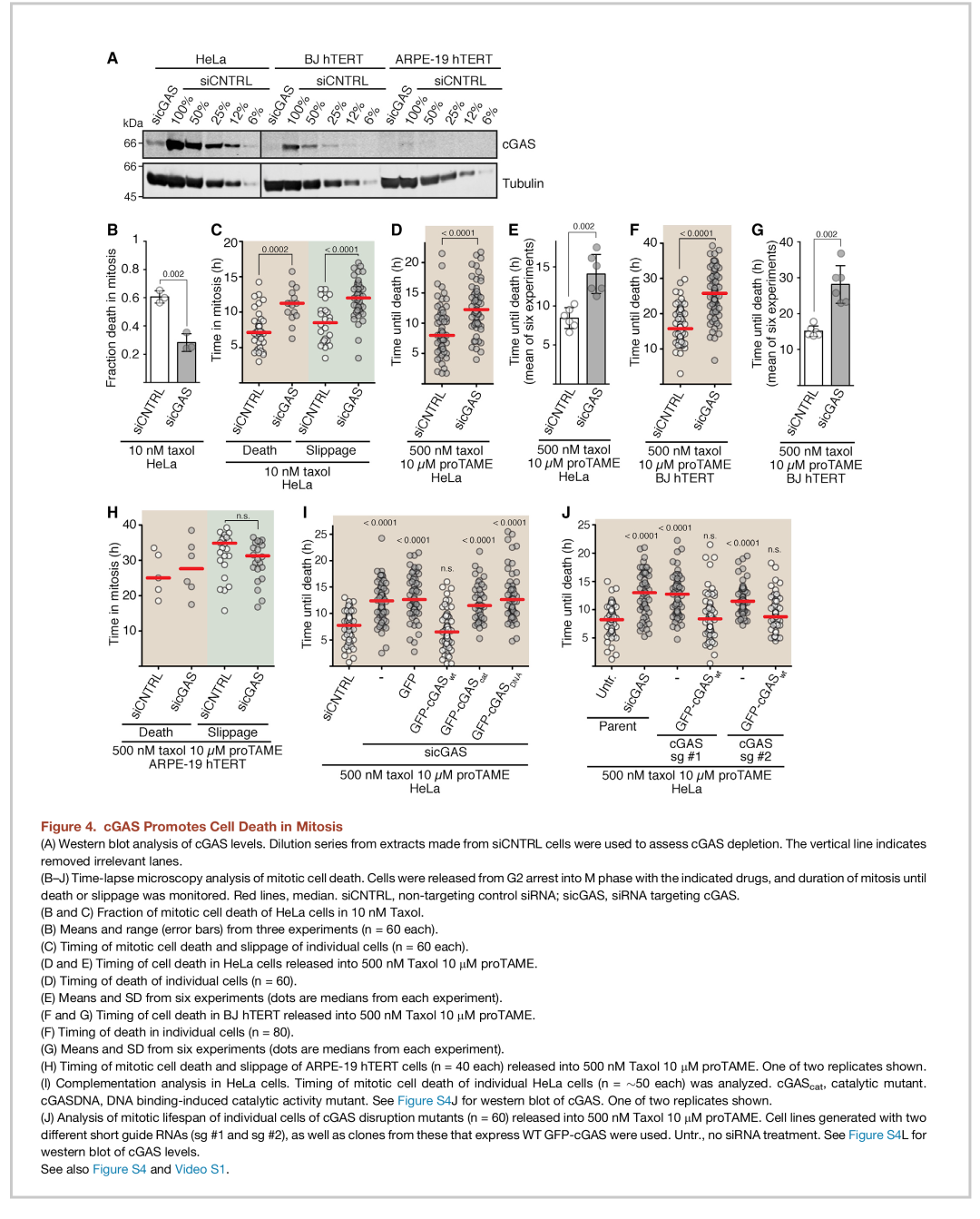
由于不同细胞系之间的 cGAS 蛋白水平差异很大(图 3A),并且cGAS 及其下游效应器 STING和 IRF3 被报道促进细胞死亡(Chattopadhyay et al,2010;Gaidt et al,2017;Nakhaei er al,2012;Petrasek et al,2013),作者检测cGAS 是否会影响细胞死亡。通过跟踪单个有丝分裂细胞实时成像(Gascoigne and Taylor,2008;Wheelock et al,2017),作者检测了单个细胞的死亡率和有丝分裂寿命。
因为乳腺癌经常用紫杉类药物治疗(Jordan and Wilson, 2004),作者首先分析了七种乳腺癌细胞系(图 3A),其中四种表达 cGAS 和其中三种没有表达。四种表达 cGAS 细胞中的三种细胞系(HCC1143、MDA-MB-231、BT549)在有丝分裂阻滞期间表现出IRF3 磷酸化(图 S3A–S3D)。当用10 nM 紫杉醇处理时,与临床治疗期间治疗肿瘤的估计浓度相似(Mitchison,2012;Weaver,2014),三种cGAS 阴性细胞系在有丝分裂阻滞期间没有死亡,而三种cGAS 阳性细胞系在有丝分裂中容易死亡(图3B )。当紫杉醇浓度增加到 500 nM 时,cGAS 阴性细胞系细胞阻滞的时间会延长,增加有丝分裂细胞死亡几率。小干扰 RNA (siRNA) 介导的cGAS 下调降低了三种最敏感的细胞系50% 的有丝分裂死亡率(图 3E 和 S3G)。MDA-MB-231细胞中的 cGAS 敲除在用高紫杉醇处理后会减少有丝分裂细胞死亡(图 3F)。
结论
cGAS 的表达与紫杉醇诱导有丝分裂阻滞期间细胞死亡具有相关性。

△点击放大图片
4. cGAS促进有丝分裂停滞期间的细胞死亡
切入点
cGAS是否会促进有丝分裂细胞死亡?
研究过程
作者用Hela细胞进行进一步验证,实验表明当用 10 nM 紫杉醇处理细胞时,cGAS 敲除减少了 HeLa 中的有丝分裂细胞死亡(图 4A 和 4B)。
为了验证 cGAS 消耗是否会延迟细胞死亡,作者使用 500 nM 紫杉醇和 proTAME处理细胞。在 HeLa 细胞(图 4A、4D、4E)或 BJhTERT 细胞(图 4A、4F 和 4G)中进行cGAS敲除延长有丝分裂寿命。
结论
cGAS在有丝分裂阻滞期间促进细胞死亡。
△点击放大图片
部分相关产品:
| 货号 | 名称 | 说明 |
| 301105 | PolyFect Transfection Reagent | 转染试剂 |
| 101000014 | FectoPRO® | 转染试剂 |
| 101000007 | FectoPRO® | 转染试剂 |
| 101000019 | FectoPRO® | 转染试剂 |
| 101000027 | jetPRIME® | 转染试剂 |
| 101000046 | jetPRIME® | 转染试剂 |
| AAB-1001 | Nucleofector™ 2b | 电转仪 |
| V4XP-3024 | P3 Primary Cell 4D X Kit | 电转试剂盒 |
5. cGAS 通过Bcl-xL 依赖性MOMP 的抑制来促进细胞凋亡
切入点
cGAS促进细胞凋亡是否和BCL2蛋白家族有关?
研究过程
作者进一步研究cGAS和凋亡相关指标的关系。实验表明cGAS 敲除会延迟 Bax 激活(图 5A-5C)和 SMAC和细胞色素 C释放(图 5D-5F),表明cGAS 通过调节 MOMP 促进细胞凋亡。
结论
cGAS 通路直接或间接地克服了 Bcl-xL 依赖性对 Bax激活和 MOMP的抑制。

△点击放大图片
6. cGAS-cGAMP-STING-IRF3 促进有丝分裂细胞死亡不依赖于转录诱导
切入点
cGAS促进细胞死亡是否和其他蛋白有关?
研究过程
由于 cGAS-STING-IRF3 通路可以通过 p53 依赖性和 p53 非依赖性机制调节凋亡蛋白表达促进细胞死亡(Goubau et al,2009;Gulen et al,2017;Knowlton et al,2012;Lallemand et al,2007), 稳态 cGAS 信号可以促进有丝分裂死亡通过直接改变基因表达或通过 IFNb 刺激的 JAK-STAT 信号传导机制(Wang et al., 2017)。作者研究表明cGAS的敲除不会导致凋亡蛋白(图 6A)或干扰素刺激基因 IRF1(图 6B)的水平发生显著变化。用FNb 受体的 IFNAR2 亚基 (Wu et al., 2018)中和抗体处理 BJ hTERT 细胞,会破坏IFNb 诱导 IRF1 的能力(图 6B)但不影响有丝分裂寿命(图6C)。因此,cGAS调节有丝分裂细胞死亡不依赖于 IFNb。
作者早期的数据表明 cGAS介导的cGAMP合成对于限制有丝分裂寿命很重要(图 4I)。如果 cGAS 通过 cGAMP 促进死亡,则添加 cGAMP 可以替代cGAS 并缩短有丝分裂寿命。尽管 cGAMP 膜转运效率低下(Gao et al,2013b;Konno et al,2013;Wu et al., 2013),在细胞培养基中添加cGAMP会使细胞有丝分裂停滞(图 6D 和 6E),表明 cGAS 在有丝分裂阻滞过程中的直接作用。这些结果表明 cGAMP信号传导直接在有丝分裂中促进有丝分裂细胞死亡。
cGAS 激活和cGAMP 的产生主要是对转录因子的刺激,例如IRF3。虽然转录通常在有丝分裂中被关闭(Prescott and Bender, 1962),低水平有丝分裂转录可能发生(Palozola et al,2017 年)。然而,IRF3 靶点IFNB1、CXCL10 和 IRF1(Chen 等人,2016)在有丝分裂期间没有被诱导,而 DNA 转染会刺激它们的转录(图 6F)。此外,转录抑制剂雷公藤内酯(Bensaude,2011)没有延长有丝分裂寿命(图 6G 和 6H),这些数据表明有丝分裂中的 cGAS 激活不会诱导 IRF3 依赖性转录反应。
为了进一步验证IRF3 的作用,作者改造了细胞使其表达突变的IRF3(图 6J)。IRF3构造由于缺乏DNA结合域 (DDBD) 而无法进行转录诱导 (Chattopadhyay et al., 2010)减缓了IRF3 中断的延长寿命作用(图 6L),表明转录非依赖型的细胞凋亡机制。
结论
在有丝分裂停滞期间cGAS 依赖性IRF3 的磷酸化诱导促进细胞凋亡不依赖于 IRF3的转录诱导。

△点击放大图片
部分相关产品:
| 货号 | 名称 | 说明 |
| 9239S | Bad (D24A9) Rabbit mAb | 一抗 |
| 12105S | Bak (D4E4) Rabbit mAb | 一抗 |
| 2772S | Bax Antibody | 一抗 |
| 2764S | Bcl-xL (54H6) Rabbit mAb | 一抗 |
| 2819S | Bim Antibody | 一抗 |
| 7065T | c-IAP1 (D5G9) Rabbit mAb | 一抗 |
| ab179520 | Anti-Caspase-2 antibody [EPR16796] | 一抗 |
| ab201959 | Anti-Caspase-7 antibody [4D10B2] | 一抗 |
| ab202068 | Anti-Caspase-9 antibody [EPR18107] | 一抗 |
7. cGAS 促进小鼠移植瘤癌症模型中的紫杉醇反应
切入点
引入动物肿瘤模型
研究过程
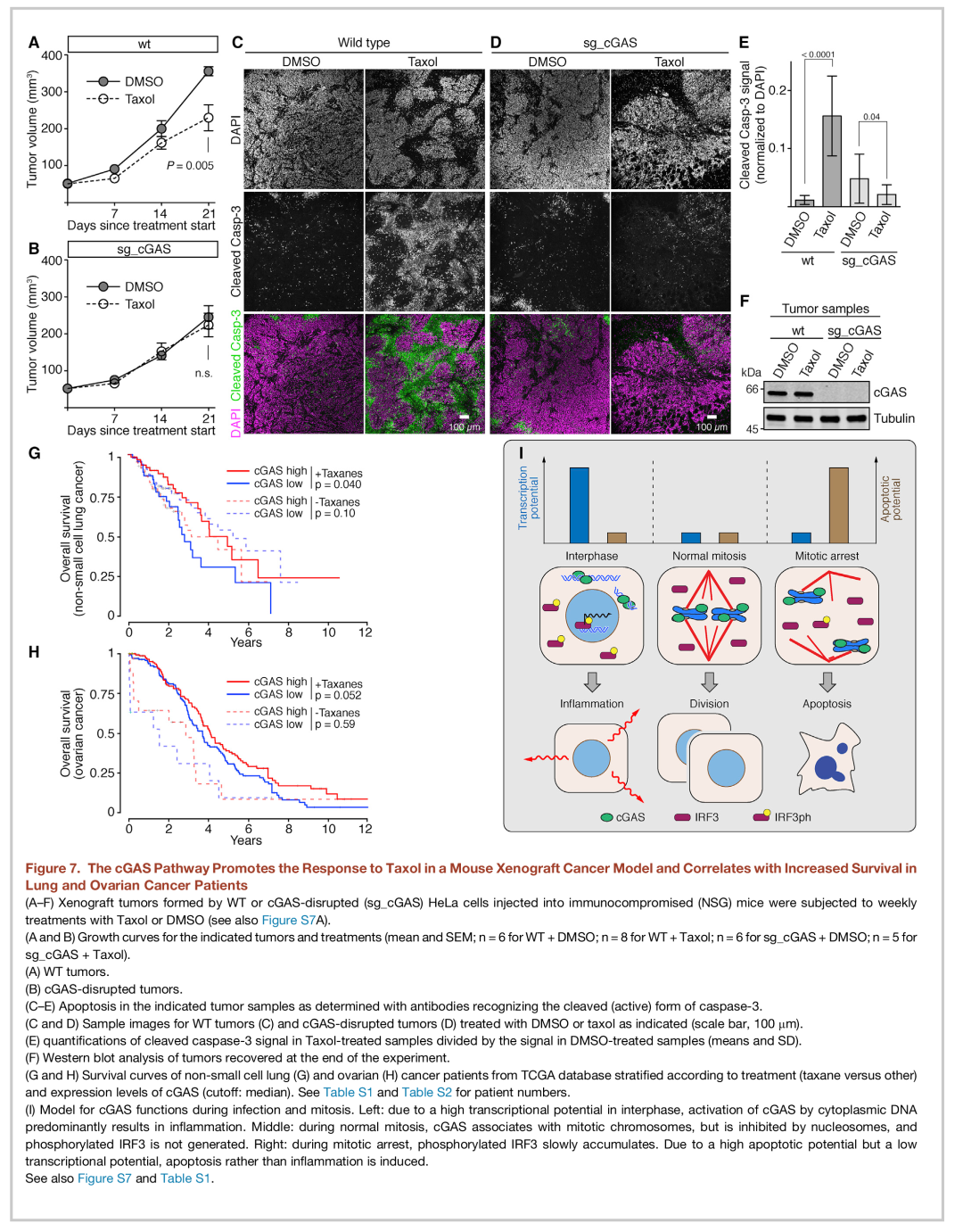
为了评估肿瘤内的 cGAS 通路是否会影响紫杉醇化疗,作者进行了小鼠移植瘤肿瘤模型实验。一旦肿瘤形成可见,紫杉醇或 DMSO 进行每周给药。对手术切除的肿瘤进行免疫荧光证明cGAS仅存在于间期野生型细胞的细胞质中,但在有丝分裂期间富集于染色体上。紫杉醇延迟了野生型肿瘤生长,但对cGAS敲除的肿瘤没有影响(图 7A、7B、和 S7C)。此外,对野生型肿瘤用紫杉醇治疗,具有明显的凋亡区域(图 7C-7F)。
为了确定 cGAS 在移植瘤肿瘤模型中是否通过 IRF3 起作用,作者用 IRF3 破坏的细胞及强力霉素诱导的过表达GFP-IRF3 或 GFP-IRF3_△DBD重复这些实验(图 6K 和 6L)。紫杉醇处理再次延迟了野生型肿瘤的生长,但没有影响IRF3敲除的肿瘤。
结论
cGAS 促进小鼠移植瘤癌症模型中的紫杉醇反应
△点击放大图片
8. cGAS 表达对紫杉烷治疗的肺癌和卵巢癌患者存活的影响
切入点
疾病相关
研究过程
最后,作者使用记录在TCGA内的数据(CancerGenomeAtlas Network,2012)调查了 cGAS通路和非小细胞肺癌和卵巢癌患者紫杉烷化疗之间可能存在的相关性。根据患者肿瘤的cGAS 的 RNA 水平,以及他们是否使用紫杉烷治疗对患者进行分类。紫杉烷处理的非小细胞肺癌患者的肿瘤表达高水平的cGAS,并且比低表达cGAS病人显示出更长的生存期(图7G)。相比之下,对于接受过其他类型的治疗但从未接受过紫杉烷治疗的病人,cGAS 的表达水平和生存情况没有表现出任何明显的相关性(图7G)。对于卵巢癌患者,由于缺乏没有使用紫杉烷治疗的患者,难以评估cGAS 和紫杉烷功效之间的相关性,但cGAS 表达和延长生存期的趋势在紫杉烷治疗的患者中也可观察到(图 7H)。这些观察结果与 cGAS和用于肺癌和卵巢癌患者的紫杉烷治疗具有重要联系的观点一致。
结论
数据表明 cGAS 通路有助于紫杉烷化疗的效果。
以上文章运用了多种技术验证了cGAS在细胞死亡及肿瘤治疗中的重要作用,除了常规的WB,qPCR,免疫荧光等技术外,蛋白纯化也常用于非常多的高分文献中。蛋白纯化的步骤主要包括质粒构建,蛋白表达和蛋白纯化,可在短时间得到大量需要的高纯度蛋白,也多用于蛋白的改造和多样化功能实现(例如本文蛋白突变及片段化截短等)。