引言
2021年的诺奖颁发给了戴维·朱利叶斯和阿登·帕塔普蒂安,以表彰他们在“发现温度和触觉感受器”方面作出的贡献,主要是新的离子通道蛋白TRPV1和Piezo。之前的文章,小优跟大家一起回顾了两位大佬的发现之旅。其实,这是离子通道领域第三个诺奖。1991年,埃尔温·内尔以及伯特·萨克曼由于发明膜片箝电位记录技术,证实离子通道获奖。2003年,颁发给了发现水通道的彼得·阿格雷和利用X射线晶体成像技术展现离子通道结构的罗德里克·麦金农。
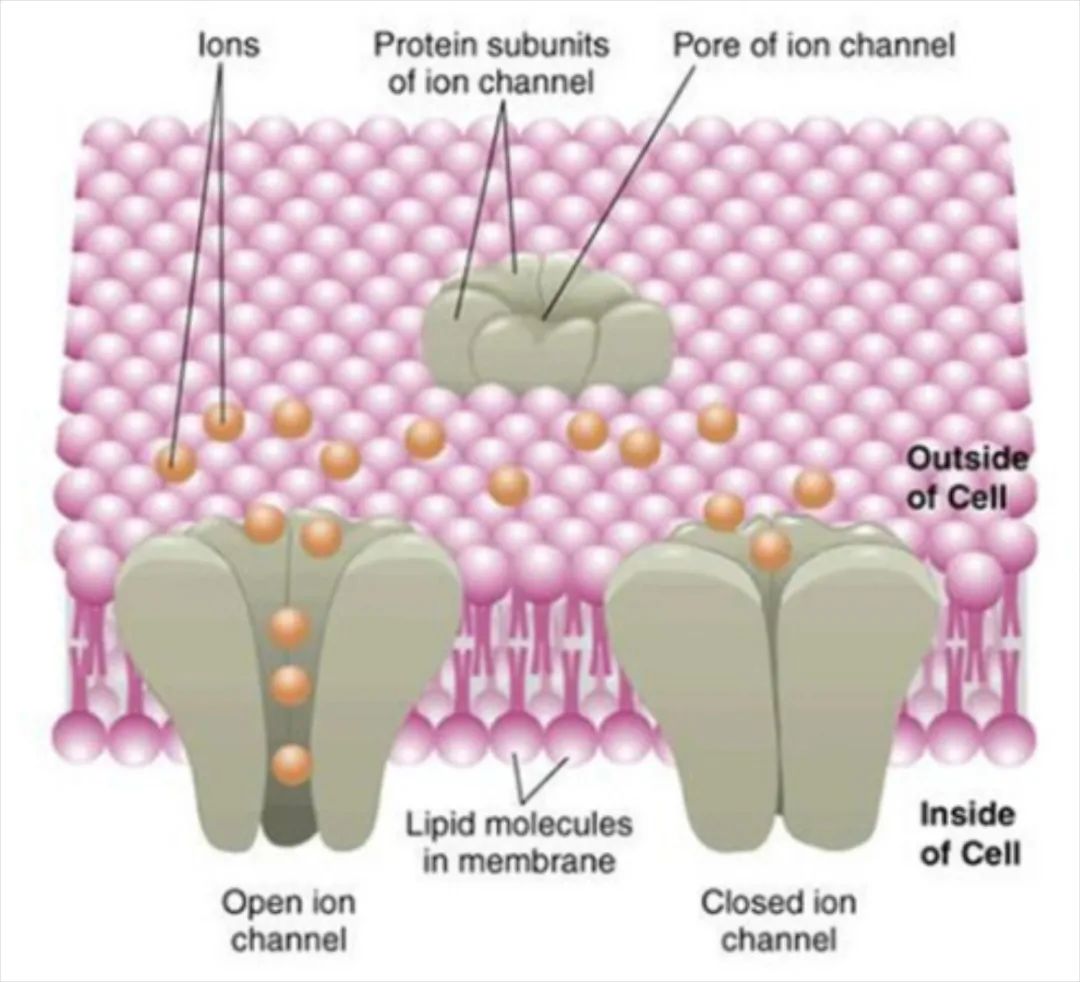
图1 离子通道蛋白
△点击放大图片
离子通道蛋白的研究方法
针对离子通道的研究逐渐涉及许多科学技术,例如电生理学,免疫学,基因工程和影像学等。随着研究体系的发展,目前形成通过基因工程选择特定基因,构建文库,过表达或者敲除等方式进行筛选; 通过膜片钳技术观察电位变化;免疫学和影像学进行后续的蛋白结构、位置、表达水平的鉴定。其中免疫学中最常见的实验方法是免疫印迹(WB),但我们发现在用WB研究离子通道蛋白的过程中,经常结果不尽人意。鉴于离子通道蛋白的特性,要想WB一次成功, 小优细节君整理了如下Tips,希望能够帮到您。
| 学科 | 主要技术 |
| 电生理学 | 电压钳位法、膜片钳技术 |
| 基因工程 | 异源功能互补,过表达,基因沉默,GFP标记、原位杂交和qPCR等 |
| 免疫学 | 免疫组织化学、免疫荧光、免疫印迹和免疫电镜等 |
| 影像学 | Ca2+拮抗荧光术、放射自显影、X射线晶体成像和冷冻电镜等 |
01 离子通道蛋白的
主要特征
1. 具有多重跨膜结构域
2. 分子量较大
3. 具有同源或异源多聚体
4. 结构复杂

图2 CaV2.1跨膜结构域
△点击放大图片
02 离子通道蛋白WB实验的注意事项
2.1 样品类型与蛋白特征
样品制备是任何蛋白质印迹 (WB) 中至关重要的第一步。您使用的制备方案取决于您计划使用的样品类型和蛋白特征。
对于细胞(贴壁/悬浮)样品,建议直接用 Laemmli样品缓冲液,该方法将几乎所有细胞蛋白质释放到缓冲液中。如果后续要做IP,应该使用温和去垢剂(Triton X-100或者NP-40)制备细胞系。对于组织样品,例如,从心脏、脑组织和脂肪组织中提取相同蛋白质的最佳方法不一定是相同的。 通常,可以同时尝试两种裂解方案,比如“富集膜蛋白”或“常规制备”,最后选择对目的蛋白最合适的方案。
此外,还需要考虑蛋白质的亚细胞定位(例如,质膜蛋白和核蛋白需要不同的样品制备方法),以及目标蛋白是否富含脂筏等特定微结构域(低温下脂筏能抵抗非离子去垢剂的抽提,超声有助于裂解过程)。当目的蛋白丰度很低时,还需要浓缩膜组分。蛋白具有多重跨膜结构域时,需要注意防止蛋白聚集或降解。
2.2 裂解液与裂解方式
对组织或细胞样品进行裂解是为了释放目的蛋白、不同裂解缓冲液对蛋白溶解能力各不相同。现在裂解液市面上有很多,有RIPA,NP-40,Triton X-100,SDS等,那我们如何去做选择呢?
离子通道抗体厂家Alomone不建议使用RIPA进行裂解样品,RIPA往往会“破坏”膜蛋白,导致膜蛋白降解,特别 不适合多重跨膜蛋白和易降解膜蛋白。另外,RIPA 裂解液提取蛋白已被证实有10-30%的蛋白会丢失在不可溶组分中。Laemmli样品缓冲液释放更加全面。有些蛋白对于降解非常敏感,可以尝试不同的样品裂解液。
| Laemmli样品缓冲液 | lp裂解液 | 富集膜蛋白裂解液 | 常规组织裂解液 | ||||
| 成分 | 浓度 | 成分 | 浓度 | 成分 | 浓度 | 成分 | 浓度 |
| Tris (pH6.8) | 62.5 mM | Tris (pH7.6) | 50 mM | HEPES(pH7.4) | 4mM | Tris(pH7.4) | 50 mM |
| sDs | 2% | Triton x-100 | 1% | Sucrose | 320 mM | Triton x-100 | 1% |
| Glycerol | 10% | EDTA(pH8) | 5mM | EDTA(pH8) | 5mM | EDTA(pH8) | 5 mM |
| DTT | 100 mM | Nacl | 150 mM | - | - | - | - |
在裂解组织蛋白时,请注意全程需在冰上操作,裂解时需加入cocktail形式的蛋白酶体抑制剂。对于核蛋白和富含脂筏的,裂解时强烈建议超声处理,可以更大程度释放蛋白。组织匀浆时,避免使用匀浆珠,后者的放热可能导致蛋白损失。裂解后测完浓度,冻存于-80℃备用。
2.3 变性与上样
变性时,将样品在 Laemmli 缓冲液中 70–100°C 下加热 10 分钟。对于细胞,通常将其加热到 100℃。组织是更复杂的样本,加热到 70℃可保护最“容易”降解的蛋白质。另外,对于多重跨膜蛋白,也不建议煮沸,可能会引起膜的聚集或者膜蛋白的降解,一般建议70℃ 10min或者37℃ 30min。对于可能形成多聚体的指标,要确保中Laemmli 缓冲液中的还原剂有效,最好新鲜配制,DTT长时间会失效,可另外补充。
如果样品在冰箱里存储一段时间,上样前可在70℃煮一下,有助于得到清晰的条带。细胞样品建议上样2–5x105个细胞/泳道的裂解液。由于组织裂解时有许多杂质,上样80–100µg组织裂解液/泳道。

图3 煮沸可能引起膜蛋白降解
△点击放大图片
2.4 电泳与转膜
对于高分子量蛋白(HMW,分子量>150KD),电泳时Tris-Glycine 4–6% 或Tris-Acetate 3–8%凝胶是最佳选择,也可根据经验选择凝胶。
HMW建议湿转,在4°C下以100 mA将蛋白质从凝胶转移到膜上20小时。注意此步骤至关重要,因为它决定了传输的有效性。较长的转移时间将提高 HMW 蛋白质转移的效率。
2.5 封闭与抗体稀释
一般产品说明会提供对应抗体的最佳的实验条件,当您实验遇到问题,需要优化实验时,请您优先参照产说明进行操作。
03 常用实验protocol
3.1 使用 Laemmli 样品缓冲液制备细胞裂解液
用冰冷的 PBS 清洗细胞板,重复3次。(对于悬浮细胞,清洗离心后加入裂解液)
将板置于冰上并以 5 × 106细胞/ml 样品缓冲液的比例加入预冷的样品缓冲液(62.5 mM Tris(pH 6.8)、2%SDS、10%甘油和100mM DTT)。
用细胞刮刀刮下培养皿并将裂解液收集到微管中。
将样品在100°C下煮沸5分钟。
对煮沸的样品进行超声处理5秒钟。
将样品在4°C下以14,000 rpm的速度离心5分钟。
将上清液转移到干净的微管中,并储存在-80°C直至进一步使用。
3.2 使用温和去垢剂制备细胞裂解液
对于IP等应用,我们建议使用温和的去垢剂(如Triton X-100或NP-40)进行细胞裂解。
用冰冷的PBS清洗细胞板,重复3次。(对于悬浮细胞,清洗离心后加入裂解液)
将板置于冰上并以5 ×106个细胞/ml的比例加入预冷的IP裂解液。
用细胞刮刀刮下培养皿并将裂解液收集到微管中。
在 4°C下将样品在微管中摇晃30分钟。
将样品在 4°C下以14,000 rpm的速度离心10分钟。
小心地将透明上清液转移到干净的微管中。您可以将样品在-20°C下保存数月或立即与Laemmli样品缓冲液混合。
3.3 富集膜蛋白制备组织裂解液
从动物身上取出感兴趣的组织,并在液氮中快速冷冻。将组织储存在 -80°C 直至进一步使用。
将冷冻组织放入5倍体积预冷的富集膜蛋白裂解液中。
用 polytron 匀浆器匀浆组织。
在 4°C下以 2,000 xg离心匀浆10分钟,丢弃大碎片。
将上清液转移到干净的微管中,将沉淀重悬在2倍体积的富集膜蛋白裂解液中并重新匀浆。
在4°C下以 2,000 xg离心匀浆10分钟。将上清液与步骤e中的上清液混合。
将上清液(来自步骤e和f)在4°C下以100,000 xg离心1小时。
丢弃上清液。用2倍体积的富集膜蛋白裂解液重悬沉淀(含有组织膜),并用 polytron匀浆器短暂匀浆。
使用Bradford方法测量蛋白质浓度。用富集膜蛋白裂解液将蛋白质浓度调整至4 mg/ml。
将蛋白质样品储存在-80°C直至进一步使用。
3.4 常规制备组织裂解液
从动物身上取出感兴趣的组织/器官,并在液氮中快速冷冻。将组织/器官储存在-80°C 直至进一步使用。
将冷冻组织放入5倍体积预冷的常规组织裂解液中。
用 polytron 匀浆器匀浆组织。
在 4°C 下旋转样品30分钟。
在 4°C 下以 100,000 xg离心匀浆1小时。
将上清液转移到干净的微管中,并使用 Bradford 方法测量蛋白质浓度。使用常规组织裂解液将蛋白质浓度调整至4mg/ml。将裂解液储存在-80°C下直至进一步使用。
好的研究依赖于稳定高质量的试剂, Alomone离子通道专家(优宁维独家代理)多年来一直为离子通道研究提供稳定可靠的抗体,小分子化合物等。除了试剂,离子通道研究另一个不可或缺的工具就是— 全自动膜片钳。

△点击放大图片
Reference:
Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature 1997:389:816-824.
McKemy DD, Neuhausser WM, Julius D. Identification of a cold receptor reveals a general role for TRP channels in thermosensation. Nature 2002:416:52-58
Coste B, Mathur J, Schmidt M, Earley TJ, Ranade S, Petrus MJ, Dubin AE, Patapoutian A. Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels. Science 2010:330: 55-60
Janes, K. A. (2016). An Analysis of Critical Factors for Quantitative Immunoblotting. Sci Signal. ; 8(371): rs2. doi:10.1126/scisignal.2005966.
https://www.alomone.com/support/protocols