前言
支气管哮喘(bronchial asthma)是由多种细胞和细胞组分参与的气道慢性炎症为特征的异质性疾病。人们对决定病情恶化过程的分子免疫学过程仍知之甚少,这阻碍了有效治疗方法的发展进展。本研究旨在分析单个免疫细胞的转录组变化。

来源于网络侵删
△点击放大图片
目的:在细胞水平上识别与哮喘恶化密切相关的候选基因。
样本:支气管肺泡灌洗液(哮喘加重患者和健康对照组)
方法:通过荧光激活细胞分选分离细胞,并对富集的细胞群进行单细胞RNA测序。
FACS:
获得BALF样本后,红细胞被裂解,用冰冷的PBS洗涤。然后用台盼蓝计数细胞,用7-aminoactinomycin D染色。BALF细胞用抗人CD45染色。用FACSAriaIII流式细胞仪收集活的CD45细胞。
单细胞基因表达:
为了替代BALF中单个免疫细胞的转录组谱,使用了BD Rhapsody单细胞分析系统,如之前报道的那样。简单地说,对已分类的BALF CD45细胞的单细胞捕获是通过随机分布在超过20万个微孔中进行的。具有独特分子标识符的珠子被添加到微孔中,使单个珠子与单个细胞配对。裂解缓冲液用于裂解细胞,使RNA分子与珠子杂交。将珠子收集到单个试管中,用逆转录法合成cDNA。然后将每个cDNA分子标记在59端(即mRNA转录本的39端),用分子指数和细胞标记表示其细胞来源。合成第二链cDNA,然后用BD狂想曲单细胞全转录组扩增试剂盒连接适配器进行转录组文库的通用扩增。共用18个周期的PCR扩增接头连接的cDNA产物。
通过分析BALF中的CD45+免疫细胞,我们使用Single R鉴定了69个具有特定分子标记的不同簇,如热图所示:

△点击放大图片
哮喘加重患者BALF中肺免疫细胞的单细胞rna序列分析 :


△点击放大图片
对健康受试者的5个肺悬液和对健康哮喘发作患者的11个肺产生的单细胞悬液进行单细胞rna测序。使用基于图的共享最近邻聚类方法对细胞进行聚类,并通过tSNE图绘制。
A,已鉴定出的16个细胞群。
B,部分巨噬细胞簇(C0)和CD8 t细胞簇(C1)的水平也有所升高。
C,为了检测促炎因子的表达,检测了已鉴定的细胞簇的细胞因子谱。
与哮喘恶化相关的已知转录调控因子的表达水平:

△点击放大图片
每个点的大小代表每种类型的细胞比例,并着色表示每个标记基因在所有细胞中的平均表达量。
单细胞RNA-seq鉴定了BALF免疫细胞中严重哮喘相关基因的表达:

△点击放大图片
哮喘发作患者BALF免疫细胞中差异表达基因tSNE图中的基因表达特征,确定了104个与严重哮喘发病机制密切相关的基因。发现有10个基因被已鉴定的细胞簇差异表达。在这些基因中,CEACAM8和DPYSL3主要由巨噬细胞簇表达。AMPD3、ATXN7L1和CHML在巨噬细胞、CD41和CD81t细胞簇中存在差异表达。GSDMB在t细胞簇中强烈表达,而HOMER2在单核细胞簇中表达。IL18R1主要存在于CD8 t细胞簇中。有趣的是,能够检测到在部分巨噬细胞簇中表达的TSLP。
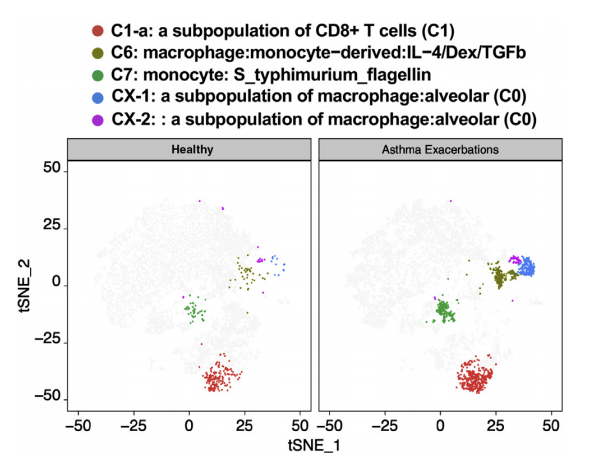
哮喘加重患者BALF中肺免疫细胞C1-a、C6、C7、CX-1和CX-2簇的TSNE图谱:
△点击放大图片
使用基于图的共享最近邻聚类方法对细胞进行聚类,并使用tSNE图绘制。健康组和哮喘加重组的肺免疫细胞C1-a、C6、C7、CX-1和CX-2细胞簇的TSNE图显示。显示了C1-a(CD8 T细胞的一个亚群)、C6(巨噬细胞:单核细胞2来源:IL24/Dex/TGF-b)、C7、CX-1和CX-2簇。
最终发现,在患者的支气管肺泡灌洗液中,单核细胞、CD8 T细胞和巨噬细胞的水平显著升高。一组细胞因子和细胞内转导调节因子与哮喘发作相关,并在多个细胞簇中共享,形成一个复杂的分子框架。另一组核心加重相关模块被激活,包括CD8 T细胞亚群(C1-a)和单核细胞簇中的真核起始因子2信号、ephrin受体信号和CXC趋化因子受体4型信号,它们与感染相关。
Reference:Single-cell transcriptomic analysis reveals keyimmune cell phenotypes in the lungs of patientswith asthma exacerbation