很多刚接触HIF-1α的同学们很容易碰到一个问题,就是做的Western老是空白条带,什么都没有。今天我们就带着这个问题,一起深入了解下这个缺氧大明星。
发现

美国癌症学家威廉·凯林(William G. Kaelin, Jr.)
英国医学家彼得·拉特克利夫(Sir Peter J. Ratcliffe)
美国医学家格雷格·塞门扎(Gregg L. Semenza)
△点击放大图片
HIF-1的发现得感谢上面三位科学家。我们一直知道氧气的重要性,却不清楚细胞是如何适应氧气水平的变化。这三位科学家为大家揭示了细胞水平的分子机理以及核心蛋白HIF-1,从而获得诺贝尔生理学或医学奖。
简单描述下发现的过程:首先在缺氧情况下,发现细胞内的促红细胞生成素(Erythropoietin, EPO)会大量表达,然后发现了增强EPO表达的关键区域——缺氧反应元件(Hypoxia Response Element,HRE)。最后发现与HRE特异性结合的蛋白——缺氧诱导因子(Hypoxia-Inducible Factor, HIF)。
结构
HIF-1结构上是一个异源二聚体,其中一个命名为HIF-1α,另外一个,命名为HIF-1β。HIF-1β又叫芳香烃受体核转运因子(Aryl Hydrocarbon Receptor Nuclear Translocator,ARNT)。研究发现,HIF-1β对氧气含量的变化并不敏感,所以我们的主角就是HIF-1α了。

HIF家族结构域示意图
△点击放大图片
HIF家族有共同的两个结构域:一个是紫色部分的碱性螺旋-环-螺旋结构域(Basic Helix-Loop-Helix, bHLH),一个是绿色部分的Per-ARNT-Sim结构域(Periodicity-ARNT-Single-minded,PAS)。这两个结构域是 HIF-1α 和 HIF-1β 亚基形成异二聚体所必需的。
蓝色是氧依赖降解结构域(Oxygen-Dependent Degradation, ODD),是HIF1受氧调控的关键部位,这个我们下部分细讲。N-TAD和C-TAD是两个反式激活结构域(transactivation domain, TAD),N-TAD位于ODD结构域,C-TAD 可以和CBP/p300 等相互作用共同激活下游基因。这两个结构域共同负责HIF-1α转录活性。
HIF-2α在 HIF-1α被发现不久后就被克隆出来了。HIF-2α与HIF-1α有 48% 的氨基酸序列是相同的,功能也类似,可以与HIF-1β形成异二聚体并结合HRE。不过与HIF-1α的普遍表达不同的是,HIF-2α主要表达在肺,内皮,颈动脉中。
后来发现的HIF-3α也在多种组织中表达,同样与 HIF-1β 形成异二聚体并结合HRE。不过目前HIF-1α 和 HIF-2α研究更加广泛,而HIF-3α和其他HIF亚型研究较少,还有待大家去研究。
降解
为什么HIF-1α Western难做呢,主要就是因为常氧快速降解,还没等你检测,就已经没有了。

HIF-1α信号通路
△点击放大图片
我们一起来看上面的通路图,在常氧条件下,HIF-1α 会发生脯氨酸羟基化(402和564位点都是脯氨酸),细心的同学还可以看到图中K532也同时发生了乙酰化。这时冯·希佩尔-林道肿瘤抑制蛋白(von Hippel-Lindau tumor suppressor protein,VHL) 就会结合到HIF-1α,发生泛素化,形成E3泛素连接酶复合体。随后发生蛋白酶体降解。
而在右边的缺氧条件下,HIF-1α没有了VHL这个蛋白的限制,不发生泛素化降解,从而不断积累进入细胞核,调控下游基因的表达。如果我们使用一些羟化酶抑制剂,例如DFO去铁胺和氯化钴等,同样可以阻断HIF-1α的降解,使HIF-1α的水平上调。
还需要注意的是,HIF-1α的降解不是只通过VHL调控。研究报道还有许多其他蛋白可以影响 HIF-1α的泛素化和稳定性。例如P53可以通过MDM2来降解HIF-1α;Jab1又可以增加HIF-1α的表达水平。此外,VHL 也与 HIF-1信号通路的其他蛋白有相互作用,因此VHL调节的不仅只是HIF-1α 稳定性。生物体如此复杂,大部分蛋白调控都是交错进行的。
常见问题
1.无条带

△点击放大图片
做HIF-1α蛋白最常见的问题就是无条带。在我们的咨询中,无条带的比例占到了80%。
碰到无条带的情况,首先要确认你的样本是否表达或高表达HIF-1α,是否使用低氧诱导,低氧诱导是否成功,这些都可以通过上下游蛋白表达变化以及功能实验去综合判断的。
有的同学说我做的不是低氧诱导,是药物诱导,那么最好在旁边添加一个低氧诱导的阳性对照来排查问题。
小优细节君建议
阳性对照推荐0.5%氧气培养24h。如果没有低氧培养箱,建议使用氯化钴(100µM,4h)或者DMOG(1mM,6h)来处理细胞。
如果样本表达和低氧诱导都没有问题,还有一个关键点需要注意,就是蛋白提取操作是否成功。因为HIF-1α低氧诱导后主要在细胞核累积,所以提取蛋白时使用的裂解液和方法要充分裂解核蛋白。
建议使用裂解效果强的RIPA裂解液或者SDS裂解液,保证可以裂解核膜。裂解完增加超声步骤,完全破碎细胞膜和细胞核膜,打断DNA,充分释放蛋白,同时可以增加样本的均一性。建议每次超5~10S,间隔20S,共三个循环。超声时需要根样本体积及所用的探头大小调整超声功率,尽量保证在超声过程中样本不起泡,超声后样本变得澄清。
如果有同学说实验室没有超声仪器怎么办,可以使用1ml注射器,来回抽进打出5~10次,到没有阻力为止。做Western时也可以做一下核内参。
2. 条带位置不对
HIF-1α理论分子量在93KD,实际上由于蛋白的多种修饰,尤其是泛素化修饰,呈现出来的分子量在110-120KD左右。我们之前就碰到有同学只裁窄窄的两个marker之间的部分,很有可能将目的蛋白丢失。

Uniprot上HIF-1α的修饰
△点击放大图片
小优细节君建议
在跑HIF-1α一定要把膜裁宽一些,将70-150KD蛋白全部转上去。这里还需要注意,预染marker由于偶联了染料,出现5-10KD迁移偏差是很正常的现象。如果样本条带趋势符合造模,且条带位置和阳性对照一致,只是条带出现在了130 KD位置,我们可以基本确认是目的条带。
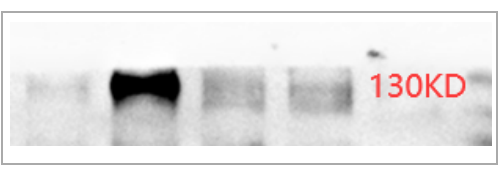
△点击放大图片
3. 为什么HIF-1β/ARNT能做出来,HIF-1α做不出来?
这个问题其实仔细看过上文的同学们是可以找到答案的。因为HIF-1β对氧气含量的变化并不敏感,也就是说正常的细胞组织是可以检测出HIF-1β的。我们看下图,同样的HepG2细胞,只有CoCl2处理后才能检测到HIF-1α,而未处理的HepG2就可以检测到HIF-1β。

HepG2细胞检测HIF-1α和HIF-1β
△点击放大图片
小优细节君建议
如果想通过其他亚型的表达情况来确认HIF-1α表达,建议可以做下HIF-2α。这两个蛋白比较相近,可以说明一定问题。
部分推荐产品:
| 货号 | 名称 |
| 36169T | HIF-1α (D1S7W) XP® Rabbit mAb |
| 14179S | HIF-1α (D2U3T) Rabbit mAb |
| NB100-105 | HIF-1 alpha Antibody |
| NB100-479 | Rabbit Polyclonal HIF-1 alpha Antibody |
| abs130612-50ug | Rabbit anti-HIF1A Polyclonal Antibody |
| abs120168-50ul | Rabbit Anti-HIF-1 Alpha Polyclonal Antibody |
参考文献:
1. Qingdong Ke, Max Costa. Hypoxia-inducible factor-1 (HIF-1). Mol Pharmacol. 2006 Nov;70(5):1469-80.
2. G L Semenza. HIF-1 and mechanisms of hypoxia sensing. Curr Opin Cell Biol. 2001 Apr;13(2):167-71.
3. Johannes Schödel, Peter J Ratcliffe. Mechanisms of hypoxia signalling: new implications for nephrology. Nat Rev Nephrol. 2019 Oct;15(10):641-659.