心血管疾病是全球的“头号死因”:它是一种严重威胁人类,特别是50岁以上中老年人健康的常见病,具有高患病率、高致残率和高死亡率的特点,即使应用目前最先进、完善的治疗手段,仍可有50%以上的脑血管意外幸存者生活不能完全自理,全世界每年死于心脑血管疾病的人数高达1500万人,居各种死因首位。
动脉粥样硬化是心血管疾病的的主要原因之一。已有众多研究表明,一种过氧化物酶体增长因子活化受体α(peroxisome proliferator-activated receptors, PPARα)通过在动脉粥样硬化过程的多个阶段进行干扰而起到抗动脉粥样硬化的作用。PPARα激动剂在动脉粥样硬化中的作用被描绘为存在于动脉粥样硬化病变中的最突出的细胞类型。
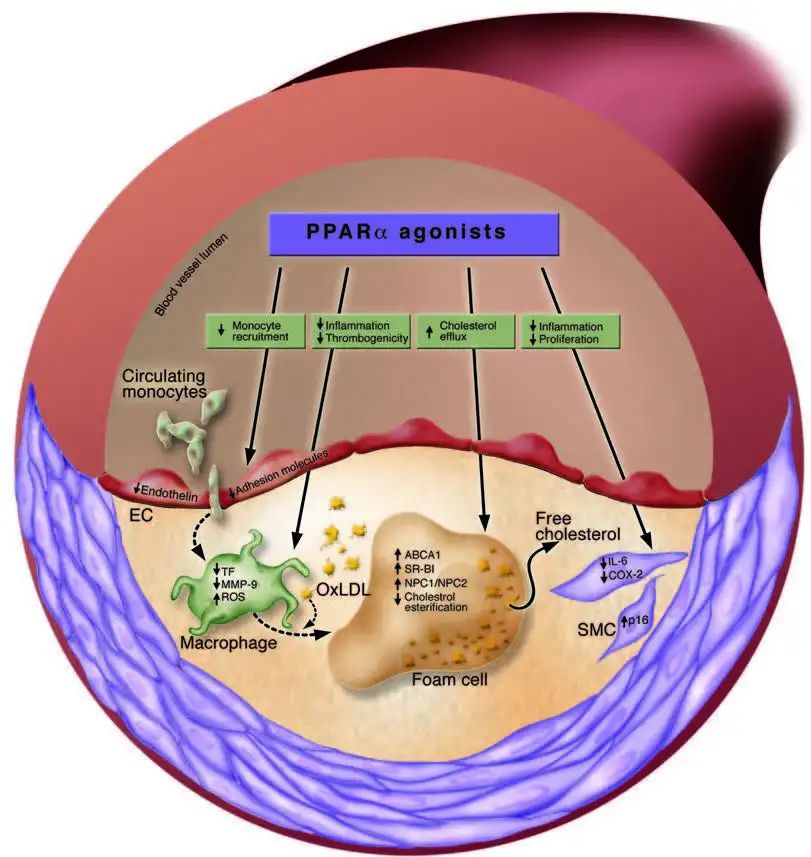
PPARα 和动脉粥样硬化
△点击放大图片
过氧化物酶体增长因子活化受体究竟是什么?它在生物体代谢中又是如何发挥作用的呢?接下来就为您解答。
过氧化物酶体增长因子活化受体(peroxisome proliferator-activated receptors,PPARs)是由脂肪酸及其衍生物激活的核激素受体,属于核激素受体家族中的配体激活受体。
PPARs和其他核受体超家族一样,本质上为一类配体依赖的转录调节因子,均为单亚基,具有N端区(A/B区)、居中高度保守的DNA结合区(C区)和C端的激素结合区(E区)。PPARs转录活性可通过与磷酸酶和激酶的非基因串扰来调节,包括ERK1 / 2,p38-MAPK,PKA,PKC,AMPK和GSK3。PPARs调节基因转录的经典途径包括其通过与配体结合的初始激活与视黄醇类X受体(retinoid X receptor,RXR)的异二聚化。PPAR-RXR二聚体与位于启动子或基因内区的过氧化物酶体增殖物反应元件(peroxisome proliferator response elements,PPRE)结合。同时,核受体共激活因子(co-activator)与PPAR-RXR协同作用并且补充和稳同活性转录复合体,可调节脂质代谢,脂肪形成,维持代谢稳态和炎症的基因的表达,并在多种人肿瘤中诱导抗癌作用。
目前已发现有PPARα、PPARβ/δ、PPARγ三种亚型,这三种亚型高度同源,但分布在不同的组织中,由不同的基因编码,并在组织和生物功能中显示出不同的分布模式。
PPARα 主要表达于肝脏、棕色脂肪组织、心脏、肾脏和肌肉组织,主要参与β-氧化和脂肪酸转运来调节脂质平衡。
PPARβ/δ 广泛表达于骨骼肌、脂肪组织、心脏和胃肠道,主要参与脂肪酸代谢。
PPARγ 在脂肪组织、免疫细胞和结肠中表达,主要负责调节脂肪细胞分化和改善胰岛素抵抗。
PPARs作为核受体于生物体内广泛分布,其在能量代谢中的作用有待进一步研究。
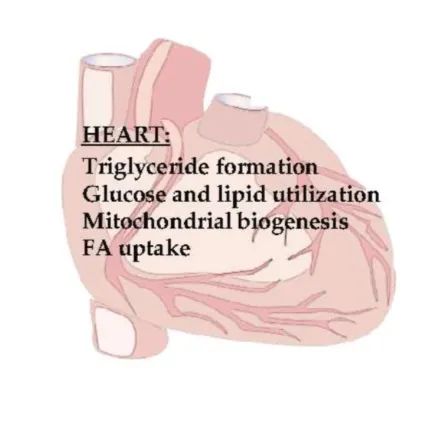
PPARs在心脏能量代谢中的作用
心脏消耗ATP来维持其收缩功能,而脂肪酸是主要的能量来源。心脏使用的大约70%的ATP来自脂肪酸氧化。心脏脂肪酸氧化在不同阶段受到调控,如脂肪酸摄取、甘油三酯形成和储存、甘油三酯脂解释放未酯化的脂肪酸、将脂肪酸转移到线粒体中以供脂肪酸氧化以及ATP的生产。大多数蛋白质受PPARα转录调控。心肌中的PPARβ/δ控制葡萄糖和脂质的利用,并促进胰岛素敏感性。
心脏中PPARs的活性受过氧化物酶体增殖物激活受体γ共激活因子1(peroxisome proliferator-activated receptorγcoactivator-1,PGC-1)调节,PGC-1α负责线粒体的生物发生和代谢。PGC-1α是心脏中高表达的基因。PGC-1α的过表达显着增加了核和线粒体相关基因的表达,从而将代谢能底物从葡萄糖变为脂肪酸。
PPARα通过激活脂肪酸代谢途径中的基因来调节心脏的脂肪酸氧化。PPARβ/δ的过表达通过上调线粒体FA转运和β-氧化中的基因来诱导脂肪酸氧化,但PPARβ/δ的过表达不会引起脂质蓄积和心脏功能障碍,这可能是由于葡萄糖利用率高所致;PPARβ/δ的缺失下调脂肪酸氧化基因并通过脂质蓄积引起心脏肥大。
患有代谢综合征和主动脉瓣狭窄的患者在心脏中表达高水平的PPARγ,这与心脏脂质蓄积和心脏功能差密切相关。在某些病理条件下,当PPARγ水平较高时,可能会引起心肌病。
△点击放大图片
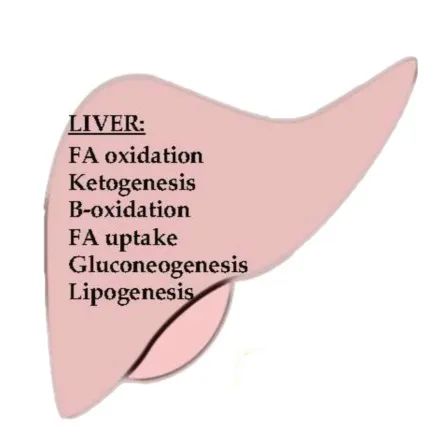
PPARs在肝脏能量代谢中的作用
肝脏是参与全身能量代谢的主要器官,因为它能代谢脂肪酸和葡萄糖。
PPARα 主要表达于肝脏,由脂肪酸氧化调节能量代谢。在禁食期间,它调节脂肪酸的摄取、生酮和β-氧化。
肝脏中PPARα引起的脂肪酸氧化在酮症中也起着重要作用,它满足了禁食时的能量需求。在禁食的情况下,PPARα可通过增强线粒体HMG-CoA合酶的水平来增加脂肪组织中脂肪酸的吸收和线粒体运输,从而将乙酰辅酶A转化为酮体。
PPARα调节过氧化物酶体中直链脂肪酸降解所涉及的酶。如甘油-3-磷酸脱氢酶(GPDH)和甘油激酶在PPARα的调控下将甘油转化为葡萄糖。在进食的情况下,PPARα指导脂肪的从头生成,提供以甘油三酸酯形式存储的脂肪酸,可以在饥饿时利用。
PPARβ/δ在肝脏能量代谢调节中具有不同的作用。PPARβ/δ的过表达会上调参与能量代谢的基因,而PPARβ/δ的缺失会降低负责脂肪生成和葡萄糖利用的基因的表达。
PPARγ在小鼠肝脏中的表达会引起肝脂肪变性。PPARα的异常刺激会通过脂肪肝产生肝细胞癌。
△点击放大图片
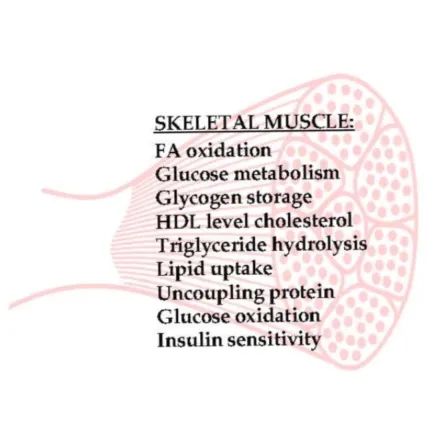
PPARs在骨骼肌能量代谢中的作用
骨骼肌约占总体重的40%,是糖原储存、胰岛素介导的葡萄糖利用、脂质代谢、脂肪酸氧化和葡萄糖代谢的重要部位,在胰岛素敏感性和脂质代谢中具有重要作用。
PPARβ/δ 的表达在骨骼肌中占主导地位,它通过依赖脂肪酸作为能量来源来调节参与能量代谢的基因表达。它调节甘油三酯水解、脂质摄取和脂肪酸氧化的基因,以及激活解偶联蛋白为氧化磷酸化提供能量,它还编码线粒体蛋白CPT1来调节长链脂肪酸氧化。PPARβ/δ 激活FOXO1(代谢适应的转录因子)和丙酮酸脱氢酶激酶4(PDK4),后者使丙酮酸脱氢酶复合物失活,因此是肌肉碳水化合物氧化的限速步骤。PDK4作用于几个编码脂质流出和能量消耗的基因,它还能上调脂肪酸β-氧化。
骨骼肌的能量代谢受线粒体生物合成调节剂PGC-1的调节,PGC-1α的表达直接被PPARβ/δ激活,通过增加线粒体蛋白的表达来调节骨骼肌的新陈代谢。PGC-1α刺激负责葡萄糖和脂质代谢,能量转移和肌肉收缩功能的基因的表达。
在骨骼肌中,脂质氧化的增加和葡萄糖利用的减少是通过激活PPARδ来进行的。
△点击放大图片
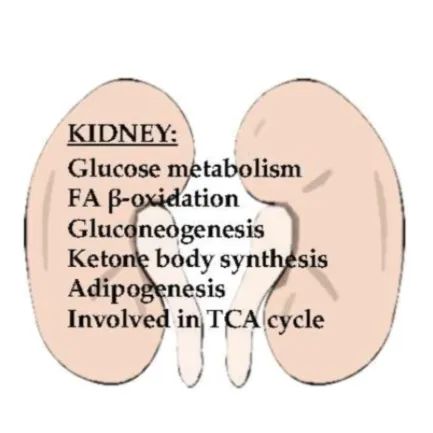
PPARs在肾脏能量代谢中的作用
PPARs的三种亚型在肾脏中均有表达,PPARα主要存在于Henle的近端小管和髓质厚上升肢中,PPARγ主要存在于肾小管和近端小管的髓质收集管中。
PPARα和PPARγ与脂肪酸和葡萄糖代谢的控制有关。脂肪酸是肾皮质组织中产生能量的主要燃料来源。PPARγ改变了参与外周葡萄糖和脂肪酸代谢的大量靶基因,从而改善了胰岛素敏感性和血糖控制。
PPARα是脂质代谢的主要调节剂,它可控制其靶基因(如酰基辅酶A氧化酶,酰基辅酶A,CPT1a,PGC1α,UCP2和UCP3)的转录,它调节肾脏脂肪酸的β-氧化,以提供近端肾小管细胞中ATP。
在肾近端小管细胞中,花生四烯酸或亚油酸的脂肪酸代谢物通过环氧合酶或脂氧合酶途径活化PPARα。线粒体的生物合成是由PPARα通过氧化磷酸化,脂肪酸代谢和三羧酸循环控制的。
PPARs激动剂和拮抗剂可用于调节肾小球肾炎,肾小球硬化和糖尿病性肾病等肾脏疾病。
△点击放大图片
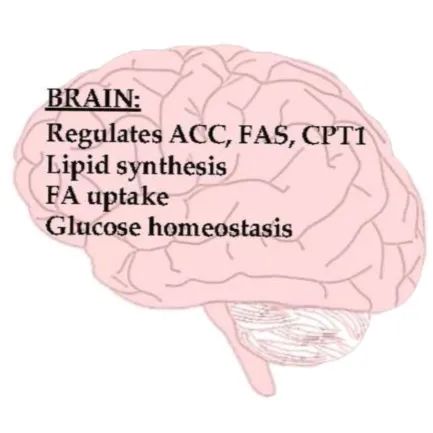
PPARs在大脑能量代谢中的作用
PPARs在中枢神经系统中有表达。其中,PPARγ是用于调节能量稳态的关键神经元同工型,它调节参与脂肪酸代谢的基因,如乙酰辅酶A羧化酶(ACC)、脂肪酸合成酶(FAS)和CPT1。它在脑的腹内侧核(VMN)和下丘脑弓状核(ARC)内表达。中枢PPARγ的过表达会增加食物摄入量、腹部脂肪、神经肽Y(NPY)活性和下丘脑的弓状核中前阿黑皮素(POMC)的表达。
研究表明,PPARα和/或PPARγ的激活有助于体重增加和肥胖。敲除神经元和下丘脑中的PPARγ可防止饮食引起的肥胖症的发展。
PPARγ 激动剂对帕金森病、阿尔茨海默病、脑损伤和肌萎缩侧索硬化症都有疗效。它们能有效抑制中枢神经系统炎症和神经退行性疾病动物模型的发展。
△点击放大图片
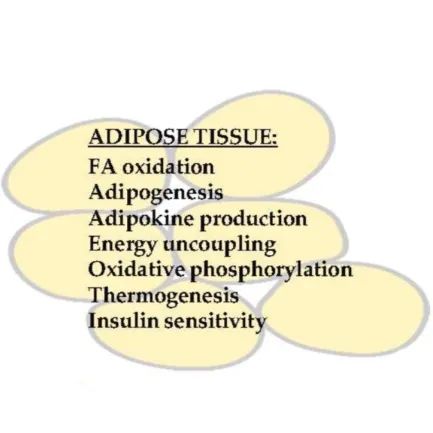
PPARs在脂肪组织能量代谢中的作用
脂肪组织对于体内能量稳态至关重要。脂肪组织有两种功能类型:白色脂肪组织(white adipose tissue,WAT)和棕色脂肪组织(brown adipose tissue ,BAT)。WAT是其他器官的热量储存库,在营养过剩的情况下,它会将营养物质存储为脂质。在饥饿期间,它通过脂解作用释放能量。BAT专门用于脂质的存储,并通过产生热量来增加能量消耗。
脂肪组织执行内分泌功能,并分泌各种激素,细胞因子和脂肪因子,它们通过获取来自中枢神经系统的信号和周围组织的代谢活动来调节能量平衡。
PPARγ在两种类型的脂肪组织中广泛表达。它参与了脂肪酸摄取和储存以及脂肪组织分化必不可少的基因的诱导。PPARγ在非脂肪形成细胞中的异位表达可有效地将其转化为脂肪细胞,PPARγ对于动物脂肪细胞的产生和存活是必不可少的。
PPARα在BAT中高表达,但在WAT中不表达,其功能是调节线粒体解偶联蛋白UCP1和PGC1α的表达。当PPARα在人和小鼠的脂肪细胞中被激活时,它会诱导脂肪酸氧化基因表达并增加能量消耗。
PPARβ/δ也在BAT和WAT中表达,它对脂肪酸氧化的调控和BAT的产热有重要作用。当PPARβ/δ在脂肪组织中异位表达时,它会显著诱导脂肪酸氧化、氧化磷酸化和产热相关基因的表达。
脂肪组织中PPARγ的激活诱导了脂肪酸运输和储存基因的表达,并促进了脂肪的新生,因此PPARγ激活剂噻唑烷二酮(TZD)已被广泛用于II型糖尿病的治疗。
△点击放大图片
文章总结
PPARs是核受体超家族成员,在机体能量代谢中起着重要作用。PPARs分为三种亚型,即PPARα, PPARβ/δ, 以及PPARγ。它们共同参与脂肪酸氧化,以及全身的葡萄糖和脂质代谢。重要的是,PPARs的三种亚型在细胞和全身水平上具有互补和不同的能量平衡代谢活性。PPARs还与其他共同调节者一起维持能量稳态。当内源性配体与这些受体结合时,它们调节参与能量稳态的基因的转录。
PPARs除了在生物体能量代谢中发挥重要作用,它还与细胞分化、增殖、凋亡,炎性反应等密切相关,有许多问题待大家去深入探究。
部分产品推荐:
| 货号 | 品名 |
| 2443S | PPARY (81B8) Rabbit mAb |
| 8660T | PPARY Regulated Fatty Acid Metabolism Antibody Sampler Kit |
| 2178S | PGC-1a (3Go) Rabbit mAb |
| 4695s | p44l42 MAPK (Erk1/2) (137F5) Rabbit mAb |
| 8690s | p38 MAPK (D13E1)xPO Rabbit mAb |
| 5831S | AMPKa (D5A2) Rabbit mAb |
| 2880S | Foxo1 (C29H4) Rabbit mAb |
| 1110/10 | enistein (10 g) |
| 5075/50 | Harmine (50 mg) |
| abs810355 | FH535 |
| abs812978 | oleuropein |
| abs819765 | Mifobate |
| abs817974 | Pioglitazone |
| abs817119 | Daidzein |
| abs817216 | emfibrozil |
参考文献:
[1] Lefebvre, Philippe et al. “Sorting out the roles of PPAR alpha in energy metabolism and vascular homeostasis.” The Journal of clinical investigation vol. 116,3 (2006): 571-80. doi:10.1172/JCI27989
[2] Barish, Grant D et al. “PPAR delta: a dagger in the heart of the metabolic syndrome.” The Journal of clinical investigation vol. 116,3 (2006): 590-7. doi:10.1172/JCI27955
[3] Lehrke M, Lazar MA. The many faces of PPARgamma. Cell. 2005 Dec 16;123(6):993-9. doi: 10.1016/j.cell.2005.11.026. PMID: 16360030.
[4] Wang, Yong-Xu. “PPARs: diverse regulators in energy metabolism and metabolic diseases.” Cell research vol. 20,2 (2010): 124-37. doi:10.1038/cr.2010.13
[5] Korbecki, Jan et al. “Self-regulation of the inflammatory response by peroxisome proliferator-activated receptors.” Inflammation research : official journal of the European Histamine Research Society ... [et al.] vol. 68,6 (2019): 443-458. doi:10.1007/s00011-019-01231-1
[6] Lamichane, Shreekrishna et al. “Pivotal Roles of Peroxisome Proliferator-Activated Receptors (PPARs) and Their Signal Cascade for Cellular and Whole-Body Energy Homeostasis.” International journal of molecular sciences vol. 19,4 949. 22 Mar. 2018, doi:10.3390/ijms19040949
[7] Schupp M, Lazar MA. Endogenous ligands for nuclear receptors: digging deeper. J Biol Chem. 2010 Dec 24;285(52):40409-15. doi: 10.1074/jbc.R110.182451. Epub 2010 Oct 18. PMID: 20956526; PMCID: PMC3003339.