针对血样样本,我们展开了系列文章分享:
第二篇:【血液样本处理全攻略】2——血清、血浆制备及保存时间的影响
第三篇:【血液样本处理全攻略】3——溶血素(裂红)你真的会用么
第四篇:【血液样本处理全攻略】4——一群特殊的存在:中性粒细胞neutrophils
本篇将针对PBMC的制备、保存、冻存检测做详细说明。
PBMC中常见免疫细胞比例

△点击放大图片
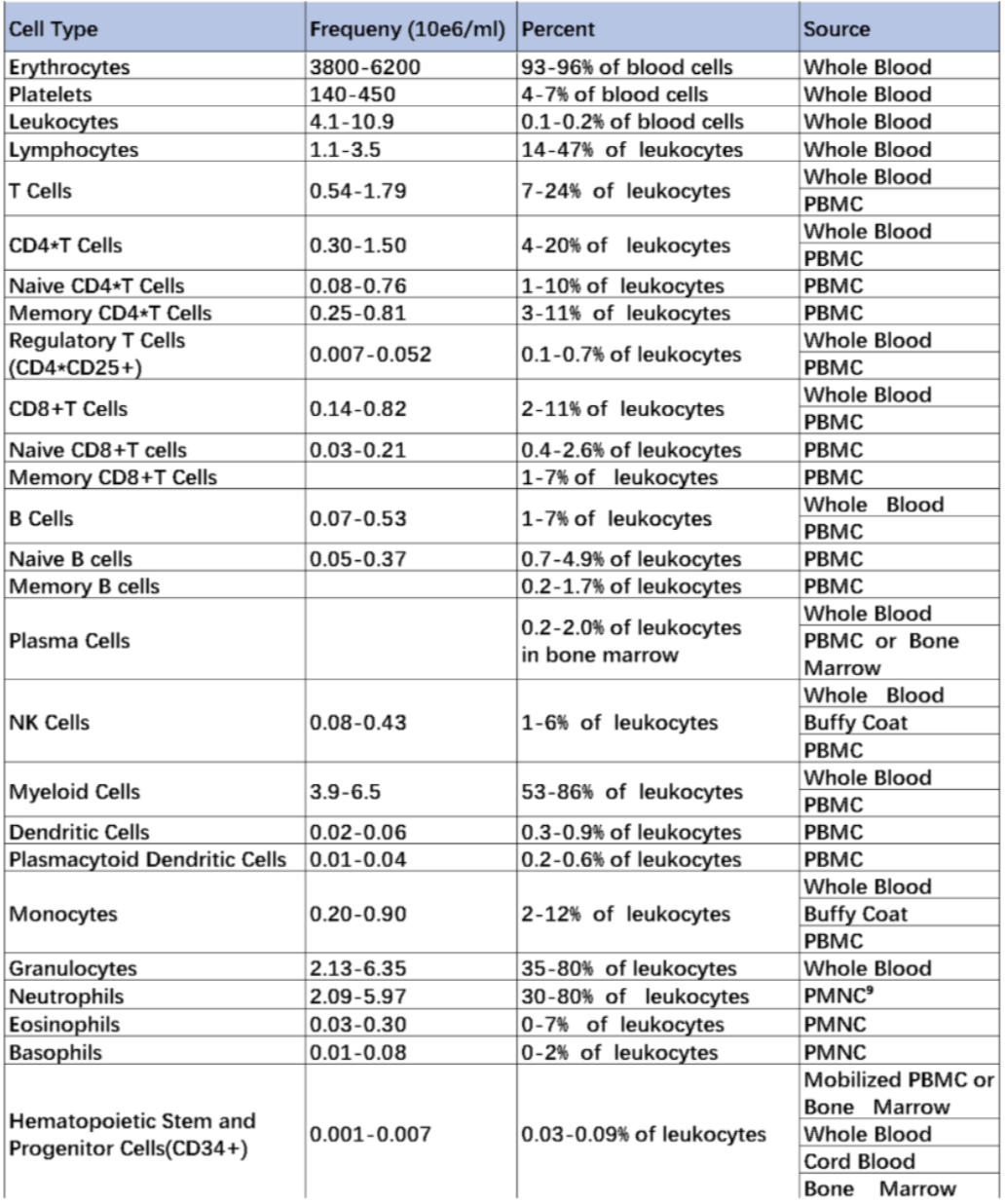
△点击放大图片
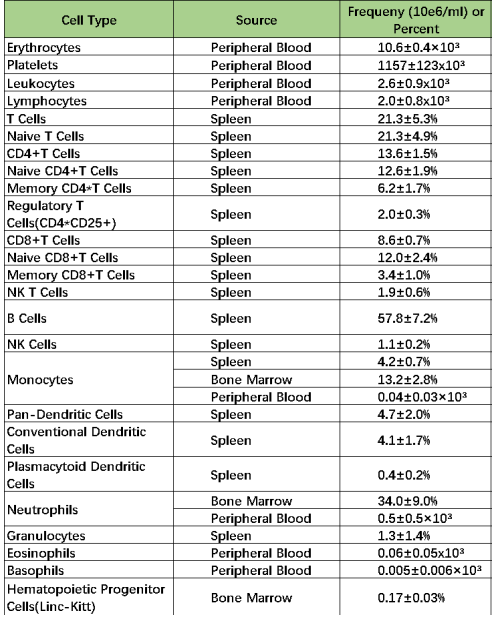
△点击放大图片
PBMC制备
1、PBMC制备原理说明

△点击放大图片
2、密度梯度离心workflow
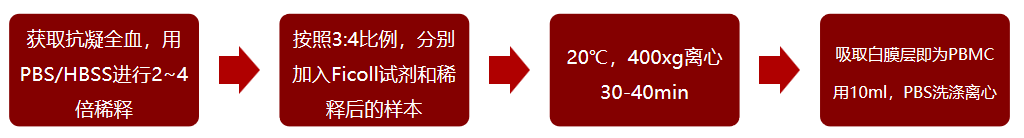
△点击放大图片
abs930分离效果DEMO展示:

Ficoll密度梯度离心前
△点击放大图片

Ficoll密度梯度离心后
△点击放大图片
3、Ficoll使用注意事项
Q:FICOLL 可用于哪些种属细胞的分离?
A:Ficoll 被用作从外周血、骨髓及脐带血中分离高活性的单个核细胞(包括淋巴细胞和单核细胞)
Ficoll主要用于人外周血中淋巴细胞的分离,如果待分离的淋巴细胞来自其他的组织/种属,可能无法获得淋巴细胞的最佳产量和纯度,需要对标准操作进行优化。
1.077 g/mL:人外周血,脐带血,骨髓中分离PBMC(无粒细胞群)
1.073 g/mL:人低密度细胞,如基质细胞和间充质干细胞
1.084 g/mL: 大鼠和小鼠血液,骨髓中分离PBMC
Q:FICOLL 的保存条件是什么?
A:Ficoll应避光储存于 4-30 °C 之间,在该条件下可以保存 3 年。打开后建议存储于 4-8℃。偶尔短时冷冻,解冻后来回反复倒置,确保溶液的均一。
Q:用 FICOLL 进行人外周血中淋巴细胞的分离时,淋巴细胞所处的位置如何,各层分别是哪种细胞?
A:离心完成后,从管底往上依次为红细胞-粒细胞-Ficoll 细胞分离液-淋巴细胞-血小板-血浆。在取淋巴细胞时要小心将上层的血浆和血小板移除后再吸取淋巴细胞。

△点击放大图片
Q:用 FICOLL 进行人外周血中淋巴细胞的分离时,血液样品和 FICOLL 的比例是如何的?大体积样品该如何处理?
A:按照样品:
Ficoll 的高度比约为 3:2.4 或体积比 4:3 的比例进行样品和分离液的添加。
大体积样品可以通过增加离心管的直径来进行分离。增加离心管直径并不影响所需的分离时间。

△点击放大图片
Q:PBMC得率较低且活性较差
A:在温度较高的情况下,Ficoll产品的密度较低,因此某些淋巴细胞可穿透Ficoll层,细胞的活性也会同时受到影响。合适的分离温度应保持在18到22℃。
Q:有较多红细胞污染
A:原因1:温度太低:Ficoll-Paque是一种密度梯度离心介质,在低温条件下,Ficoll-Paque本身的密度较高,因而红细胞的聚集效果比较差,红细胞和粒细胞不能很好地穿透Ficoll-Paque层而造成结果污染。合适的分离温度应保持在18到20℃。
原因2:离心速度不够或离心时间过短:必须保证足够的离心时间及离心力以保证不同细胞具有合适的分层。
Q:PBMC得率较低,且带有粒细胞污染
A:离心机不稳定,导致密度梯度的波动:波动可能带来单个核细胞层的条带变宽,从而与底层细胞混合。建议检查离心机是否配平合适,并检查离心机状态。
冻存后的PBMC对流式结果有多少影响

△点击放大图片
Human外周血单核细胞 (PBMC) 是重要的生物资源,有助于提高我们对免疫疾病的了解,并在免疫治疗中发挥关键作用。
为了解决新鲜分离的 PBMC 的局限性,冷冻保存的 PBMC 被广泛应用于基础研究和临床试验。许多临床试验需要高质量的功能性 T 细胞产品和稳定的细胞亚型;因此,需要以适当的方式评估多年来收集的大量冷冻保存的 PBMC
1、实验方案设计

△点击放大图片
2、PBMC 回收率和活力保持稳定
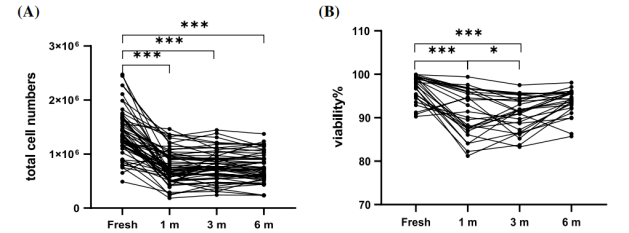
△点击放大图片
A: 冻存后的细胞数量变化(新鲜样本,冻存时间1月,3月,6月)
与新鲜样本相比明显减少(P < 0.0001),但冻存1、3、6个月后均无明显变化,统计学结果显示1m vs 3m,P = 0.48;1m vs 6m,P = 0.84;3m vs 6m,P = 0.11
B: 冻存后的细胞活率变化(新鲜样本,冻存时间1月,3月,6月)
冻存后PBMCs的活力显著降低,但在不同的冻存时间内PBMCs的活力保持稳定,统计结果显示1m与3m,P=0.99;1m与6m,P=0.10;3m与6m,P=0.05,这表明虽然冻存影响PBMCs的细胞恢复效率和活力,但PBMCs在长期冻存过程中仍然保持稳定的状态。
3、PBMCs 中的免疫细胞亚型受冷冻保存的影响
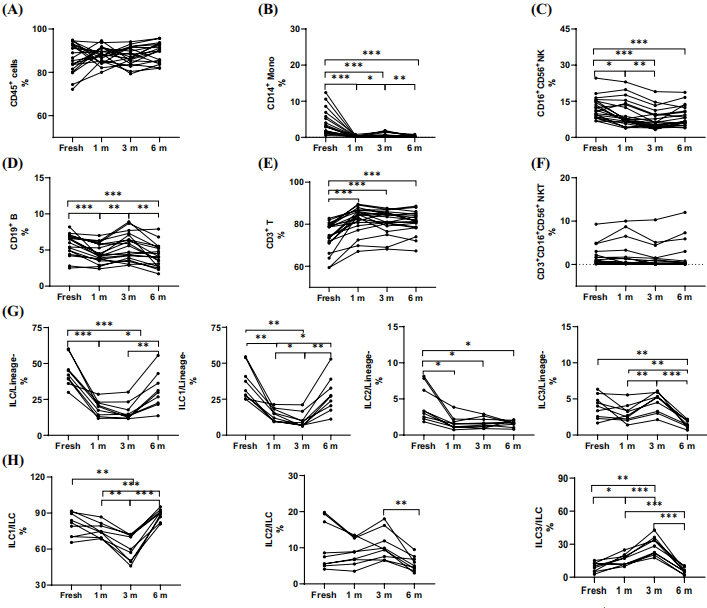
△点击放大图片
与新鲜分离的PBMCs相比,冻存后单核细胞和ILC的数量不仅显著减少
在长期冻存过程中单核细胞发生动态变化(单核细胞1m vs. 3m,3m vs. 6m,P < 0.05,P < 0.05;单核细胞1m vs. 6m,3m vs. 6m,P < 0.05,P < 0.01)。
进一步对ILC亚型分析显示,除ILC2外,ILC1和ILC3均受到长期冻存的影响(1 m vs. 3 m、1 m vs. 6 m、3 m vs. 6 m,P < 0.05、P < 0.05、P < 0.01;1 m vs. 3 m、1 m vs. 6 m、3 m vs. 6 m,P < 0.01、P < 0.01、P < 0.01)
无论在长期冻存过程中还是在新鲜分离的PBMCs中,ILC中各亚型的比例都会发生变化
自然杀伤(NK)细胞的数量与新鲜分离的细胞相比显著减少,但NK细胞在长期冻存过程中保持稳定。
新鲜与冻存的适应性免疫细胞中T细胞和B细胞比例有明显变化,但不同时间冻存的PBMCs中T细胞和自然杀伤T(NKT)细胞比例无差异。
4、长期冷冻保存不会影响 T 细胞比例、细胞凋亡和增殖

△点击放大图片
T细胞应答是细胞免疫的重要组成部分,参与多种对抗疾病和感染的生物学功能。
前期研究结果已证实T细胞比例在冻存1、3、6个月后仍保持稳定。
T细胞可分为CD4 +辅助T细胞和CD8 +细胞毒性T细胞。新鲜分离的PBMCs与冻存的PBMCs中CD4 + T细胞的比例无差异。
与新鲜分离的 PBMCs 相比,冻存 PBMCs 中CD8 + T 细胞的百分比显著降低(新鲜 vs. 1 m、3 m、6 m,P < 0.0001,P < 0.0001,P < 0.001;1 m vs. 3 m、6 m,P < 0.0001,P < 0.0001),表明冻存后 T 细胞数量减少,主要受 CD8 + T 细胞的影响。

△点击放大图片
尽管已有研究证明冻存PBMCs活力保持稳定,但冻存可能会破坏细胞膜的完整性,改变线粒体膜电位,导致细胞凋亡。
研究结果表明,冻存对CD4 + T细胞和CD8 + T细胞凋亡没有影响。
对CFSE标记的T细胞的增殖进行评估,在用T细胞激活剂和IL-2刺激后,新鲜分离的与冻存的PBMCs之间的增殖能力发生了显著变化(新鲜vs. 1m、3m、6m,P < 0.05,P < 0.05,P < 0.05),但延长冷冻时间后无明显变化。
T细胞的变化主要是由CD4 + T细胞引起的,在冻存过程中,新鲜分离的PBMCs与冻存的PBMCs之间 CD8 + T细胞的增殖情况没有变化。
T细胞的增殖率没有因冻存时间的延长而受到影响,但似乎T细胞的传代发生了变化,在相同条件下经过72h的刺激后,冻存3个月和6个月的细胞增殖细胞数明显少于冻存1个月的细胞。
5、长期冷冻保存后,活化 T 细胞、幼稚 T 细胞、中央记忆 T 细胞、效应 T 细胞和效应记忆 T 细胞的比例发生动态变化
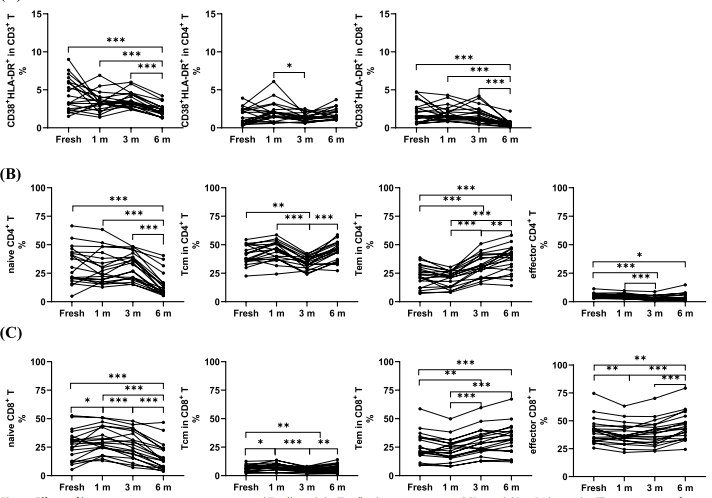
△点击放大图片
长期冷冻保存对活化 T 细胞和表达 CCR7 和 CD45RA 的 T 细胞亚型的影响。
Th Naïve(CD45RA+CCR7+)
Tcm(CD45-CCR7 +)
Tem(CCR7-CD45RA-)
效应-T(CD45RA + CCR-)
与新鲜分离的细胞相比,冻存6个月后幼稚CD4 + T细胞和幼稚CD8 + T细胞的比例均降低,且在不同冻存时间呈动态变化。
CD4+T细胞中枢记忆细胞(Tcm)和CD8+ Tcm的比例在3个月时已明显降低,但6个月后与新鲜分离的细胞相比无明显变化。
CD4 + T细胞和CD8 + T细胞中效应记忆细胞(Tem)的比例在冻存1个月后略有下降,但随着冻存时间的延长而明显升高。
效应CD4 +和CD8 + T细胞也随冻存时间缩短而呈增加趋势,这些结果提示冻存导致幼稚T细胞比例明显降低,其他亚型T细胞在长期冻存后有所增加,但与新鲜分离的样本相比仍有差异。
Reference:
1.Optimizing recovery of frozen human peripheral blood mononuclear cells for flow cytometry.
2.Freezing and Thawing of Peripheral Blood Mononuclear Cells (PBMCs).
3.Effects of long-term cryopreservation of PBMC on recovery of B cell subpopulations.
4.Impact of blood storage and sample handling on quality of high dimensional flow cytometric data in multicenter clinical research.
5.Effects of storage time and temperature on highly multiparametric flow analysis of peripheral blood samples; implications for clinical trial samples.
6.Comprehensive evaluation of the efects of long-term cryopreservation on peripheral blood mononuclear cells using fow cytometry.