经常有小伙伴们过来反馈说之前买的抗体,一开始是好用的,用着用着就不好用了,做不出来了;或者前一支买的是好用的,后面一支不好用了,这是什么原因呢?难道都是抗体原因吗?别急,今天小优细节君就和大家讨论一下关键的影响因素,以及WB需要注意的事项,从而提高抗体的可重复性。
抗体验证
抗体是否充分验证是影响可重复性的关键因素。通常有四种基本方法用于验证抗体的特异性,分别是WB验证、敲除验证、双抗体验证和IP-MS的验证,其中WB是使用最广泛的抗体特异性验证方法,基本任何实验室都能进行。
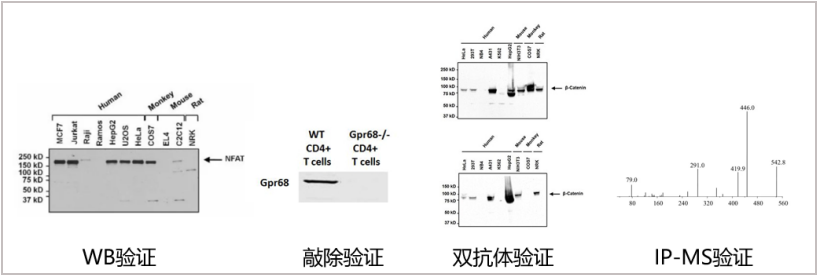
图1 四种基本抗体验证方法
△点击放大图片
有小伙伴要问了,抗体验证是抗体供应商的事情,为什么还需要我自己验证啊。如果选择的抗体有充分验证的数据,那倒不用担心,但是还有许多抗体其实未经充分验证,是需要使用人根据自己实验情况来自行验证的,一般也会选择进行WB验证。WB不仅可以检测抗体特异性结合,还可以预测抗体在其他应用中的成功率。有研究报道,尽管抗体的各个应用是独立的,但是WB的弱标记与IHC中的弱染色存在相关性。还有一个数据,在WB中产生单一准确信号的抗体中,90%以上也能产生良好的免疫染色信号。所以我们在选择抗体的时候可以尽量去选择有WB验证的。对于做不了WB的抗体,我们应该保持谨慎的态度。
举个例子,比如某些抗体页面标注了 “在WB中不起作用”,这是什么意思呢?对于不做WB只做IF或IHC的人来说,可能理解为“不用担心WB是否work,只要抗体在免疫染色中有效就行了”。然而,在绝大多数情况下,“在WB中不起作用”意味着抗体在WB中会与许多不同的蛋白质发生交叉反应,也就是非特异结合比较多,抗体供应商制备出不结合任何蛋白的抗体是很少见的。大家也可以回头找一找,那些用于组化染色重复性不好的抗体,是不是没有充分的WB验证数据。
关于WB的验证数据,有两点需要特别注意下。一、要看用的是什么样本,如果使用的是重组蛋白或者过表达的样本,其实对于我们的参考意义不是很大,因为我们大部分做的是组织/细胞的内源表达,和重组/过表达的量有数量级的区别。二、如果是磷酸化抗体,最好是有磷酸酶的数据,这样能说明抗体的特异性。我们之前碰到一个同学做磷酸化修饰,把磷酸化位点单独突变掉,然后用磷酸化抗体进行检测,发现还是有条带,觉得是抗体不特异。其实他忽略了一点,就是磷酸化抗体对于磷酸化位点周围的几个氨基酸都有一定的亲和力,所以这个实验结论是不准确的。
说了这么多抗体验证的事情,就是希望大家在抗体选择尽量选择有充分WB验证数据的,若没有,自己可以进行一下WB验证,可对抗体的可重复性打下坚实的基础。
抗体差异
同一个供应商往往会提供很多个不同克隆号的抗体,效果也是不一样的,经常有小伙伴问,为什么相同靶标的A抗体和B抗体,A抗体能做出来,B抗体做不出,是不是B抗体有问题,其实是B抗体不适用你的样本或者实验,是很常见的现象。前些年杂志只需要写抗体供应商就行了,现在基本都要求将抗体的货号具体写出,便于他人重复实验。我们就经常碰到不少同学因为其他品牌抗体便宜,或者货期快等原因,就轻易更换之前使用的抗体,导致结果不一致。所以我们要尽量保持整个课题前后所使用的试剂/抗体货号一致,这样才能提高可重复性。
还有一个问题就是批间差异,即便使用相同货号的抗体,效果也会随着批次有很大的区别。目前使用多克隆抗体的研究者是最多的,根据发表在Nature杂志上的使用统计,多克隆抗体占到了65%, 35%使用单克隆抗体,只有0.05%的人使用了重组抗体。多克隆抗体由于制备方法是动物免疫,所以批间差异大是无法避免的。那么一个好的习惯就是,准确记录实验所使用的抗体的货号和批号,后续购买时尽可能保持批次一致。当然,如果经费充裕,建议选择重组抗体,源头上减少批间差异,大幅提高抗体的可重复性。
WB注意事项
除了抗体本身的因素,实验方面的小细节也不容忽视。
01 样本
如果是动物样本,应该注意动物处死的方式也会影响到某些蛋白或者磷酸化的表达变化。我们应该尽可能保持前后批次实验的一致性,不能上一批是安乐死,或者做了麻醉,下一批直接脱颈椎。
如果是细胞样本,也是一样的,尽量保持每批细胞的收集方式一致。如果是做一些膜蛋白的研究或者磷酸化蛋白的研究,建议是直接使用刮板法收集,胰酶消化可能会改变蛋白表达。
02 裂解液
蛋白大部分是不溶的,所以需要裂解液中的去垢剂,例如SDS去溶解蛋白,所以SDS的浓度很关键。研究发现非离子型去垢剂(Triton X-100和NP-40)不能溶解许多蛋白质,尤其是突触蛋白。当发现提取出来的目的蛋白浓度较低时,有可能就是使用的RIPA裂解液不含/含SDS较低,那我们就可以尝试提高SDS的浓度,例如1%SDS 裂解液,让目的蛋白充分溶出。
03 转膜
很多实验室习惯重复使用转膜液,这个本身没有问题,有研究还发现最多重复使用5-7次,但是在做重复性实验时,建议还是使用新鲜配置的转膜液。因为重复用的转膜液导电离子增多,电流增大,相同时间转膜效率就会有差异。另外,电流大容易温度过高,影响胶和膜。
04 抗体稀释液
抗体稀释液是很容易被忽略的一个因素,不少小伙伴用的是TBST,或者商品化的稀释液。TBST只是缓冲液,商品化稀释液主要成分是BSA,浓度未知,也可能添加一些抗体稳定剂和防腐剂。我们建议是按照抗体说明书建议来选择,例如CST抗体,每支抗体都已经摸好条件了,直接follow就好了。如果抗体供应商没有明确要求,按照我们的经验,高表达的样本使用脱脂奶粉减少非特异结合,低表达的样本使用BSA。
05 内参
有一些研究表明,内参的灰度在较小的上样量(3-5ug)就达到了饱和。有一些小伙伴习惯用内参灰度去调整上样量,其实泳道内总蛋白量的差异比灰度差异更大一些。也有很多小伙伴说明明BCA测了,浓度也调整了,跑出来的内参还是不齐,这时建议可以使用总蛋白染色,比如考马斯,看下整体情况齐不齐。只有总蛋白齐了,才能准确地比较目的蛋白的变化情况,如果总蛋白都不齐,那么结果不一致也很正常。
总结
不同品牌的抗体或者相同品牌不同的抗体确实存在或多或少的差异,这给我们的研究工作的重复性带来很大的挑战。但是,小优细节君坚信,只要大家能意识到以上几点,并坚持做一些改变,就可以在日常工作中极大的提高抗体的可重复性。
参考文献:
1. Simpson K, Browning M. Antibodies That Work Again and Again and Again [J]. Methods Mol Biol, 2017:1554:41-59.
2. Algenas C, Agaton C, Fagerberg L, et al. Antibody performance in western blot applications is context-dependent. Biotechnol J, 2014, 9(3):435–445.
3. Kurien BT, Dorri Y, Dillon S, et al. An overview of Western blotting for determining antibody specificities for immunohistochemistry. Methods Mol Biol, 2011:717:55–67.
4. Husi H, Grant SG. Isolation of 2000-kDa complexes of N-methyl-d-aspartate receptor and postsynaptic density 95 from mouse brain. J Neurochem, 2001, 77:281–291.
5. Dittmer A, Dittmer J. Beta-actin is not a reliable loading control in Western blot analysis. Electrophoresis, 2006, 27(14):2844-5.