在2024年国家自然科学基金的中标项目统计中,细胞焦亡和外泌体均跻身前20大研究热点。细胞焦亡的最新研究为我们揭示了焦亡与外泌体之间的潜在联系,为深入探索细胞焦亡的机制带来了更多可能性。今天,小优为大家介绍两篇关于细胞焦亡与外泌体“碰撞”的热点研究,文章中呈现了很多精巧的实验设计和严谨的实验方法,值得我们仔细反复品读,内容较多大家可以先收藏哦!

2024年12月31日,康涅狄格大学健康中心免疫系Vijay A. Rathinam研究小组在Cell杂志上发表文章 Transplantation of gasdermin pores by extracellular vesicles propagates pyroptosis to bystander cells。这篇文章展示了细胞焦亡在细胞间传播的具体机制,并阐明了细胞外囊泡(EV)在其中发挥的重要作用。发生细胞焦亡的细胞释放的细胞外囊泡携带有GSDMD孔,并转移至旁观细胞的细胞质膜,诱发这些旁观细胞发生焦亡性死亡,揭示出一种支配疾病相关旁观细胞死亡新机制。这篇文章实验思路清晰,设计严谨,快来看下小优的解析吧!

一、体外和体内实验验证焦亡在细胞间传播
01.体外实验发现细胞焦亡在细胞间传播
首先作者先在体外细胞层面验证焦亡在细胞间传播,作者设计了两个实验:
(1)作者将CD45.1+ WT(野生型)骨髓来源巨噬细胞(BMDMs)和CD45.2+ Nlrp3-/- BMDMs进行共培养,在加入尼格霉素(NLRP3激活剂)进行处理后,CD45.2+ Nlrp3-/- BMDMs也出现了细胞死亡,它们的死亡并非尼格霉素的直接作用,而是由CD45.1+ WT BMDMs在尼格霉素诱导下发生细胞焦亡所引起的旁观细胞死亡。
(2)作者在Gsdmd-/- iBMDMs细胞中引入GSDMD-NT(GSDMD的N端)的质粒,再与不包含该质粒的细胞(iBMDMs-WT)进行共培养,当GSDMD-NT被诱导表达时,首先观察到iBMDM-iGSDMD-NT细胞发生焦亡,随后iBMDMs-WT细胞也发生旁观细胞死亡。
这些实验表明,细胞焦亡在体外可以引起旁观细胞死亡。
02.细胞焦亡在体内向旁观细胞传播
为了验证细胞焦亡在体内向旁观细胞传播,作者建立了三种小鼠体内研究模型:1)作者用表达AF647 标记 LPS的大肠杆菌腹腔注射感染野生型小鼠,并评估大肠杆菌AF647阴性腹膜细胞(即旁观细胞)中的细胞死亡情况;2)用Dox刺激的CellBrite488 标记的 iBMDM-iGSDMD-NT 细胞转移到野生型小鼠的腹腔中,并评估 CellBrite488 阴性腹膜细胞(即旁观细胞)中的细胞死亡情况;3)将FITC-LPS电穿孔处理的CD45.1+ BMDM 转移到同类 CD45.2+ Gsdmd -/- 小鼠的腹腔中,观察Gsdmd -/- 小鼠中的 CD45.2+ 腹膜细胞是否发生焦亡。在这些模型中,均观察到了焦亡细胞会引起小鼠体内的旁观细胞发生细胞死亡。这些实验表明,许多细胞类型在体内都会发生旁观者焦亡。
综上,细胞焦亡在体外和体内的多种细胞类型均能引发旁观细胞死亡。
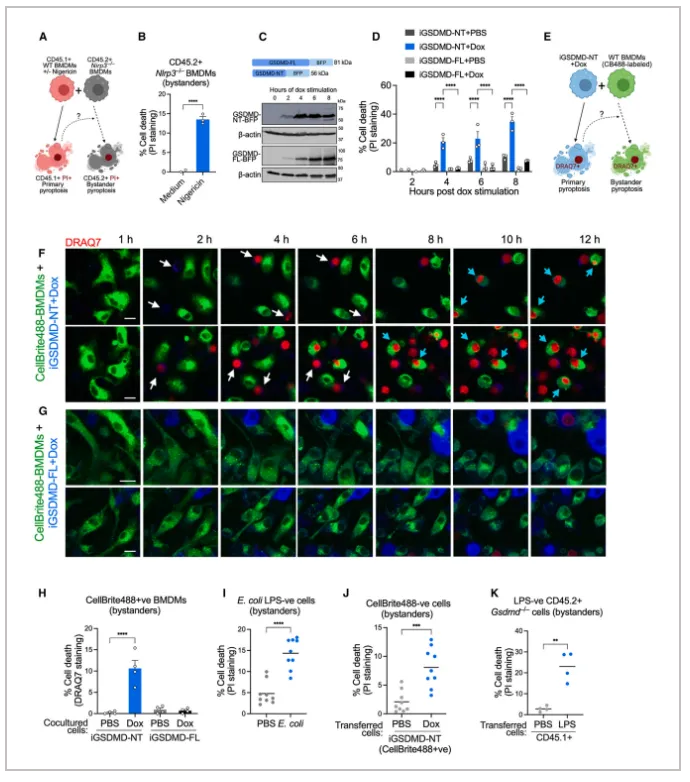 Figure 1. Intercellular propagation of pyroptosis occurs in vitro and in vivo
Figure 1. Intercellular propagation of pyroptosis occurs in vitro and in vivo
△点击放大图片
部分相关产品:
| 货号 | 名称 | 规格 | 应用 |
| 11437-5mg | Nigericin(sodium salt) | 5mg | NLRP3激活剂 |
| abs817331-5mg | Doxycycline(Dox) | 5mg | 生化试剂 |
| 7406S | DRAQ7™ | 1ml | 细胞染料 |
| abs9105-5mg | 碘化丙啶(PI) | 5mg | 染料 |
| 561871 | FITC Mouse Anti-Mouse CD45.1 | 100ug | 流式抗体 |
| 561874 | FITC Mouse Anti-Mouse CD45.2 | 100ug | 流式抗体 |
| 39754S | Gasdermin D (E9S1X) Rabbit mAb | 100T | WB抗体 |
| AAF-1003B | 4D-Nucleofector™ Core Unit | 1台 | 电转仪 |
二、焦亡细胞释放的细胞外囊泡(EV)介导旁观细胞死亡
01.细胞焦亡的细胞间传播不依赖于接触
接下来,作者继续验证细胞焦亡是以细胞间接触依赖性还是非细胞间接触依赖性的方式传播。iBMDM-iGSDMD-NT 细胞被接种在上层的transwell小室中,BMDM-WT细胞被接种在下层的transwell小室中。用Dox诱导iBMDM-iGSDMD-NT 细胞发生焦亡后,底部孔中的旁观者BMDM-WT细胞也发生焦亡。此外,使用Dox诱导iBMDM-iGSDMD-NT 细胞上清液也可以引起正常的BMDMs焦亡。由此表明,细胞焦亡是通过分泌因子在细胞间以非接触方式传播。
02.焦亡细胞释放的细胞外囊泡(EV)介导旁观细胞死亡
为了鉴定细胞焦亡上清液中诱导旁观细胞死亡的因素,作者使用凝胶过滤层析 (SEC) 对焦亡上清液进行了分离,并筛选了这些组分的活性。通过鉴定作者发现诱导细胞死亡的组分中富含细胞外囊泡(EV)。进一步实验表明,这些细胞外囊泡具有细胞裂解活性,并且可以诱发巨噬细胞,上皮细胞等多种细胞死亡。
作者又进行了动物实验验证,将焦亡细胞分泌的EV腹腔注射到Gsdmd-/-的小鼠体内,焦亡细胞分泌的EV而不是正常的EV会导致小鼠腹膜细胞死亡。此外,焦亡细胞分泌的EV上调了许多与细胞死亡和炎症相关的途径,例如焦亡、细胞因子风暴和急性期反应等。
综上,细胞焦亡的细胞间传播不依赖于细胞间的直接接触,而是通过细胞外囊泡介导。
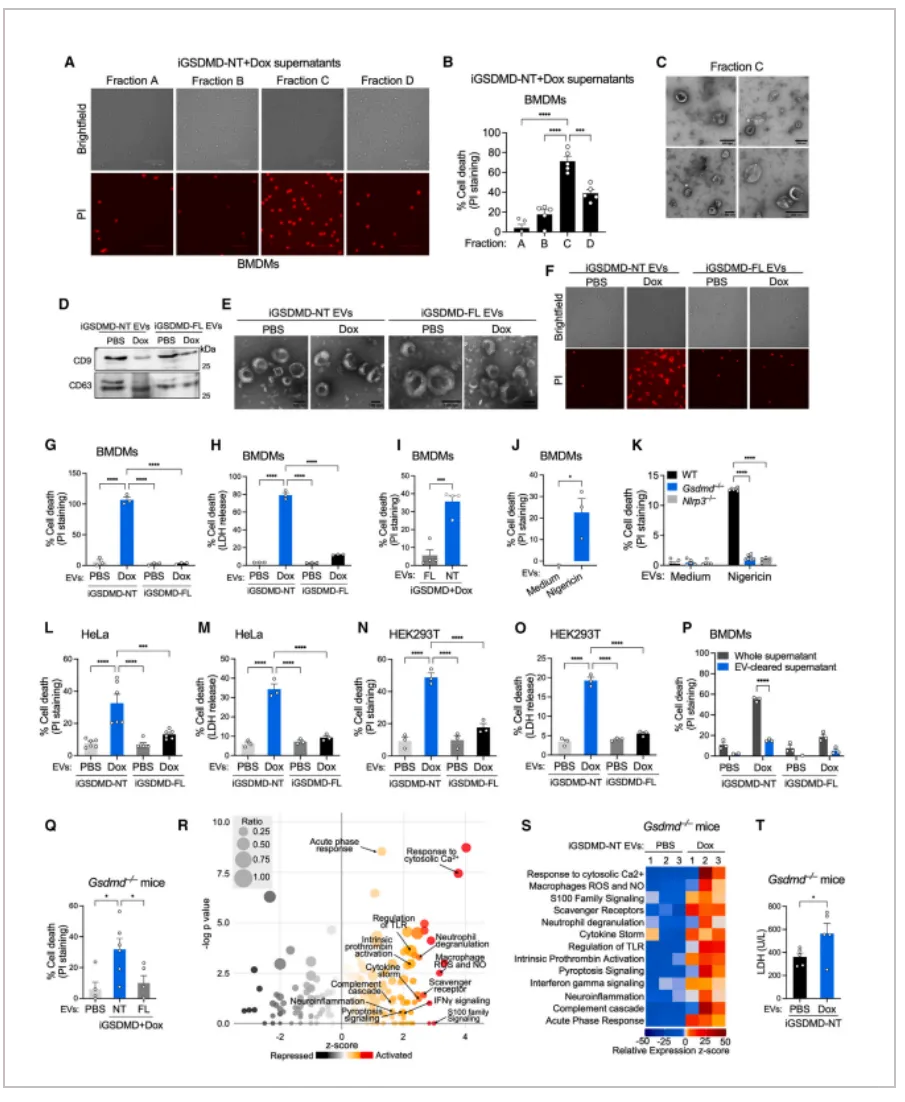
Figure 2. Pyroptotic EVs mediate cell-to-cell spread of pyroptosis
△点击放大图片
部分相关产品:
| 货号 | 名称 | 规格 | 应用 |
| 115-195-146 | 6nm Colloidal Gold-AffiniPure® Goat Anti-Mouse IgG (H+L) (min X Hu,Bov,Hrs,Rb,Sw Sr Prot) (EM Grade) | 0.5ml | 胶体金二抗 |
| 28990944 | Superdex 200 Increase 10/300 GL | 1根 | 凝胶过滤层析(SEC)柱 |
| 13174S | CD9 (D8O1A) Rabbit mAb | 100ul | WB抗体 |
| 52090S | CD63 (E1W3T) Rabbit mAb | 100ul | WB抗体 |
| abs580007-96T | Lactate Dehydrogenase (LDH)Microplate Assay Kit | 96T | 生化检测试剂盒 |
| abs520004-96T | Mouse IL-6 ELISA Kit | 96T | Elisa试剂盒 |
| abs520010-96T | Mouse TNF-α ELISA Kit | 96T | Elisa试剂盒 |
三、焦亡细胞分泌的EV将 GSDMD 孔移植到旁观细胞上并导致其死亡
01.焦亡的 EV 携带活性 GSDMD
接下来作者继续研究细胞焦亡的EV是如何在细胞间传播焦亡。作者对转入GSDMD质粒的细胞中的GSMDM用胶体金进行标记,然后用电镜检测成像,结果显示在焦亡细胞释放的EV上发现了标记的GSDMD。在体内 LPS 诱导的非典型炎症小体激活后,从血浆中纯化的 EV 也含有激活的GSDMD。体内实验也表明,焦亡细胞在体内释放的EV达到的水平可能足以导致大量旁观细胞死亡。
02.细胞焦亡EV将活性GSDMD转移旁观细胞并诱导旁观细胞焦亡
共聚焦显微镜检测到焦亡 EV 刺激的巨噬细胞中含有GSDMD信号,并且这些GSDMD信号主要位于受体细胞的质膜上。此外,在注射了 iGSDMD-NT-BFP EV 的 Gsdmd-/-小鼠的腹膜细胞也含有iGSDMD-NT-BFP,这些数据表明焦亡的 EV 将 GSDMD-NT 转移到旁观者中。此外,最低剂量的焦亡细胞EV也会显著杀死旁观细胞,而较高剂量的 EV会杀死更大比例的旁观细胞。这些数据表明,发生细胞焦亡的细胞释放的 EV 通过活性 GSDMD 触发旁观细胞焦亡。
03.GSDMD 以孔的形式存在于焦亡EV上
焦亡细胞和从中释放的EV的免疫电镜显示 GSDMD 染色在 EV 的外缘。与 GSDMD 在 EV 表面的定位一致,焦亡EV使用胰蛋白酶处理降低了 GSDMD 信号和旁观细胞死亡。此外,DSS 交联后免疫印迹发现焦亡EV包含有寡聚体状态的GSDMD。
为了精确确定焦亡 EV 上 GSDMD 的结构构象,iBMDM-iGSDMD-NT EV 和对照 EV 用抗tagBFP 纳米抗体DNA锚定链(tagBFPnb-DS) 染色,并使用 DNA-PAINT 超分辨率显微镜检测。GSDMD-NT-BFP 染色与 iBMDM-iGSDMD-NT EV 中的 DNA-PAINT 定位相关,与对照 EV 相比,iBMDM-iGSDMD-NT EV 中超分辨的 GSDMD-NT 结构密度更高。此外,作者也在 iBMDM-iGSDMD-NT EV 中可视化了环形、弧形和线形 GSDMD-NT 纳米结构。这些 EV 相关 GSDMD-NT 的弧形和环状结构在形状和大小上与在焦亡细胞质膜上观察到的结构相似,表明焦亡中存在功能性 GSDMD 结构。该结果表明 GSDMD 以孔的形式存在于焦亡细胞释放的 EV 上。
为了验证这一点,对焦亡的 EV用C12E8 去垢剂处理以提取 GSDMD 孔,提取物的后续免疫电镜检测显示GSDMD-NT孔状结构。这些数据表明焦亡的 EV 携带GSDMD孔构象。
04.焦亡EV将GSDMD 孔移植到旁观细胞并导致其发生细胞焦亡
考虑到焦亡 EV 上的 GSDMD 孔、焦亡 EV 处理的旁观细胞质膜上 GSDMD 的定位以及 EV 与受体细胞质膜融合的能力,作者猜测焦亡 EV 将 GSDMD 孔移植到旁观细胞质膜上,并导致其死亡。为了验证这一点,作者将来自 Dox 诱导的 iBMDM-iGSDMD-NT细胞的 EV 与包裹有6-羧基荧光素 (6-FAM) 染料的脂质体混合,并监测荧光染料的释放。来自 Dox 诱导的 iBMDM-iGSDMD-NT 细胞的 EV 导致脂质体中荧光染料的泄漏。二硫仑共价修饰 GSDMD-NT 的 Cys192会阻止 GSDMD-NT 片段插入和组装到膜上,但不影响预先存在的 GSDMD 孔。作者观察到使用二硫仑处理不会抑制 GSDMD-NT-EV 诱导的脂质体泄漏,表明GSDMD-NT 孔已存在于 EV 上。与此一致,用二硫仑预处理 EV 或受体细胞也不会影响焦亡 EV 诱导旁观细胞死亡的能力。
此外,作者将脂质体与含有 caspase-11的重组GSDMD 一起孵育,并纯化出含有 GSDMD 孔的脂质体。然后在二硫仑存在下将这些装载有 GSDMD 孔的脂质体与带有荧光的脂质体或正常的BMDM细胞一起孵育,以进一步测试这些GSDMD 孔是否可以从一个脂质双层移植到另一个脂质双层。结果表明,这些载有 GSDMD 孔的脂质体可以以对二硫仑不敏感的方式诱导脂质体荧光的泄漏和BMDM细胞的死亡。相比之下,如果仅外源添加游离活性 GSDMD 不会导致BMDM细胞死亡,这表明是与 EV相关的 GSDMD 孔而不是单体 GSDMD-NT 会导致旁观细胞焦亡。焦亡的 EV 可以通过将 GSDMD 孔插入其质膜中而旁观细胞死亡,而无需旁观细胞主动摄取 EV。焦亡的 EV 诱导的细胞死亡在用细胞松弛素 D 或拉特鲁库林 B 预处理以抑制 EV 内化的细胞中仍保持完整。这些实验表明,焦亡的 EV 将 GSDMD 孔移植到旁观细胞上,导致其死亡。
综上,作者通过多个实验证明,焦亡细胞分泌的细胞外囊泡是细胞焦亡传递的介质,焦亡细胞分泌的细胞外囊泡通过将携带的GSDMD孔移植到旁观细胞上,并导致旁观细胞发生焦亡。
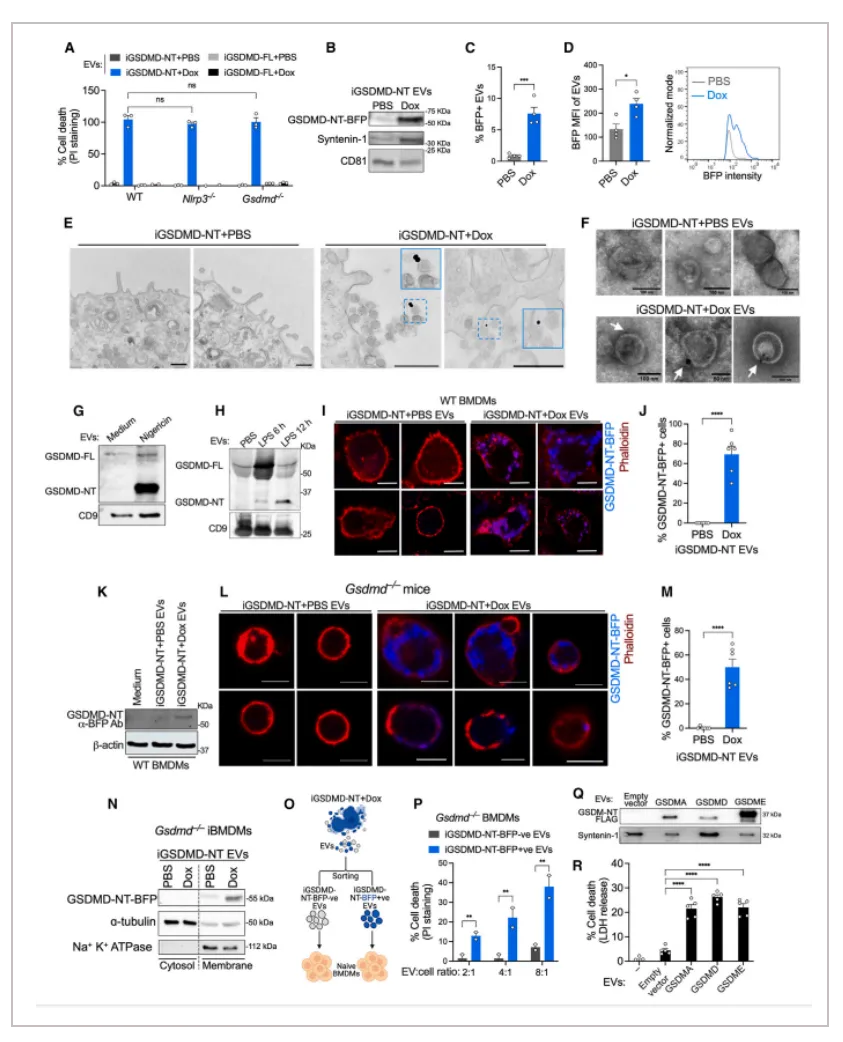
Figure 3. EVs released by pyroptotic cells kill bystander cells through GSDMD
△点击放大图片
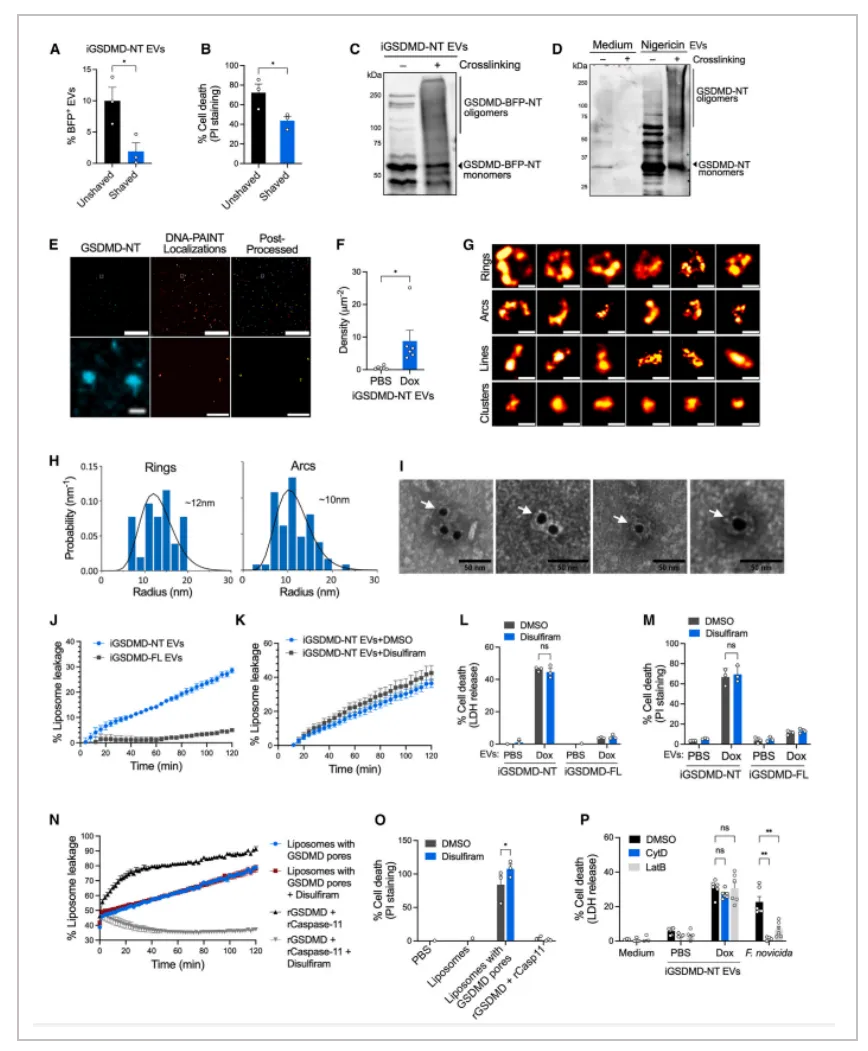
Figure 4. Pyroptotic EVs harbor GSDMD pores and transplant GSDMD pores on bystander cells
△点击放大图片
部分相关产品:
| 货号 | 名称 | 规格 | 应用 |
| 27964S | Syntenin-1/MDA9 (E2I9L) Rabbit mAb | 100ul | WB抗体 |
| 10037S | CD81 (D5O2Q) Rabbit mAb | 100ul | WB抗体 |
| NB300-146 | Mouse Monoclonal Sodium Potassium ATPase Alpha 1 Antibody | 0.05ml | Na,K-ATPase抗体 |
| abs42086317-5g | 双琥珀酰亚胺辛二酸酯(DSS) | 5g | 交联剂 |
| 15303-50g | Disulfiram(二硫仑) | 50g | 生化试剂 |
| abs42073371-5g | 辛乙烯二醇单正十二烷基酯(C12E8) | 5g | 去垢剂 |
| abs42218317-100umol | 6-FAM phosphoramidite | 100umol | 染料 |
| 11330-1mg | Cytochalasin D | 1mg | 生化试剂 |
| 10010631-1mg | Latrunculin B | 1mg | 生化试剂 |
文章总结:这篇文章从观察到焦亡细胞可以引起旁观细胞死亡这个现象开始,逐渐深入的研究引起这个现象的机制。首先,作者先验证了细胞焦亡不是通过细胞的接触传播的,通过对焦亡细胞的上清液进行分析,进一步研究发现焦亡细胞释放的细胞外囊泡介导旁观细胞的死亡。再继续研究细胞外囊泡,发现焦亡的EV携带活性的GSDMD并具有将活性GSDMS转移到旁观细胞的能力,焦亡的EV通过将GSDMD孔移植到旁观细胞并导致其发生细胞焦亡。这个机制的发现为理解焦亡引起的疾病的发生发展提供新的角度和治疗思路。
 文章总体思路和亮点
文章总体思路和亮点
△点击放大图片
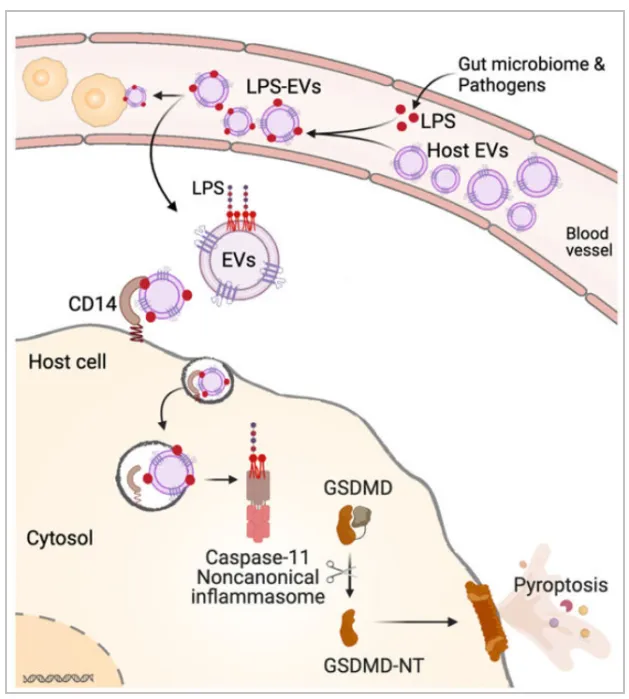
 在23年11月,来自康涅狄格大学健康医学院免疫学系的Vijay A. Rathinam教授团队也在Nature Cell Biology杂志上发表一篇关于外泌体引发细胞焦亡的文章:Host extracellular vesicles confer cytosolic access to systemic LPS licensing non-canonical inflammasome sensing and pyroptosis文章,报道了微生物产生的游离LPS通过宿主细胞外囊泡进入宿主细胞,并激活细胞的免疫反应和细胞焦亡。这篇文章中对焦亡和外泌体的研究方法很值得我们学习,我们也一起来看下这篇文章。
在23年11月,来自康涅狄格大学健康医学院免疫学系的Vijay A. Rathinam教授团队也在Nature Cell Biology杂志上发表一篇关于外泌体引发细胞焦亡的文章:Host extracellular vesicles confer cytosolic access to systemic LPS licensing non-canonical inflammasome sensing and pyroptosis文章,报道了微生物产生的游离LPS通过宿主细胞外囊泡进入宿主细胞,并激活细胞的免疫反应和细胞焦亡。这篇文章中对焦亡和外泌体的研究方法很值得我们学习,我们也一起来看下这篇文章。

01.宿主细胞外囊泡(EV)捕获 LPS
为了验证宿主来源的细胞外囊泡(EV) 是否与 LPS 结合,作者给小鼠腹膜内注射 PBS 或 LPS,并通过超速离心从血浆中分离 EV。通过纳米跟踪分析验证 EV 的尺寸分布,通过免疫印迹验证 EV 标记物 (CD9 和 CD63),并通过透射电镜 (TEM) 验证EV形态。通过Limulus Amebocyte Lysate (LAL) 和 HEK-Blue TLR4 reporter cell assays检测LPS,结果表明,从LPS 注射小鼠而非 PBS 注射小鼠获得的 EV 中存在大量 LPS。
为了进一步确认和可视化 EV 中的 LPS,作者将从注射了生物素标记的LPS 或 PBS 的小鼠血浆中分离出的 EV 用链霉亲和素胶体颗粒染色并进行 TEM电镜观察。结果表明从注射了生物素-LPS 的小鼠中分离出的 EV 上含有 LPS 染色,从注射了 LPS 的 Casp11 −/− 小鼠中分离出的 EV 也含有 LPS,这表明 EV 与 LPS 的结合不是 LPS 诱导的非典型炎症小体活化和细胞焦亡的结果。作者又进一步在各种体外和体外条件下测试了 EV 与 LPS 的结合,这些数据表明 LPS 结合能力是血浆和细胞培养来源的 EV 所固有的和共同的。
综上,宿主来源的细胞外囊泡会捕获LPS。
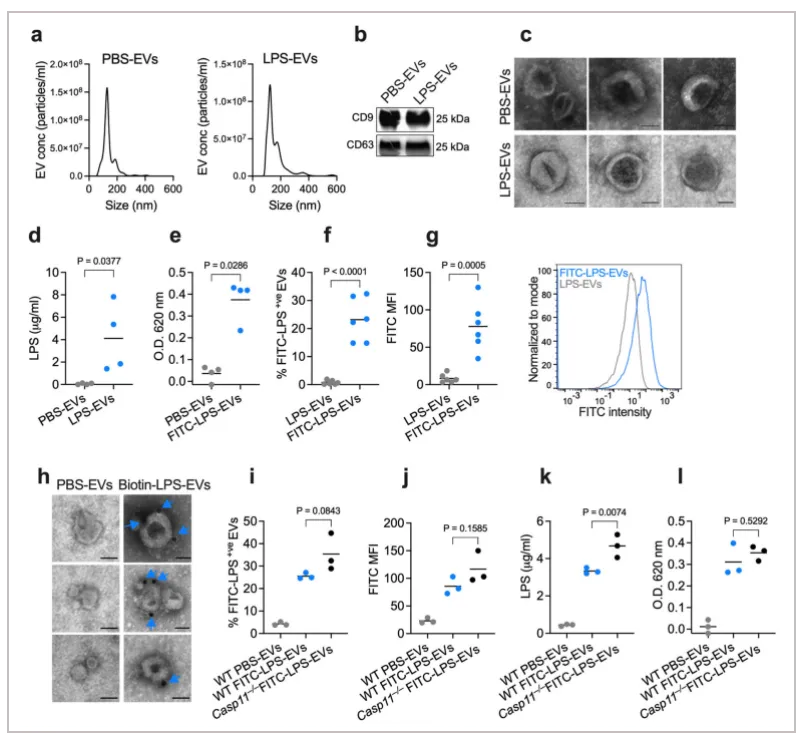
Fig. 1: Circulating host-derived EVs capture LPS
△点击放大图片
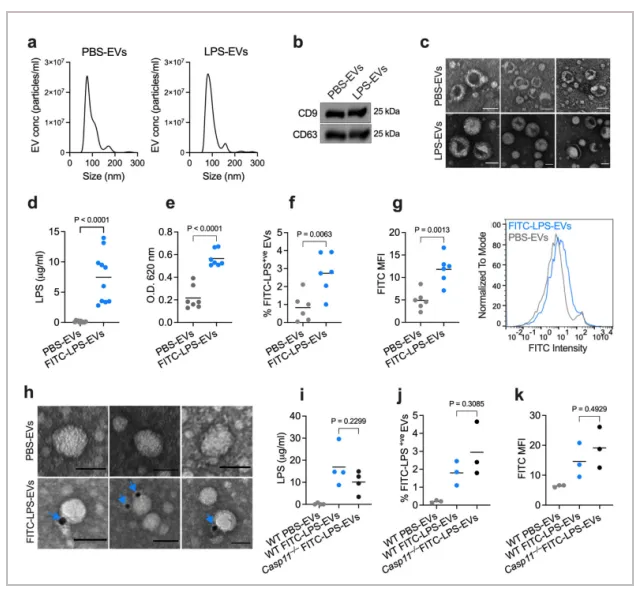
Fig. 2: Host-derived EVs bind LPS in vivo.
△点击放大图片
部分相关产品:
| 货号 | 名称 | 规格 | 应用 |
| abs42020800-10mg | 脂多糖(LPS) | 10mg | 生化试剂 |
| 115-195-146 | 6nm Colloidal Gold-AffiniPure® Goat Anti-Mouse IgG (H+L) (min X Hu,Bov,Hrs,Rb,Sw Sr Prot) (EM Grade) | 0.5ml | 胶体金二抗 |
| 016-400-084 | 40 nm Colloidal Gold-Streptavidin | 1ml | 胶体金链霉亲和素 |
| abs42155612-500g | 聚乙二醇 | 500g | 用于外泌体提取 |
| MAP100C37-Cytiva(GELife) | Macrosep ADV Omega 100k 24pk | 24根 | 超滤管用于外泌体提取 |
| abs47050864-1kg | 蔗糖 | 1kg | 用于外泌体提取 |
| 17372411 | HiTrap 5x1ml Capto Core 400 | 5*1ml | 外泌体提取SEC纯化柱 |
| 17553002 | Cytiva super SEC resin | 100ml | 外泌体提取SEC纯化柱(新品) |
02.EV 将 LPS 转移到髓系细胞和内皮细胞胞质中
作者进一步验证LPS和EV的结合是否会有助于LPS进入细胞质。游离的LPS不会在体外直接转移进入骨髓衍生巨噬细胞(BMDM)的细胞质中,而从 LPS-EVs 处理的 BMDM 中提取的细胞质中检测到了大量的 LPS,但从 PBS-EVs 或游离 LPS 处理的 BMDM 中提取的细胞质中没有检测到。电镜检测也发现在用 FITC-LPS-EVs 处理的细胞中,无细胞器和膜区域的细胞内观察到LPS 染色,但在用 FITC-LPS 或 PBS-EVs 处理的细胞中没有检测出。
作者继续做体内实验验证。Casp11 −/− 小鼠注射了 FITC-LPS-EVs 或 PBS-EVs,并从脾髓系细胞中提取了细胞质。LAL 测定显示,从注射 FITC-LPS-EVs 的小鼠中分选出的脾髓系细胞的细胞质中存在 LPS。此外,在接受 FITC-LPS-EVs 的小鼠的腹腔细胞中也观察到了 LPS。从接受 FITC-LPS-EVs 的小鼠脾脏中分离的内皮细胞的成像和生化分析显示,EVs 还将 LPS 输送到内皮细胞中。这些数据表明,载有 LPS 的 EVs 将 LPS 输送到髓系细胞和内皮细胞的胞质中,髓系细胞和内皮细胞是脓毒症期间感知胞质 LPS 的关键细胞类型。
综上,细胞外囊泡会介导LPS向宿主细胞的细胞质转移。
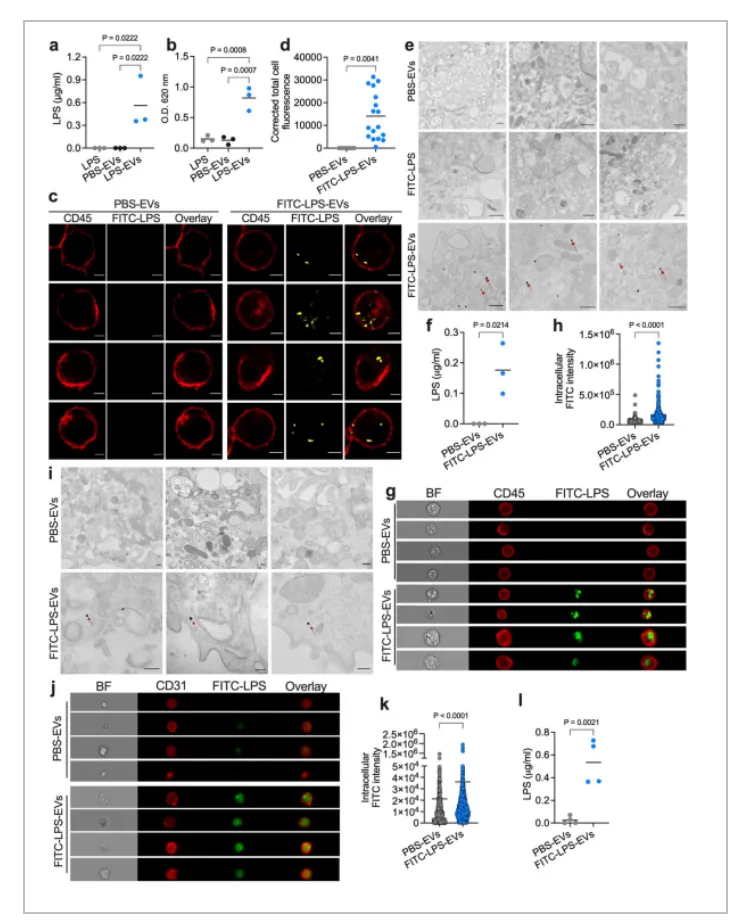
Fig. 3: Cytosolic delivery of LPS by host-derived EVs
△点击放大图片
部分相关产品:
| 货号 | 名称 | 规格 | 应用 |
| 13174S | CD9 (D8O1A) Rabbit mAb | 20/100ul | WB抗体 |
| 52090S | CD63 (E1W3T) Rabbit mAb | 20/100ul | WB抗体 |
| 24232 | Caspase-1 (E2Z1C) Rabbit mAb | 20/100ul | WB抗体 |
03.EV 向细胞浆输送 LPS 可激活 caspase-11 和 GSDMD
和游离 LPS 对照,EV 相关的 LPS 以 EV 剂量依赖性方式在 BMDM 中和人类 THP1 单核细胞中触发 GSDMD 裂解和细胞焦亡。值得注意的是,LPS-EVs 仅在WT巨噬细胞中诱导 GSDMD 活化、细胞焦亡以及 caspase-1 和 IL-1β 激活,而在 Casp11 −/− 巨噬细胞中不会发生。此外,LPS-EVs 也可以诱导 Nlrp3 −/− 和 Aim2 −/− 巨噬细胞以及 RAW 巨噬细胞中的 GSDMD 激活和细胞焦亡。这些数据表明 LPS-EVs 在体外激活了巨噬细胞中的非典型炎症小体。
接下来,作者评估了携带 LPS 的 EV 是否能够在体内引发炎症反应。将使用凝胶过滤层析SEC 分离的 PBS-EV 或 LPS-EV 注射到 WT 小鼠体内,并检测炎症小体反应。结果表明,LPS-EV 而非 PBS-EV 诱导了脾脏和肝脏中的 GSDMD 裂解、IL-18 和 IL-1β 分泌到血浆中以及 DAMP(IL-1α and galectin-1)的释放。此外,超速离心分离的 LPS-EV 而非 PBS-EV 也诱导了 IL-18 和 IL-1β 分泌到血浆中。值得注意的是,从注射 LPS 的 WT 和 Casp1 −/−Casp11 −/− 小鼠中分离出的 EV 在 WT 受体小鼠中也引发了类似的 IL-18 和 IL-1β 反应。
鉴于没有缺乏 EV 的突变小鼠,作者使用 GW4869(一种常用的 EV 产生抑制剂)来降低循环 EV 水平并评估其对LPS引起的细胞内炎症产生的影响。结果表明,GW4869处理的小鼠的脾脏髓样细胞和腹膜灌洗细胞中的 LPS 细胞内定位减少,GSDMD、IL-18 和 IL-1β 的全身激活也受到损伤。此外,使用 GW4869处理可改善 Tlr4 −/− 小鼠中 LPS 诱导的致死率,但不会影响 Casp11 −/− 小鼠的生存率。另一种 EV 抑制剂 nexinhib20也降低了小鼠对 LPS 的非典型炎症小体反应。外源性 LPS-EV 可挽救 GW4869处理小鼠中的非典型炎症小体反应。这些数据共同表明 EV 可能参与体内 LPS 的细胞质感应。
综上,细胞外囊泡将LPS转移至宿主细胞的细胞质并引发宿主细胞发生炎症反应和细胞焦亡。
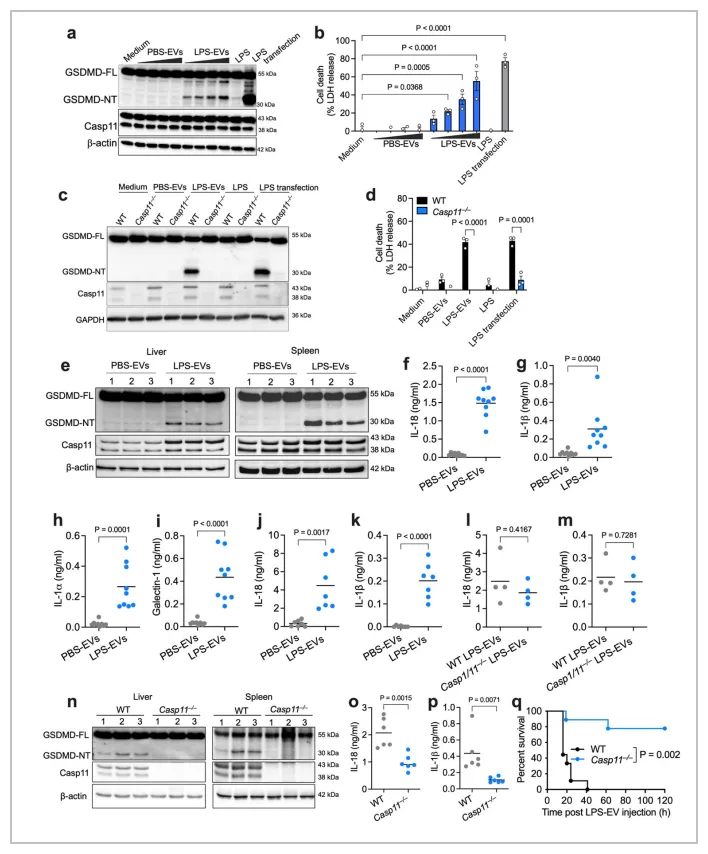
Fig. 4: EV-mediated cytosolic LPS delivery activates the noncanonical inflammasome
△点击放大图片
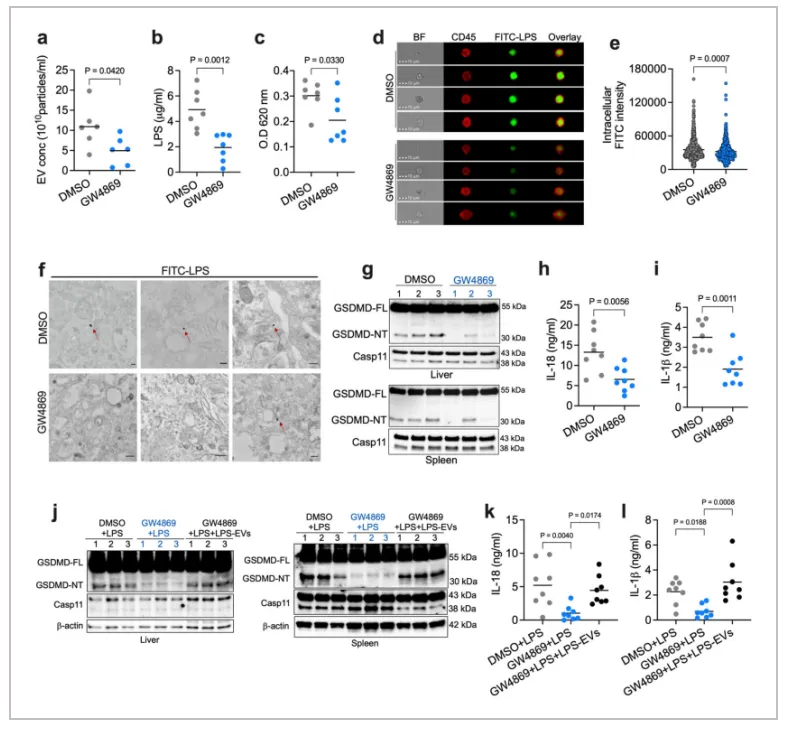
Fig. 5: The effect of EV depletion on intracellular LPS sensing
△点击放大图片
部分相关产品:
| 货号 | 名称 | 规格 | 应用 |
| 39754S | Gasdermin D (E9S1X) Rabbit mAb | 100T | WB抗体 |
| 14340 | Caspase-11 (17D9) Rat mAb | 20/100ul | WB抗体 |
| abs580007-96T | Lactate Dehydrogenase (LDH)Microplate Assay Kit | 96T | 生化检测试剂盒 |
| AF-401-NA | mIL-1b Aff Pur PAb (100 ug) | 100ug | WB抗体 |
04.CD14通过EV介导LPS 细胞内转移
载有 LPS 的 EV 如何在细胞内传递 LPS?受体介导的内吞作用是 EV 内化的常见模式,有助于其货物在细胞内的转移。CD14 是一种 TAXI(与炎症执行相关的转运蛋白)蛋白,可结合 LPS 并驱动 TLR4-MD2 复合物的内吞作用。作者观察到FITC-LPS-EV 与 CD14 的共定位以及 FITC-LPS-EV 的细胞摄取。此外,WT 和 Cd14 −/− 小鼠注射了 FITC-LPS-EVs,并通过生化、成像和胶体金 TEM 测定检查了 LPS 在脾脏髓系细胞中的胞浆定位。所有这些测定都表明 Cd14 −/− 髓系细胞中 LPS 的胞浆定位减少,Cd14 −/− 小鼠中 LPS-EVs 对 caspase-11 的激活受损,GSDMD 激活减少以及 IL-18、IL-1β、IL-1α 和半乳糖凝集素-1 释放减少。总体而言,这些数据清楚地表明 CD14 介导 EV 促进的 LPS 细胞质转移。
综上,细胞外囊泡将LPS转移至宿主细胞的细胞质受到CD14介导。
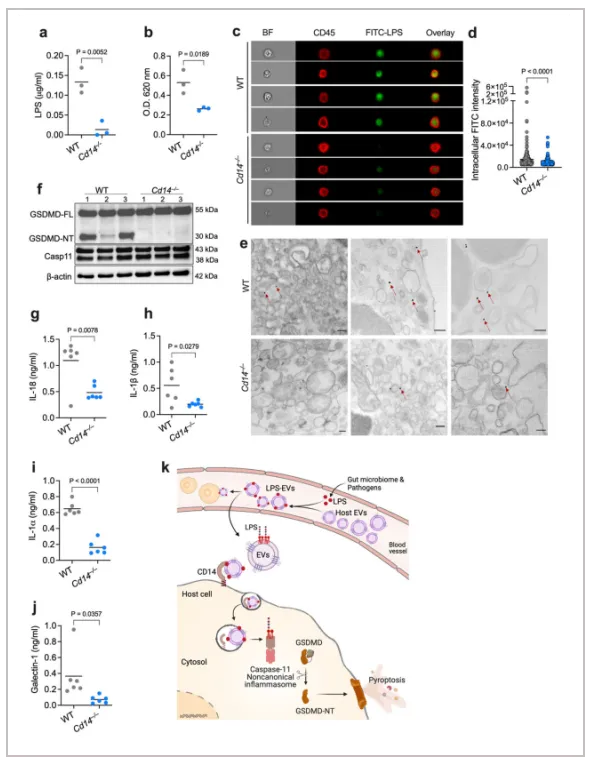
Fig. 6: EV-mediated cytosolic delivery of LPS is CD14-dependent
△点击放大图片
部分相关产品:
| 货号 | 名称 | 规格 | 应用 |
| 50794 | IL-1alpha (D4F3S) Rabbit mAb | 20/100ul | WB抗体 |
| 12936 | Galectin-1/LGALS1 (D608T) Rabbit mAb | 20/100ul | WB抗体 |
| 57058 | IL-18 (E8P5O) Rabbit mAb | 20/100ul | WB抗体 |
文章总结:在体内平衡和感染期间,对全身微生物成分的细胞内影响宿主的生理和免疫。作者在这篇文章中展示了宿主分泌的细胞外囊泡 (EV) 在此过程中的作用:血浆和细胞培养分泌的EV具有结合细菌脂多糖 (LPS) 的内在能力。循环宿主 EV 在体内捕获血源性 LPS,而载有 LPS 的 EV 为 LPS 提供了细胞溶质通道,从而引发非典型炎症小体激活 GSDMD 和细胞焦亡。这项研究表明,EV 捕获并护送全身 LPS 至细胞质,从而引发炎症小体反应,揭示了 EV 是系统性微生物配体与细胞内监视之间先前未被认识的联系。
文章总体思路
△点击放大图片