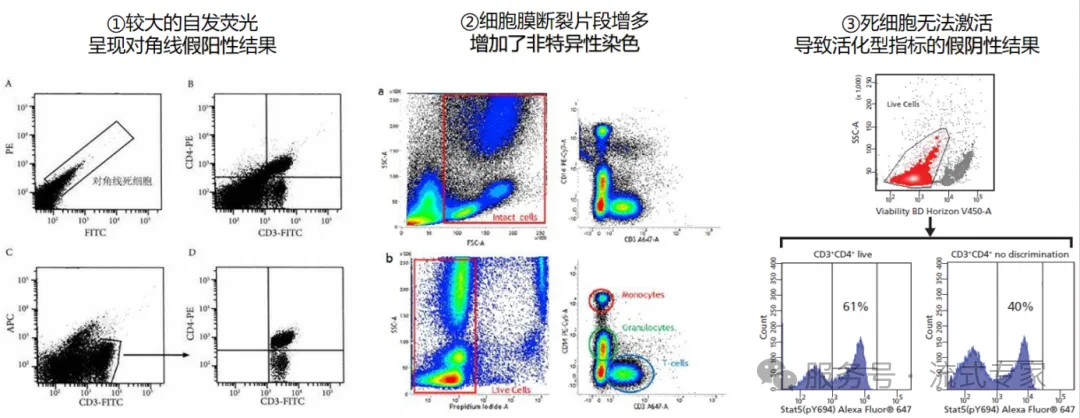
常规操作中的,离心、洗涤等步骤就会产生少量死细胞,如果样本本身就是一些细胞活性较差的来源,如非免疫类的组织制备的细胞悬液,病人或长时间放置的血液样本,做细胞培养或模型诱导的体外培养的细胞样本,那细胞活性就更差,因此推荐大家做流式实验的时候,尽量都不要省去死活染料的搭配。
常见的死活染料有两大类,一类是核酸染料,一类是氨基染料。
△点击放大图片
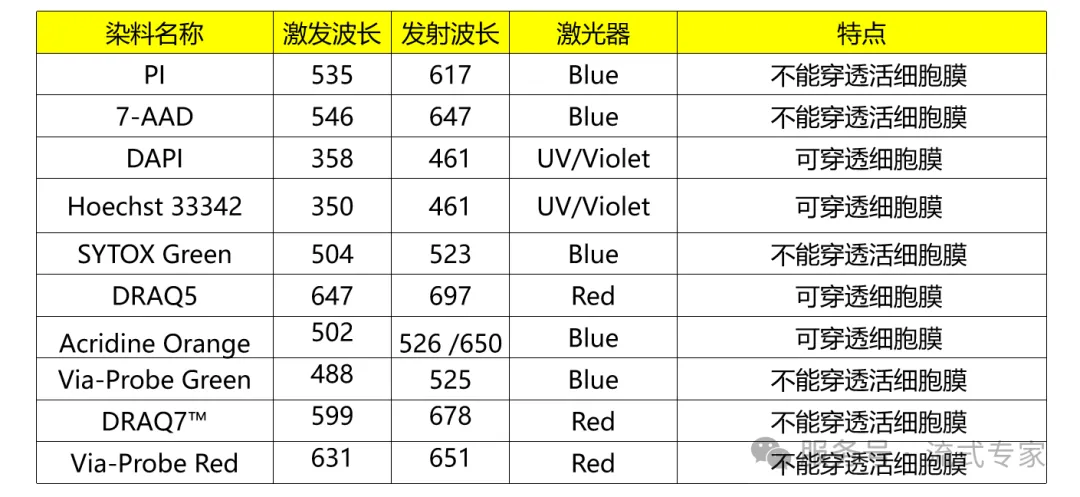
01核酸染料

△点击放大图片
△点击放大图片
操作步骤和注意事项
1. 按常规流式染色流程,完成表面染色后;
2. 在1×10^6细胞 的100 µl细胞悬液中,加入适量核酸类死活染料,轻摇混匀;
3. (7-AAD: 5 µl, 50 µg/ml;PI: 10 µl, 50 µg /ml;DAPI: 0.5~2 µl, 1 mg/ml;其他染料也请按照说明书推荐用量并结合预实验摸索最佳染料用量)
4. 避光室温孵育5 min;
5. 1 h内进行流式上机检测。
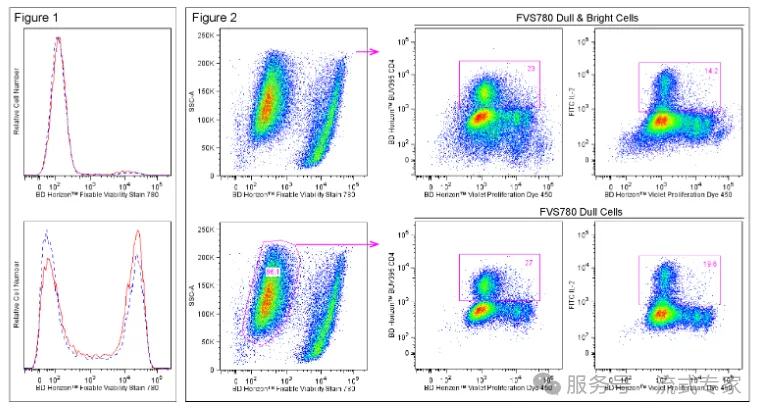
02氨基染料Fixable Viability Dye
△点击放大图片
△点击放大图片
氨基结合染料(FVS系列荧光染料)
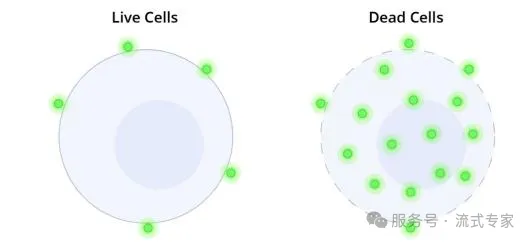
这一类染料是与蛋白质发生共价反应的,那他们结合之后在流式图上的展示就是死细胞是强阳性,活细胞呈现弱阳性。因为这一类染料会与活细胞表面的极少部分的胺相结合,会与死细胞内部更多的胺相结合,所以我们可以根据阳性信号的强弱进行区分
①碧迪家族
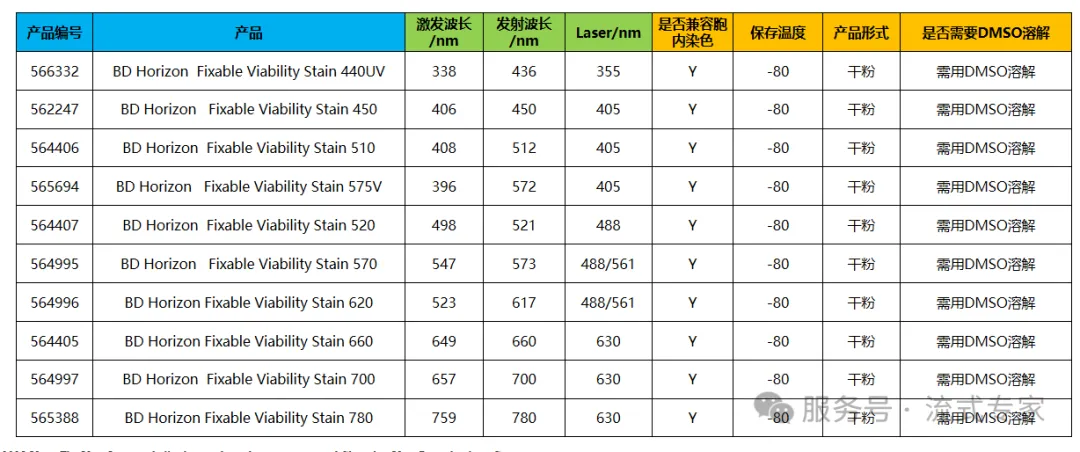
△点击放大图片
②Thermo家族
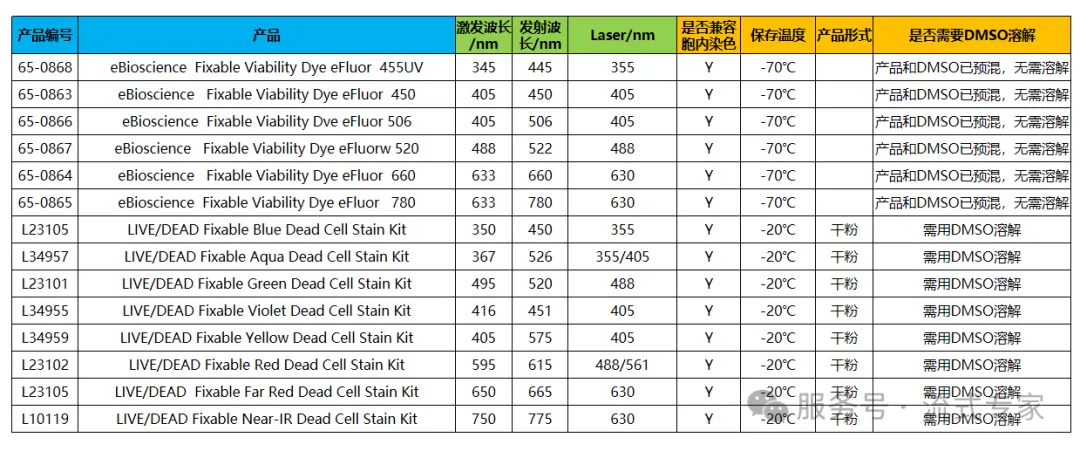
△点击放大图片
③Beckman Coulter+BioLegend家族
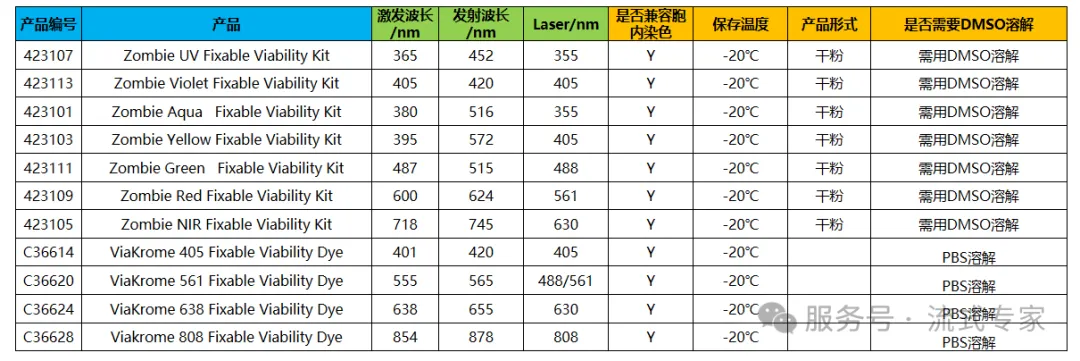
△点击放大图片
核酸染料 VS 氨基染料区别

△点击放大图片
操作步骤和注意事项
1.使用前,先将染料粉末,请根据说明书中的“Preparation”部分所写的体系,使用细胞培养级别的DMSO,对粉末在室温条件下,进行充分涡旋溶解;
2.使用不含叠氮化钠和不含蛋白质/血清的 Dulbecco 磷酸盐缓冲液(1X DPBS),清洗细胞一次;
3.在无叠氮化钠和无蛋白质/血清的1X DPBS中以 1-10x10^6 个细胞/ml重悬细胞;
4.每 1 ml 细胞悬液 (1:1000) 加入 1 μl 溶解后的FVS死活染料,涡旋混匀;
5.注意:我们建议滴定染料以获得最佳性能,因为不同的细胞类型和不同的应用可能会导致染色的可变性程度很大
u .推荐避光室温下孵育 10~15 min(可选:37°C 孵育 5~7 min或 2-8°C 孵育 30~60 min);
u 用 2 ml BD 的Stain Buffer(Cat. 554656)或替代物(如含1-2%血清的PBS等)洗涤离心收集细胞两次;
u 用Stain Buffer或替代物重悬细胞;
u 根据下游应用的需要,按常规流式染色流程对细胞进行FCR阻断、表面染色、固定破膜及胞内染色等。
实验注意事项:
1.FVS胺基类死活染料,收到时为粉末状,于-80℃长期保存;工作液需用DMSO充分涡旋溶解,分装成小份,保存于-20℃,避免反复冻融(溶解前建议先将试剂管,放于离心离心机离心,以确保试剂聚集在管底);溶解后理论保存期限为90天。
2.FVS胺基类死活染料,染色前细胞染色缓冲液中不能含有血清,避免中和掉死活染料导致假阴性;染色后的洗涤液中需包含有血清,中和掉未结合的死活染料。
3.核酸类死活染料4℃保存,不能冻存。
4.核酸类死活染料染色后,避免洗涤,剧烈涡旋或过度用力吹打, 避免核酸类死活染料染料的脱落,导致假阳性。
5.核酸类死活染料染色后,需及时上机(1h内),避免染料的毒副作用导致额外的死细胞产生。
好消息!抗体促销火热进行中~小优为您提供免费配色方案优化,让您的实验更出彩!
如需设计/优化配色,可点击“流式配色服务”提交配色需求





